Анализ крови на амг — антимюллеров гормон
Анти-Мюллеров гормон (АМГ) — гликопротеин, вырабатывается клетками гранулезы яичников (у женщин) или клетками Сертоли (у мужчин). АМГ участвует в нормальном развитии внутренних половых органов у мужчин на этапе эмбриогенеза, вызывая редукцию Мюллеровых протоков. У женщин участвует в формировании доминантного фолликула. Уровень АМГ в крови в течение цикла не имеет значительных колебаний.
Анализ крови на АМГ в комплексе с ингибином В и ФСГ применяют для оценки овариального резерва у женщин, с целью определения тактики лечения при бесплодии и в качестве контроля ответа на примуляцию овуляции. Отдельно анализ на АМГ применяют для диагностики синдрома поликистозных яичников. Также уровень АМГ резко увеличивается при гранулезоклеточных опухолях.
Общая информация
В норме ингибирующее вещество Мюллера продуцируется в клетках яичников. Название этому веществу было дано за его способность препятствовать развитию эмбриона по женскому типу. Пол ребенка закладывается во время зачатия, но в первые 6 недель у зародыша имеются зачатки женских и мужских половых структур. Изначально зародыш формируется по женскому типу. Из Мюллерова протока развивается женская половая система. В определенный момент происходит разрушение Вольфова протока.
Если имеются подавляющие факторы, развитие эмбриона идет по другому пути. Мюллеров проход разрушается, а из Вольфова формируется мужская половая система. Одним из факторов, которые определяют развитие будущего ребенка по мужскому типу, является MIS. Его выработка начинается на 7-й неделе беременности. Этот гормон подавляет развитие женских половых структур.
Гормон играет важную роль и после рождения ребенка. Он отвечает за опускание яичек. Если показатели АМГ не соответствуют норме, развивается крипторхизм. Такая проблема, как задержка опускания яичек, широко распространена. Как свидетельствует статистика, эта патология встречается у 5% доношенных детей и у 30% недоношенных мальчиков.
На протяжении жизни концентрация АМГ меняется. При рождении у мальчиков уровень этого гормона невысокий. Он повышается к полугодовалому возрасту, а затем опять снижается, и к моменту взросления достигает своего минимума. У девочек концентрация АМГ повышается только в период полового созревания, при рождении в норме он не определяется.
Во взрослом организме гормон также выполняет ряд важных функций. У женщин он участвует в созревании фолликула, а у мужчин – в регуляции синтеза андрогенов. Повышенная концентрация АМГ у женщин может быть признаком синдрома поликистозных яичников (СПКЯ).
Интерпретировать результаты анализа, ставить диагноз и при необходимости назначать лечение может только врач.
АМГ — Женская амбулатория Lady
Антимюллеров гормон (АМГ) имеет одно из наиболее важных значений для нормального функционирования репродуктивной функции организма. Гормон вырабатывается и в женском, и в мужском организме, но выполняет разные функции. Лабораторная диагностика крови на содержание АМГ актуальна в случаях, когда устанавливается причина бесплодия. Также этот анализ назначается при подготовке к ЭКО.
Определение уровня гормона АМГ применяется гинекологами для оценки овариального резерва женского организма, а также выступает маркёром тестикулярной функции у мужчин.
Лабораторное исследование, определяющее уровень АМГ в крови, называется «Расширенный Efort-Тест». Он назначается в следующих случаях:
- высокий уровень ФСГ,
- подозрение на бесплодие, причины которого не выяснены,
- неудачные попытки проведения процедуры ЭКО или подготовка к ней,
- контроль результатов проводимой антиандрогенной терапии,
- подтверждение диагноза «поликистоз яичников»,
- выявление опухолей яичников;
- определение причин нарушений в процессе полового созревания подростков.

Забор крови для определения уровня АМГ может быть произведен в любой день менструального цикла (колебания показателей в разные дни цикла незначительны), однако оптимально сдавать анализ на 3-5 сутки цикла, это позволит получить более точный результат.
У женщин норма антимюллерова гормона зависит от возраста, например, в 20-30 лет она составляет 4-6,8 нг/мл. В зависимости от особенностей организма допустимы значения 2,2-4 нг/мл, которые также считаются нормой при отсутствии жалоб со стороны пациентки.
Подготовка к сдаче анализа довольно проста:
- за 3 суток нужно избегать интенсивной нагрузки (в том числе активных тренировок),
- накануне обязательно исключить вредные привычки,
- нежелательно испытывать стресс.
Отложить посещение лаборатории нужно и в случае недавно перенесённого гриппа, ОРВИ или любого другого инфекционного заболевания. Помните, что от полученных результатов анализа зависит определение схемы лечения, ее эффективность.
Наша лаборатория использует технологии последнего поколения, что дает возможность проводить исследования в автоматическом режиме и предоставлять пациентам результаты в кратчайшие сроки. Современные реактивы и оборудование позволяют в короткие сроки достоверно определить уровень гормона АМГ и назначить соответствующее лечение.
Снижение овариального резерва | Балтийский институт репродуктологии человека (БИРЧ)
Овариальный резерв – это показатель индивидуального запаса яйцеклеток в яичнике, который закладывается у каждой женщины еще до рождения. К моменту рождения девочка имеет в яичниках 5 — 7 миллионов яйцеклеток. К наступлению первой менструации остается уже 300 – 500 тысяч яйцеклеток. И далее в течении всего репродуктивного периода женщина только «теряет» свои яйцеклетки при каждой овуляции.
Вопреки распространенному представлению, что в менструальный цикл расходуется только одна яйцеклетка, выяснено, что в каждом менструальном цикле запускается в рост несколько десятков яйцеклеток, а овулирует действительно, как правило, только одна. Остальные погибают.
Остальные погибают.
О чем говорит сниженный овариальный резерв
Сниженный овариальный резерв говорит о том, что у женщины заметно уменьшился запас яйцеклеток в яичнике и вероятность забеременеть понижена. При этом надо учитывать, что каждому биологическому возрасту соответствует свой овариальный резерв. Поэтому биологический возраст не всегда соответствует фактическому: может как «отставать», так и «перегонять» его.
Анализ на овариальный резерв – это получение информации о запасе яйцеклеток, находящихся в яичнике женщины к определенному возрасту.
ЭКО и низкий овариальный резерв
С уменьшением запаса яйцеклеток уменьшаются и шансы на успешный результат ЭКО. При этом для наступления беременности может потребоваться 3- 5 и даже больше попыток. При оформлении ЭКО по ОМС есть нижняя граница анализа на овариальный резерв, при которой в ЭКО за счет медицинского страхования может быть отказано – это показатель антимюллерового гормона (АМГ) менее 1 нг/мл.
Как определить овариальный резерв женщины? Какие нужны анализы?
Анализ крови на АМГ
АМГ расшифровывается как Антимюллеров гормон. Диагноз сниженный овариальный резерв ставится на основании результатов лабораторного и анализа уровня АМГ в крови при подготовке женщины к вступлению в протокол ЭКО. Уровень антимюллерового гормона – это показатель овариального резерва. АМГ вырабатывается в яичнике и «запускает» рост фолликулов. Наиболее высокие показатели АМГ наблюдаются в репродуктивном периоде жизни женщины: 2 – 7 нг/мл. После 37 лет и далее с падением запаса фолликулов в яичнике уровень АМГ начинает снижаться. При показателе ниже 1 нг/мл говорят о низком овариальном резерве.
Определение овариального резерва с помощью УЗИ
Фолликулы — это мелкие пузырчатые образования, в которых растет и развивается яйцеклетка . Эти фолликулы видны при специальном ультразвуковом исследовании. По количеству фолликулов, начинающих рост в каждом менструального цикла можно судить об овариальном резерве у женщины. Если число крупных полостных фолликулов составляет 8-12 считается, что у женщины хороший овариальный резерв и шансы забеременеть высокие. При их меньшем количестве шансы забеременеть снижаются.
По количеству фолликулов, начинающих рост в каждом менструального цикла можно судить об овариальном резерве у женщины. Если число крупных полостных фолликулов составляет 8-12 считается, что у женщины хороший овариальный резерв и шансы забеременеть высокие. При их меньшем количестве шансы забеременеть снижаются.
Каковы причины снижения овариального резерва яичников?
- 1 Естественная возрастная причина: прогрессивная убыль фолликулов в процессе жизни и регулярных овуляций. После полного расхода яйцеклеток наступает период менопаузы и климакса.
- 2. Генетические причины.
Индивидуальный запас яйцеклеток определяется наследственностью. Поэтому некоторые женщины менструируют и даже беременеют до возраста 50 лет. А у некоторых менопауза и климакс начинаются уже вскоре после 30 лет (преждевременная менопауза).
- 3. Медицинское вмешательства
Все хирургические операции на яичниках и органах половой системы женщины: матки маточных трубах, яичниках.
Из токсических влияний в первую очередь имеют значения лекарственные препараты. Но не маловажное влияние имеют и вредные внешние факторы среды и питания.
- 4. Курение женщин
Установлено, что курение ведет к снижение овариального резерва и более раннему наступлению климакса у женщин.
Состояние овариального резерва у женщин с сахарным диабетом 1 типа в репродуктивном периоде | Григорян
Несмотря на значительное улучшение прогноза для жизни и здоровья больных сахарным диабетом 1 типа (СД1) за последние десятилетия, такие пациенты по-прежнему входят в группу риска по раннему формированию микро- и макрососудистых осложнений, приводящих к поражению периферических артерий, развитию сердечно-сосудистых и цереброваскулярных заболеваний, прогрессированию хронической болезни почек [1]. Очевидно, что во многом повышение риска связано с метаболическими нарушениями, характерными для СД1 (гипергликемия, гиперлипидемия и др.), однако степень его увеличения не может объясняться лишь этими факторами. Более того, известные гендерные различия в частоте сердечно-сосудистых заболеваний (значимо большая частота у мужчин) у больных СД1 выражены значительно меньше по сравнению с субъектами из общей популяции. Раннее развитие сердечно-сосудистых заболеваний – не единственное проявление ускоренного старения у больных СД1. К другим проявлениям относятся истончение базальной мембраны мышечных капилляров, повышение жесткости базальной мембраны, что у людей без СД1 отмечается лишь после 50 лет, а у больных СД1 – в существенно более молодом возрасте, особенно при длительном течении заболевания. Кроме того, у больных СД1 чаще развивается катаракта, уменьшена скорость возобновления клеточной популяции по сравнению со здоровыми людьми [2].
Очевидно, что во многом повышение риска связано с метаболическими нарушениями, характерными для СД1 (гипергликемия, гиперлипидемия и др.), однако степень его увеличения не может объясняться лишь этими факторами. Более того, известные гендерные различия в частоте сердечно-сосудистых заболеваний (значимо большая частота у мужчин) у больных СД1 выражены значительно меньше по сравнению с субъектами из общей популяции. Раннее развитие сердечно-сосудистых заболеваний – не единственное проявление ускоренного старения у больных СД1. К другим проявлениям относятся истончение базальной мембраны мышечных капилляров, повышение жесткости базальной мембраны, что у людей без СД1 отмечается лишь после 50 лет, а у больных СД1 – в существенно более молодом возрасте, особенно при длительном течении заболевания. Кроме того, у больных СД1 чаще развивается катаракта, уменьшена скорость возобновления клеточной популяции по сравнению со здоровыми людьми [2].
Очевидно, что недооцениваются другие проявления несоответствия биологического возраста больных СД1 их календарному возрасту. Так, известно, что у больных СД1 позже наступает менархе, по сравнению со здоровыми женщинами чаще отмечается нерегулярность менструального цикла: в репродуктивном периоде у 30% больных СД1 женщин отмечаются аменорея, полименорея или олигоменорея, раньше наступает менопауза [3]. У больных СД1 чаще развивается синдром поликистозных яичников (СПКЯ), характерна сниженная фертильность [3, 4, 5]. Поздние осложнения СД и высокий уровень HbA1с могут вносить вклад в снижение овариального резерва у пациенток с СД1, однако, по всей видимости, основа патогенеза у таких больных – это каскад аутоиммунных процессов.
Овариальный резерв – это количество антральных фолликулов в обоих яичниках. Для определения овариального резерва принято определять сывороточный уровень фолликулостимулирующего гормона (ФСГ) и антимюллерова гормона (АМГ) на 2–3-й день менструального цикла. Снижение овариального резерва связано с уменьшением количества и потерей качества яйцеклеток и ассоциировано с плохим прогнозом исходов оплодотворения in vitro.
В исследовании Soto и соавт. (2009) показано, что у больных СД1 происходит преждевременное старение яичников, что проявляется в снижении уровней АМГ и ингибина В, свидетельствующем о более раннем уменьшении количества фолликулов в яичниках по сравнению со здоровыми женщинами [7]. Целью настоящего исследования явилась сравнительная оценка овариального резерва у молодых женщин, больных СД1, и у здоровых женщин репродуктивного возраста.
Цель
Сравнить овариальный резерв у женщин с СД1 репродуктивного возраста и у женщин без СД1 репродуктивного возраста.
Методы
Дизайн исследования
Проспективное обсервационное одноцентровое исследование в параллельных группах.
Критерии соответствия
Для минимизации влияния дополнительных факторов, изменяющих овариальный резерв, в исследование были включены женщины европеоидной расы репродуктивного возраста (от 18 до 37 лет включительно). В основную группу включались больные с верифицированным не менее 2 лет диагнозом СД1, в группу сравнения – женщины без СД. Критериями исключения являлись: операции на органах малого таза, химиотерапия или лучевая терапия в анамнезе, опухолевидные образования яичников, СПКЯ, эндометриоз, диагностированное бесплодие, нарушения менструального цикла, беременность, менопауза, прием гормональных препаратов (кроме инсулина в основной группе) на момент включения в исследование и в течение 3 мес до включения, эндокринные заболевания (кроме СД1 в основной группе), курение сигарет на момент включения или в анамнезе, злоупотребление алкоголем, наркомания и токсикомания. Все участницы ознакомились с информацией об исследовании, получили ответы на интересующие вопросы и подписали форму информированного согласия на участие в исследовании.
Условия проведения
Исследование проведено на базе одного центра – ФГБУ «НИМЦ эндокринологии» Минздрава России, Москва.
Продолжительность исследования
Продолжительность набора участниц исследования в соответствии с планом составила 10 мес, каждую участницу в рамках исследования обследовали дважды – на 2–3-й и на 21–23-й дни менструального цикла. Исследование проводилось в течение 2017 г.
Описание медицинского вмешательства
Всех участниц обследовали по единому протоколу: забор венозной крови натощак на 2–3-й и 21–23-й дни менструального цикла для определения сывороточных уровней АМГ, ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона (на 2–3-й дни цикла) и прогестерона (на 21–23-й дни цикла) методом усиленной люминесценции, на 2-й день также определяли уровень гликированного гемоглобина (HbA1с). В индивидуальную регистрационную карту заносились данные о возрасте менархе и манифестации СД1 (для больных основной группы). На 2–3-й дни менструального цикла для оценки объема яичников и числа антральных фолликулов проводилось трансвагинальное ультразвуковое исследование (УЗИ) на ультразвуковом аппарате Hewlett Packard Image Point (США) с использованием вагинального датчика с частотой 3,5 МГц по общепринятой методике.
Основной исход исследования
Основными оцениваемыми параметрами в рамках исследования явились уровень АМГ и когорта антральных фолликулов на 2–3-й день менструального цикла.
Дополнительные исходы исследования
Дополнительные оцениваемые параметры: уровни ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона и объем яичников на 2–3-й дни менструального цикла, уровень прогестерона на 21–23-й дни менструального цикла, уровень HbA1с при включении в исследование.
Анализ в подгруппах
Больные был разделены на две группы:
- группа А (основная) – больные СД1;
- группа B (контрольная) – здоровые женщины без СД1.

Методы регистрации исходов
Уровни АМГ, ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона прогестерона, определялись методом усиленной люминесценции. Уровень HbA1с определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Для оценки объема яичников и числа антральных фолликулов проводилось трансвагинальное УЗИ на ультразвуковом аппарате Hewlett Packard Image Point (США) с использованием вагинального датчика с частотой 3,5 МГц по общепринятой методике. Референтные значения определялись на основании данных локальной лаборатории, а также с учетом рекомендаций Американской коллегии акушеров-гинекологов по определению овариального резерва 2015 г. [8] и Роттердамских критериев СПКЯ (для определения нормального объема яичника) [9].
Статистический анализ
Принципы расчета размера выборки: размер выборки предварительно не рассчитывался.
Методы статистического анализа данных: статистический анализ осуществлялся с помощью пакета программ Statistica 6.0 (StatSoftInc, США). Нормальность распределения признаков оценивалась с помощью критерия Шапиро-Уилка. При описании нормально распределенных переменных указывалось среднее и стандартное отклонение (M±s). Сравнение количественных показателей в разных группах осуществлялось при помощи критерия Манна–Уитни (для двух групп). Качественные показатели представлялись в виде абсолютного числа наблюдений. Различия считались статистически значимыми при p<0,05. По коэффициенту Спирмена оценивали силу связи между переменными (r). При значениях коэффициента r<0,3 связь считалась слабой и незначительной; при значениях r=0,3–0,7 – средней или умеренной; при значениях r>0,7 – значительной и сильной.
Этическая экспертиза
Протокол исследования одобрен на заседании этического комитета ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России от 19 октября 2016 г. (протокол № 12).
Результаты
Основные результаты исследования
В основную группу вошли 224 женщины, в группу сравнения – 230 женщин.
Результаты обследования участниц исследования представлены в табл. 1.
Таблица 1. Результаты обследований больных СД1 женщин (группа A) и здоровых женщин (группа B)
Характеристика | Группа A (n=224) | Группа B (n=230) | Референсные значения |
Возраст, лет | 26,7±5,3 | 25,8±4,2 | Не применимо |
Возраст менархе, лет | 13,4±0,8* | 11,8±0,45 | Не применимо |
Роды однократно, % | 53 | 56 | Не применимо |
Роды повторно, % | 21 | 23 | Не применимо |
ИМТ, кг/м2 | 22,7±3,3 | 23,6±3,9 | 18–24,9 |
Окружность талии, см | 72,3±3,8 | 76±5,3 | ≤ 80 |
АМГ, нг/мл | 2,9±1,3* | 4,7±1,5 | 1–12,6 |
Ингибин В, пг/мл | 92,1±18,6 | 100±22,3 | <273 |
ФСГ, мМЕд/мл | 5,4±2,6 | 5,8±2,3 | 1,37–9,9 |
ЛГ, мМЕд/мл | 8,7±3,4 | 9,2±3,8 | 1,68–15 |
Эстрадиол, пмоль/л | 176±35 | 204±42 | 68–1269 |
Тестостерон, нмоль/л | 0,65±0,15 | 0,68±0,13 | 0,52–1,72 |
Прогестерон, нмоль/л | 1,4±0,5 | 1,6±0,6 | 0,3–2,2 |
HbA1c, % | 8,2±2,5* | 4,9±0,52* | <6 |
Объем яичников (см3) | 8,4±2,2 | 8,2±1,4 | ≤10 |
Число антральных фолликулов, n | 16,4±7,2* | 20,4±5,2* | Минимум 3–10 |
Примечания: *p<0,05 при сравнении параметра у больных СД1 и у здоровых женщин.
Благодаря жестким критериям включения/исключения участницы из обеих групп сопоставимы по возрасту и главным факторам, влияющим на овариальный резерв. Не выявлено различий по таким параметрам, как возраст, индекс массы тела, окружность талии, уровни ФСГ, ЛГ, эстрадиола, тестостерона, прогестерона, ингибина В, объем яичников.
В табл. 2 представлены параметры, статистически значимо различающиеся у больных СД1 и у здоровых женщин.
Таблица 2. Значимые различия параметров у больных СД1 (группа А) и у здоровых женщин репродуктивного возраста (группа В)
Характеристика | Группа A (n=224) | Группа B (n=230) |
Возраст менархе, лет | 13,4±0,8 | 11,8±0,45 |
Число антральных фолликулов, n | 16,4±7,2 | 20,4±5,2 |
HbA1c, % | 8,2±2,5 | 4,9±0,52 |
АМГ, нг/мл | 2,9±1,3 | 4,7±1,5 |
Обращают внимание значимые различия таких параметров овариального резерва у больных СД1 и у здоровых женщин, как уровень АМГ (2,9±1,3 нг/мл у больных СД1 против 4,7±1,5 нг/мл в группе здоровых женщин, p<0,05) и когорты антральных фолликулов (16,4±7,2 у больных СД1 и 20,4±5,2 у здоровых женщин). Закономерно значимое различие в уровне HbA1с: 8,2±2,5% у больных СД1 и 4,9±0,52% у здоровых женщин. Менархе у больных СД1 наступало значимо позже при сравнении с женщинами без СД (13,4±0,8 лет по сравнению с 11,8±0,45 лет, p<0,05).
При анализе корреляционных связей между уровнем HbA1с и параметрами овариального резерва отмечается сильная отрицательная связь с уровнем АМГ (r=-0,92, p<0,05) и с количеством антральных фолликулов (r=-0,76, p<0,05). При этом уровни таких маркеров овариального резерва, как размер яичников, уровни ФСГ, ЛГ, ингибина В, эстрадиола и прогестерона значимо не отличались.
При анализе зависимости овариального резерва от сроков манифестации СД1 получены интересные результаты: при манифестации СД1 до пубертата овариальный резерв, оцененный по уровню АМГ, оказался ниже, чем у больных с манифестацией СД1 после пубертата (рис. 1).
Рис. 1. Зависимость уровня АМГ (нг/мл) от сроков манифестации СД1.
При анализе по подгруппам больных СД1 в зависимости от степени компенсации заболевания (уровня HbA1с) связи между уровнем контроля диабета и овариальным резервом в одномоментном исследовании выявить не удалось (рис. 2).
Рис. 2. Зависимость уровня АМГ (нг/мл) от уровня HbA1с (%) у больных СД1. Статистически значимых различий между подгруппами больных не выявлено.
Нежелательные явления
В ходе проведения исследования нежелательных явлений не зарегистрировано.
Обсуждение
Состояние репродуктивного здоровья у больных СД1 в последние годы является предметом для серьезного изучения.
В 2016 г. опубликована работа Yarde и соавт. [10], целью которой явилось установление зависимости между факторами сердечно-сосудистого риска у больных СД1 со снижением овариального резерва как параметра, характеризующего возрастные изменения в яичниках. В это поперечное исследование случай-контроль вошел анализ данных 150 больных СД1 (средний возраст 33,8±8,4 лет) и 177 здоровых женщин с сохранной репродуктивной функцией. Оценивали такие параметры, как когорта антральных фолликулов, липидограмма, плазменные уровни АМГ, С-реактивного белка, HbA1с, а также систолическое артериальное давление, вызванная кровотоком дилатация артерий, скорость пульсовой волны и толщина комплекса интима-медиа. Авторы пришли к выводу, что значимых различий в параметрах овариального резерва у больных СД1 и у здоровых женщин нет, а негативная корреляция обнаружена только между значениями систолического артериального давления и уровнем АМГ и количеством антральных фолликулов. При сравнении с нашим исследованием обращает внимание отличие методологии: ретроспективный характер с историческим контролем. Кроме того, в нашем исследовании в соответствии с критериями включения участвовали значимо более молодые женщины. Проспективный характер нашего исследования позволил проконтролировать все известные факторы, влияющие на овариальный резерв, что обеспечивает высокую сопоставимость групп по всем параметрам. Кроме того, объем выборки в нашем исследовании значимо больше, что увеличивает статистическую мощность исследования и достоверность выводов. Таким образом можно объяснить различия в полученных результатах. Тем не менее результаты исследования Yarde и соавт. представляют большую ценность для понимания патогенеза снижения овариального резерва у больных СД1. В нашем исследовании мы не ставили задачу сопоставить параметры овариального резерва с выраженностью факторов риска сердечно-сосудистого риска, обнаружена лишь корреляция с уровнем HbA1с. Отсутствие корреляции параметров овариального резерва с параметрами липидограммы и с характеристиками сосудистой стенки в исследовании Yarde и соавт. свидетельствует об отсутствии как минимум прямой причинно-следственной связи снижения овариального резерва при СД1 с макрососудистыми поражениями.
Кроме того, в нашем исследовании в соответствии с критериями включения участвовали значимо более молодые женщины. Проспективный характер нашего исследования позволил проконтролировать все известные факторы, влияющие на овариальный резерв, что обеспечивает высокую сопоставимость групп по всем параметрам. Кроме того, объем выборки в нашем исследовании значимо больше, что увеличивает статистическую мощность исследования и достоверность выводов. Таким образом можно объяснить различия в полученных результатах. Тем не менее результаты исследования Yarde и соавт. представляют большую ценность для понимания патогенеза снижения овариального резерва у больных СД1. В нашем исследовании мы не ставили задачу сопоставить параметры овариального резерва с выраженностью факторов риска сердечно-сосудистого риска, обнаружена лишь корреляция с уровнем HbA1с. Отсутствие корреляции параметров овариального резерва с параметрами липидограммы и с характеристиками сосудистой стенки в исследовании Yarde и соавт. свидетельствует об отсутствии как минимум прямой причинно-следственной связи снижения овариального резерва при СД1 с макрососудистыми поражениями.
Soto и соавт. изучили функцию яичников у больных СД1 (n=66) в сравнении со здоровыми женщинами (n=58) в возрасте моложе 45 лет. Среди больных СД1 чаще встречались случаи снижения уровня АМГ до характерных для менопаузы уровней, при этом у больных СД1 старше 33 лет уровень АМГ был значимо ниже по сравнению со здоровыми женщинами. Авторы пришли к заключению, что снижение уровня АМГ у больных СД1 на четвертом десятке жизни свидетельствует об ускоренном уменьшении когорты примордиальных фолликулов. Эти данные согласуются с результатами, полученными в нашем исследовании: даже у молодых женщин репродуктивного возраста наличие СД1 приводит к снижению овариального резерва (более низкие значения АМГ и когорты антральных фолликулов) [7].
Kim и соавт. в исследовании с участием женщин в возрасте от 30 до 45 лет с сохранной репродуктивной функцией показали, что у больных СД1 log концентрации АМГ значимо ниже при сравнении с женщинами без СД (β-коэффициент -1,27, 95% доверительный интервал [-2,18, -0,36]) [11].
Совсем недавно до выхода печатной версии статьи онлайн опубликованы результаты исследования Al Khafajia и соавт. [12], в рамках которого анализировались параметры овариального резерва у 60 молодых больных СД1 и 80 здоровых молодых женщин (средний возраст 24,87±8,47 лет и 25,91±8,29 лет соответственно). Авторы показали значимо меньшие уровни АМГ (2,82±1,27 нг/мл и 3,79±1,91 нг/мл) и более высокие уровни HbA1с (8,73±2,8% и 4,82±0,39%) в группе больных СД1 по сравнению со здоровыми женщинами соответственно (p<0,00 для обоих сравнений). При этом отмечалась сильная отрицательная корреляция между уровнем АМГ и содержанием HbA1с (r=-0,931, p=0,2). Таким образом, данные Al Khafajia полностью согласуются с результатами нашего исследования.
По данным Codner и соавт., изменения в яичниках, связанные с СД1, начинаются еще до наступления пубертата [13]. Они провели оценку гормонального статуса и УЗИ органов малого таза у девочек с СД1 (n=73) и здоровых девочек (n=86). В препубертатном возрасте у больных СД1 девочек уровень АМГ был значимо выше по сравнению со здоровыми сверстницами (4,07 нг/мл и 4,19 нг/мл соответственно). Однако в пубертатном периоде у больных СД1 отмечалось значимое снижение АМГ, чего не наблюдалось у здоровых девочек (1,41 нг/мл по сравнению с 2,20 нг/мл соответственно). Таким образом, к периоду полового созревания в яичниках больных СД1 больше фолликулов по сравнению со здоровыми сверстницами, что авторы связывают с воздействием экзогенного инсулина в качестве ростового фактора. Такое повышение количества фолликулов повышает риск развития синдрома поликистозных яичников у больных СД1. В то же время фолликулогенез в яичниках изменяется после достижения полового созревания с ростом уровня гонадотропинов – отмечается прогрессивное снижение уровня АМГ по сравнению со здоровыми девушками.
Таким образом, результаты нашего исследования, в котором показано снижение овариального резерва у больных СД1 по сравнению со здоровыми женщинами репродуктивного возраста, согласуются с результатами большинства других исследований, в которых оценивался овариальный резерв у больных СД1. Механизмы снижения овариального резерва при СД1 не ясны. Девочка рождается с пулом фолликулов в яичниках, единицы из которых при достижении половой зрелости входят в процесс созревания, остальные представляют «покоящиеся» фолликулы. Клетки гранулезы находятся в тесном взаимодействии с окружающими клетками, что необходимо для выживания и адекватного созревания яйцеклетки. В экспериментах на животных с индуцированным диабетом показано, что в условиях гипергликемии эти клетки повреждаются: изменяются пути метаболизма, нарушается созревание фолликулов и усиливается апоптоз [14–17]. Кроме того, в процессах физиологического старения задействовано гликозилирование белков, значимо увеличивающееся при диабете. Так, Diamanti-Kandarakis и соавт. показали значимое повышение уровня конечных продуктов гликирования даже в яичниках здоровых молодых женщин [18]. Логично предположить, что содержание таких токсичных веществ в яичниках больных СД1 увеличено в большей степени, что негативно сказывается на овариальном резерве. Наконец, в ряде исследований показана ассоциация аутоиммунных заболеваний, в том числе СД1, с развитием синдрома преждевременной недостаточности яичников, с чем связано предположение об участии аутоиммунных механизмов в более раннем снижении овариального резерва у больных СД1 [19, 20].
Механизмы снижения овариального резерва при СД1 не ясны. Девочка рождается с пулом фолликулов в яичниках, единицы из которых при достижении половой зрелости входят в процесс созревания, остальные представляют «покоящиеся» фолликулы. Клетки гранулезы находятся в тесном взаимодействии с окружающими клетками, что необходимо для выживания и адекватного созревания яйцеклетки. В экспериментах на животных с индуцированным диабетом показано, что в условиях гипергликемии эти клетки повреждаются: изменяются пути метаболизма, нарушается созревание фолликулов и усиливается апоптоз [14–17]. Кроме того, в процессах физиологического старения задействовано гликозилирование белков, значимо увеличивающееся при диабете. Так, Diamanti-Kandarakis и соавт. показали значимое повышение уровня конечных продуктов гликирования даже в яичниках здоровых молодых женщин [18]. Логично предположить, что содержание таких токсичных веществ в яичниках больных СД1 увеличено в большей степени, что негативно сказывается на овариальном резерве. Наконец, в ряде исследований показана ассоциация аутоиммунных заболеваний, в том числе СД1, с развитием синдрома преждевременной недостаточности яичников, с чем связано предположение об участии аутоиммунных механизмов в более раннем снижении овариального резерва у больных СД1 [19, 20].
В отечественной литературе удалось найти единичные публикации, посвященные оценке овариального резерва у больных СД. Так, исследование Толопыгиной М.Г. и соавт. посвящено оценке функции яичников у больных СД1. Анализ результатов обследования 180 больных СД1 женщин репродуктивного возраста показал, что овариальная недостаточность имелась у 62,2% обследованных женщин. Выявлена связь овариальной недостаточности (критерии оценки: уровни ФСГ, ЛГ, пролактина, эстрадиола, общего и свободного тестостерона, прогестерона в периферической крови, параметры УЗИ органов малого таза) с уровнем гликемии, HbA1с, дозой вводимого инсулина. Отсутствовала связь недостаточности функции яичников с выраженностью микрососудистых диабетических осложнений и режимом инсулинотерапии. У больных СД1 отмечалось увеличение объема яичников, числа антральных фолликулов по сравнению с этими показателями у здоровых женщин. У этих больных наблюдалось повышение уровня ЛГ, эстрадиола и свободного тестостерона в крови. Увеличение объема яичников коррелировало с наличием и выраженностью диабетических микрососудистых осложнений и дозой вводимого инсулина. Аутоиммунное поражение яичников (оценивалось по наличию антител к ткани яичников) у женщин с СД1 выявлено лишь у 3,6% [21]. В нашем исследовании 2015 г. мы показали, что среди женщин с СД2 в возрастных группах от 20 до 49 лет значимо, по сравнению с группой контроля, повышен уровень ФСГ и снижено общее количество фолликулов [22].
У больных СД1 отмечалось увеличение объема яичников, числа антральных фолликулов по сравнению с этими показателями у здоровых женщин. У этих больных наблюдалось повышение уровня ЛГ, эстрадиола и свободного тестостерона в крови. Увеличение объема яичников коррелировало с наличием и выраженностью диабетических микрососудистых осложнений и дозой вводимого инсулина. Аутоиммунное поражение яичников (оценивалось по наличию антител к ткани яичников) у женщин с СД1 выявлено лишь у 3,6% [21]. В нашем исследовании 2015 г. мы показали, что среди женщин с СД2 в возрастных группах от 20 до 49 лет значимо, по сравнению с группой контроля, повышен уровень ФСГ и снижено общее количество фолликулов [22].
Ограничения исследования
В нашем исследовании не проводился формальный расчет объема выборки, что допустимо в рамках неинтервенционного исследования. Жесткие критерии отбора участниц исследования уменьшают вероятность влияния на результат дополнительных вмешивающихся факторов, однако в реальной клинической практике дисменорея, прием гормональных контрацептивов, гинекологические операции в анамнезе, ожирение могут существенно изменять овариальный резерв. Таким образом, экстраполяция результатов на общую популяцию больных СД1 репродуктивного возраста некорректна.
Заключение
В нашем исследовании доказано снижение параметров овариального резерва у молодых больных СД1 по сравнению со здоровыми женщинами того же возраста (18–37 лет). В совокупности с ранее известными данными о связанных с СД1 нарушениях менструальной функции и проблемах при планировании беременности полученные результаты требуют информирования врачей и пациенток о потенциальном влиянии диабета на репродуктивную функцию. Несмотря на сохранение параметров овариального резерва в референтных пределах, с учетом их снижения при СД1 по сравнению со здоровыми женщинами целесообразно рекомендовать пациенткам планировать беременность в более молодом возрасте.
Дополнительная информация
Источник финансирования. Работа выполнена в рамках Гранта Российского научного фонда «Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркёры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация» (Грант РНФ № 17-75-30035).
Работа выполнена в рамках Гранта Российского научного фонда «Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркёры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация» (Грант РНФ № 17-75-30035).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Григорян О.Р., Красновская Н.С. – сбор материала, написание текста рукописи; Андреева Е.Н., Дедов И.И. – идея, редактирование текста рукописи; Михеев Р.К. – статистический анализ данных, написание текста рукописи. Все авторы внесли существенный вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
1. de Ferranti SD, de Boer IH, Fonseca V, et al. Type 1 diabetes mellitus and cardiovascular disease: a scientific statement from the American Heart Association and American Diabetes Association. Diabetes Care. 2014;37(10):2843-2863. doi: 10.2337/dc14-1720
2. Dorman JS, Steenkiste AR, Foley TP. Menopause in type 1 diabetic women: is it premature? Diabetes. 2001;50(8):1857-1862
3. Codner E, Escobar-Morreale HF. Clinical review: Hyperandrogenism and polycystic ovary syndrome in women with type 1 diabetes mellitus. J Clin Endocrinol Metab. 2007;92(4):1209-1216. doi: 10.1210/jc.2006-2641
4. Sjöberg L, Pitkäniemi J, Haapala L, et al. Fertility in people with childhood-onset type 1 diabetes. Diabetologia. 2013;56(1):78-81. doi: 10.1007/s00125-012-2731-x
5. Jonasson JM, Brismar K, Sparén P, et al. Fertility in women with type 1 diabetes: a population-based cohort study in Sweden. Diabetes Care. 2007;30(9):2271-2276. doi: 10.2337/dc06-2574
Jonasson JM, Brismar K, Sparén P, et al. Fertility in women with type 1 diabetes: a population-based cohort study in Sweden. Diabetes Care. 2007;30(9):2271-2276. doi: 10.2337/dc06-2574
6. Rasool S, Shah D. Fertility with early reduction of ovarian reserve: the last straw that breaks the Camel’s back. Fertil Res Pract. 2017;11(3):15. doi: 10.1186/s40738-017-0041-1
7. Soto N, Iñiguez G, López P, et al. Anti-Mullerian hormone and inhibin B levels as markers of premature ovarian aging and transition to menopause in type 1 diabetes mellitus. Hum Reprod. 2009;24(11):2838-2844. doi: 10.1093/humrep/dep276
8. Committee on Gynecologic Practice. Committee opinion no. 618: Ovarian reserve testing. Obstet Gynecol. 2015;125(1):268-273. doi: 10.1097/01.AOG.0000459864.68372.ec
9. Franks S. Controversy in clinical endocrinology: diagnosis of polycystic ovarian syndrome: in defense of the Rotterdam criteria. J Clin Endocrinol Metab. 2006;91(3):786-789. doi: 10.1210/jc.2005-2501
10. Yarde F, Spiering W, Franx A, et al. Association between vascular health and ovarian ageing in type 1 diabetes mellitus. Hum Reprod. 2016;31(6):1354-1362. doi: 10.1093/humrep/dew063
11. Kim C, Karvonen-Gutierrez C, Kong S, et al. Antimüllerian hormone among women with and without type 1 diabetes: the Epidemiology of Diabetes Interventions and Complications Study and the Michigan Bone Health and Metabolism Study. Fertil Steril. 2016;106(6):1446-1452. doi: 10.1016/j.fertnstert.2016. 07.009
07.009
12. Al Khafajia MM, Al-Taeea HA, Al-Shaikhb SF. Assessment of anti-Mullerian hormone level in reproductive age group women with diabetes mellitus type one. Middle East Fertility Society Journal. 2017;22(4):269-272. doi: 10.1016/j.mefs.2017.04.004
13. Codner E, Iñiguez G, Hernández IM, et al. Elevated anti-Müllerian hormone (AMH) and inhibin B levels in prepubertal girls with type 1 diabetes mellitus. Clin Endocrinol (Oxf). 2011;74(1):73-78. doi: 10.1111/j.1365-2265.2010.03887.x
14. Tatone C, Amicarelli F, Carbone MC, et al. Cellular and molecular aspects of ovarian follicle ageing. Hum Reprod Update. 2008;14(2):131-142. doi: 10.1093/humupd/dmm048
15. Colton SA, Humpherson PG, Leese HJ, Downs SM. Physiological changes in oocyte-cumulus cell complexes from diabetic mice that potentially influence meiotic regulation. Biol Reprod. 2003;69(3):761-770. doi: 10.1095/biolreprod.102.013649
16. Chang AS, Dale AN, Moley KH. Maternal diabetes adversely affects preovulatory oocyte maturation, development, and granulosa cell apoptosis. Endocrinology. 2005;146(5):2445-2453. doi: 10.1210/en.2004-1472
17. Витязева И.И., Боголюбов С.В., Иловайская И.А., и др. Бесплодный брак у пациентов с сахарным диабетом // Сахарный диабет. – 2009. – Т. 12. – №4. – C. 6-9. [Vityazeva II, Bogolyubov SV, Ilovayskaya IA, et al. Infertile marriage in patients with diabetes mellitus. Diabetes mellitus. 2009;12(4):6-9. (In Russ.)] doi: 10.14341/2072-0351-5695.
18. Diamanti-Kandarakis E, Piperi C, Patsouris E, et al. Immunohistochemical localization of advanced glycation end-products (AGEs) and their receptor (RAGE) in polycystic and normal ovaries. Histochem Cell Biol. 2007;127(6):581-589. doi: 10.1007/s00418-006-0265-3
Diamanti-Kandarakis E, Piperi C, Patsouris E, et al. Immunohistochemical localization of advanced glycation end-products (AGEs) and their receptor (RAGE) in polycystic and normal ovaries. Histochem Cell Biol. 2007;127(6):581-589. doi: 10.1007/s00418-006-0265-3
19. Košir Pogačnik R, Meden Vrtovec H, Vizjak A, et al. Possible role of autoimmunity in patients with premature ovarian insufficiency. Int J Fertil Steril. 2014;7(4):281-290.
20. Ebrahimi M, Akbari Asbagh F. The role of autoimmunity in premature ovarian failure. Iran J Reprod Med. 2015 Aug;13(8):461-472.
21. Толпыгина М.Г., Потин В.В., Тарасова М.А. Функция яичников у женщин с сахарным диабетом 1 типа // Журнал акушерства и женских болезней. – 2014. – Т. 63. – №3. – С. 53-57. [Tolpygina MG, Potin VV, Tarasova MA. Ovarian function in women with type 1 diabetes mellitus. Journal of obstetrics and women’s diseases. 2014; 63(3):53-57] doi: 10.17816/JOWD63353-57
22. Григорян О.Р., Жемайте Н.С., Джавелидзе М.И., и др. Оценка овариального резерва у женщин с сахарным диабетом 2-го типа (оригинальная статья) // Проблемы репродукции. – 2015. – Т. 21. – №4. – C. 27-34. [Grigoryan OR, Zhemaite NS, Dzhavelidze MI, et al. Evaluation of ovarian reserve in women with type 2 diabetes mellitus. Problemy reproduktsii. 2015;21(4):27-34. (In Russ.)] doi: 10.17116/repro201521427-34
Антимюллеров гормон со скидкой до 50%
Срок исполнения
Анализ будет готов в
течение 2 дней, исключая субботу, воскресенье и день забора.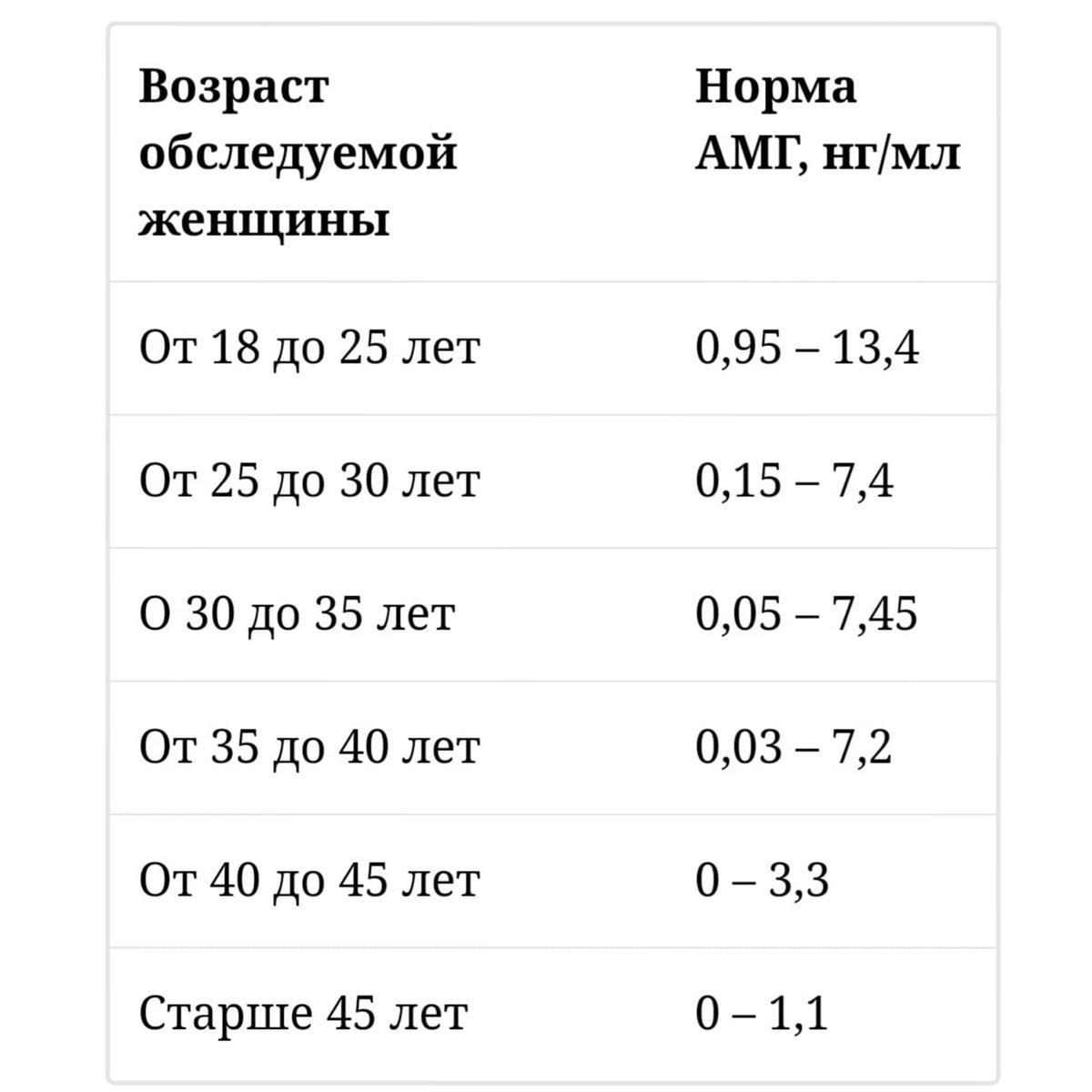 Срок может быть увеличен на 1 день в случае необходимости.
Вы получите результаты на эл. почту сразу по готовности.
Срок может быть увеличен на 1 день в случае необходимости.
Вы получите результаты на эл. почту сразу по готовности.
Подготовка к анализу
ЗаранееДля оценки овариального резерва яичников одновременно смотрят антимюллеров гормон, ФСГ и ингибин B на 3-5 день менструального цикла, если лечащий доктор не назначил другие сроки.
Взятие крови на гормоны рекомендовано проводить в утренние часы, если другое время не указано лечащим врачом. Для проверки динамики показателя каждый раз выбирайте одинаковые интервалы сдачи анализа.
Обсудите с врачом прием лекарственных препаратов накануне и в день проведения исследования крови, а также другие дополнительные условия подготовки.
Не сдавайте анализ крови сразу после рентгенографии, флюорографии, УЗИ, физиопроцедур.
НаканунеЗа 24 часа до взятия крови:
- Ограничьте жирную и жареную пищу, не принимайте алкоголь.
- Исключите спортивные тренировки и эмоциональное перенапряжение.
От 8 до 14 часов до сдачи крови не принимайте пищу, пейте только чистую негазированную воду.
В день сдачиПеред забором крови
- 60 минут не курить,
- 15-30 минут находиться в спокойном состоянии.
Информация об анализе
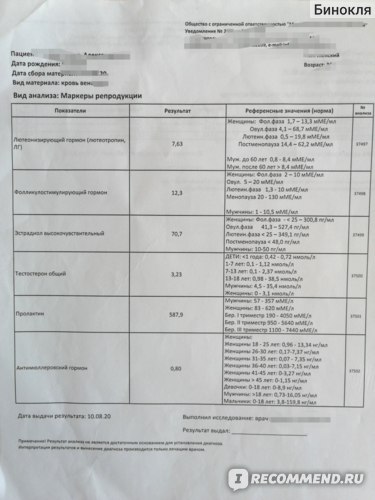
Показатель
Антимюллеров гормон участвует в процессах формирования половой системы, вырабатывается у мужчин в семенных канальцах, у женщин в фолликулах. Исследование содержания и количества антимюллерова гормона позволяет выяснить причину бесплодия.
Исследование содержания и количества антимюллерова гормона позволяет выяснить причину бесплодия.
Назначения:
Назначается при планировании беременности, для выяснения причин бесплодия, для оценки функционального резерва яичников, при подозрении на СПКЯ.
СпециалистНазначается гинекологом, репродуктологом
ВажноКонцентрация АМГ стабильна и не зависит от месячного цикла.
Метод исследования — Иммуноферментный анализ (ИФА)
Материал для исследования — Сыворотка крови
Состав и результаты
Антимюллеров гормон
Узнайте больше о планировании беременности:
Какие анализы необходимы при беременности и её планировании?
Как подготовиться к ЭКО?
TORCH-инфекции: что это такое, чем опасны при беременности
Анти-Мюллеров гормон (АМГ) является димерным гликопротеином, принадлежащим к семейству трансформирующих факторов роста. Подобно гормонам, эти факторы обладают широким спектром биологического действия на многие клетки – стимулируют или ингибируют митогенез, хемотаксис, дифференцировку клеток.
АМГ у мужчин секретируется клетками Сертоли (клетки, выстилающие семенные канальцы в яичках). Помимо АМГ клетки Сертоли синтезируют ингибин и активин. Синтез АМГ начинается в период эмбрионального развития и сохраняется в течение всей жизни. Наибольшая концентрация Анти-Мюллерова гормона наблюдается в препубертатном периоде, снижаясь в пубертатный период и оставаясь на довольно низком уровне у взрослых мужчин в течение жизни. Нарушения в секреции АМГ вызывают у мужчин сохранение дериватов Мюллеровых протоков. Данное состояние называется синдромом персистенции Мюллеровых протоков (СПМП) и клинически проявляется крипторхизмом, паховыми грыжами и нарушением репродуктивной функции. СПМП — редкая форма ложного мужского гермафродитизма. Несмотря на то, что у пациентов с синдромом персистенции Мюллеровых протоков не нарушена дифференцировка яичек, у них часто отмечают бесплодие. Бесплодие у пациентов с СПМП может быть вследствие поздно устраненного оперативными методами крипторхизма, приводящего к атрофии семенных канальцев и вторичной андрогенной недостаточности. Возникновение СПМП может быть обусловлено мутациями как гена АМГ, так и гена рецептора АМГ (AMHRII).
Синтез АМГ у женщин происходит в гранулёзных клетках первичных фолликулов яичников. По сравнению с мужчинами уровень АМГ в сыворотке крови у женщин относительно низкий вплоть до наступления пубертатного периода, в пубертатном периоде концентрация АМГ повышается и далее постепенно снижается. Концентрация Анти-Мюллерова гормона в сыворотке крови у женщин коррелирует с числом антральных фолликулов и с возрастом, лучше всего отражает снижение репродуктивной функции у здоровых женщин с доказанной фертильностью.
АМГ оказывает двунаправленное действие на яичники:
- подавляет рост фолликулов на начальных стадиях,
- подавляет ФСГ- зависимый рост и селекцию преантральных и небольших антральных фолликулов.
Секреция АМГ не контролируется гонадотропными гормонами (ФСГ, ЛГ) и адекватно отражает количество фолликулов. Поэтому определение концентрации АМГ в сыворотке крови считается важным тестом для определения фолликулярного резерва яичника (оценка числа функционально активных фолликулов в яичниках женщины), а также для оценки овариальной дисфункции и овариального старения. Пониженные значения Анти-Мюллерова гормона свидетельствуют о снижении овариального резерва. В онкологической практике определение концентрации Анти-Мюллерова гормона в сыворотке крови имеет значение при диагностике гранулёзоклеточных опухолей яичников, поскольку при этом происходит значительное повышение его концентрации.
Определение концентрации АМГ в сыворотке крови проводиться для оценки преждевременного или замедленного полового развития (мужчины и женщины), для оценки овариального резерва у женщин (совместно с определением ингибина В). Кроме того, исследование АМГ у женщин проводится при подозрении на опухоли яичников.
Ранее для оценки овариального резерва проводили исследование концентрации фолликулостимулирующего гормона (ФСГ) на 3-й день месячного цикла, однако в настоящее время доказано, что определение АМГ (особенно вместе с ингибином B) является более информативным по нескольким причинам:
- концентрация ФСГ варьируется в зависимости от дня месячного цикла,
- концентрация ФСГ зависит от уровня эстрадиола (эстрадиол подавляет секрецию ФСГ),
- концентрация АМГ стабильна и не зависит от месячного цикла.
Поэтому, большинство специалистов, занимающихся проблемами бесплодия на сегодняшний день используют определение концентрации АМГ в сыворотке крови для оценки овариального резерва. Для этой цели возможно проведение тройного теста на 3-й день месячного цикла — одновременное определение концентрации ФСГ, АМГ и ингибина B. Снижение базального уровня АМГ 0,8 мкг/л сопровождается низкой вероятностью наступления беременности в результате ЭКО (экстракорпорального оплодотворения). В протоколах ЭКО у женщин старшего репродуктивного возраста успех наступления беременности тем выше, чем выше уровень АМГ.
В онлайн-лаборатории Lab4U вас ждут сниженные цены на анализ на антимюллеров гормон – со скидкой до 50%!
Гормональные исследования — цены,отзывы,сдать анализы
Гормоны являются биологически активными веществами, которые оказывают системное воздействие на организм и регулируют все виды обмена веществ: липидный, углеводный, водно-солевой, белковый. Именно гормоны обеспечивают мобилизацию сил в стрессовых ситуациях, и они же отвечают за отдых и восстановление энергии. Гормональные исследования редко проводят в плановом порядке, как правило, их назначает специалист при наличии тех или иных показаний.
Показания к проведению
Анализ на гормоны – это гематологическое исследование, с помощью которого можно оценить работу эндокринных желез по уровню сигнальных биологически активных веществ. Сюда входит целый комплекс различных лабораторных тестов, объектом изучения которых может быть как целая группа, так и всего один гормон.
Сдать анализы на гормоны рекомендуется:
- при подозрении на дисфункцию щитовидной железы и связанных с ней органов;
- повышенном или пониженном уровне кальция в крови;
- нарушении менструального цикла;
- мужском и женском бесплодии;
- надпочечниковой недостаточности;
- нарушении метаболизма, ожирении;
- сахарном диабете;
- подозрении на развитие опухолевого процесса;
- заболеваниях гипофиза и гипоталамо-гипофизарной системы и пр.
Как проводится анализ
К прохождению обследования пациенту необходимо подготовиться. Анализ обычно сдается утром натощак, через 8 часов после последнего приема пищи. Чтобы результат был максимально точным, рекомендуется за 1–2 дня до процедуры не употреблять алкогольные напитки, отказаться от повышенных физических нагрузок, снизить уровень эмоционального напряжения, отменить прием гормональных препаратов (после консультации со специалистом). Это общие рекомендации, однако для каждого конкретного анализа (половые гормоны, АМГ, ТТГ, гормональный профиль, фон и др.) есть свой список подготовительных мер, о которых сообщит лечащий врач.
Для любого вида исследования в данном случае нужна венозная кровь пациента (сыворотка). Она собирается в вакуумные пробирки и отправляется в лабораторию. На емкостях указывается тип анализа: комплексный или на определенные виды гормонов.
Наше предложение
Если Вам необходимо сдать платные анализы крови на гормоны в Москве, Вы ищете недорогой, но качественный вариант, обратитесь в ближайшую клинику «Медлайн-Сервис». Наши специалисты дадут необходимые консультации и посчитают общую цену за обследование. Мы гарантируем чистоту и аккуратность, делаем все возможное для обеспечения комфорта нашим пациентам.
Не ищите самые дешевые варианты: низкая стоимость может быть свидетельством неточности результата. Мы всегда сообщаем нашим пациентам о необходимых мерах подготовки и ориентируем по времени готовности результата.
Почему AMG (антимулерианский гормон) важен для успешного ЭКО?
У каждой женщины естественный запас яйцеклеток находится в яичниках. По мере взросления качество и количество яиц снижается. Антимюллеров гормон (АМГ) вырабатывается яйцеклетками по мере развития яичных мешочков или фолликулов. Уровень АМГ в крови женщины — один из лучших индикаторов текущего качества ее яичникового резерва.
Уровни АМГ в крови доноров яйцеклеток, если они не изменяются во время менструации или из-за менструального цикла.Следовательно, этот тест можно проводить в любое время в течение всего месяца. Даже если женщина принимает оральные контрацептивы, она может пройти такой тест, чтобы определить качество и потенциал ее яичникового резерва.
Этот тест в первую очередь проводится на предполагаемых матерях перед оплодотворением. Это позволяет им получить отчет о качестве своих яйцеклеток, прежде чем вкладывать средства в оплодотворение яйцеклетки спермой. Женщины с плохими результатами анализов обычно обращаются к донору яйцеклеток, чтобы получить наиболее фертильную яйцеклетку для цикла ЭКО.
Фертильность — одна из самых серьезных проблем, с которыми сегодня сталкиваются начинающие родители. Тысячи пар сегодня сталкиваются с проблемами бесплодия и проходят лечение ЭКО. Основная цель всех циклов лечения ЭКО — установить причину бесплодия и устранить ее с помощью лекарств. Женское бесплодие — один из основных аспектов для пар, сталкивающихся с проблемами естественного зачатия. Тест AMH проводится для подтверждения отклонений, связанных с фертильностью яиц, вырабатываемых женщиной естественным путем.Если он подтверждает наличие у женщины некачественных яйцеклеток, ее обычно отправляют на лечение. Если она не готова тратить много времени на это лечение, обычно рекомендуется обратиться к донору яйцеклеток для завершения цикла ЭКО.
Поскольку предполагаемые родители вкладывают много своих денег и энергии в цикл ЭКО, их беспокоит качество яйцеклеток, которые они получают от донора яйцеклеток. Честно говоря, предполагаемые родители должны вкладывать дополнительные средства, чтобы получить яйцеклетки от донора. Из-за этого они хотят получать самые лучшие яйца с высочайшим качеством и потенциалом.Вот почему доноры яйцеклеток тщательно проверяются перед назначением им цикла ЭКО. Доноры яйцеклеток проходят тест AMH, чтобы определить их способность производить яйцеклетки высокого качества.
Доноры яйцеклеток, подписанные с New Life, проходят проверку на уровень АМГ. Если пара хочет использовать своего собственного донора яйцеклеток, мы сначала проверяем ее уровень AMH, а затем рассматриваем ее как кандидата на эту важную роль. У нас есть большая база данных здоровых доноров яйцеклеток, работающих с нами, которые предоставляют здоровые яйца.Помимо доноров яйцеклеток, пары могут использовать криоконсервированные яйца для завершения цикла ЭКО.
Тест AMH для успешного цикла ЭКО
Тест на антимюллеровы гормоны (AMH) измеряет резерв яичников и оценивает потенциал фертильности женщины.
Для более точной оценки тесты AMH обычно сочетаются с подсчетом антральных фолликулов (AFC). Этот конкретный тест определяет количество мелких фолликулов в двух яичниках. AFC выполняется центрами ЭКО с помощью ультразвукового исследования.Это помогает сделать точную оценку фертильности.
Женщины, планирующие пройти цикл ЭКО, сначала проходят скрининг с помощью теста на анти-мюллеровский гормон (АМГ) для определения ее фертильности. Это один из самых надежных тестов для интерпретации способности любой женщины к беременности с точки зрения фертильности ее яйцеклеток. Этот тест можно проводить в любое время месяца и не имеет никакого отношения к образу жизни женщин, проходящих этот тест. Женщины, борющиеся с бесплодием, часто проходят этот тест, чтобы узнать точную картину своего репродуктивного здоровья.
ТестированиеAMH в настоящее время является важной частью программ в авторитетных клиниках репродуктивной медицины и центрах ЭКО. АМГ — это в основном белок, который вырабатывается клетками фолликулов яичников. Процедура тестирования AMH была впервые разработана еще в 1990 году. Она была введена в действие после многих лет исследований на женщинах, проходящих лечение ЭКО. Эксперты в этом исследовании установили положительную корреляцию между уровнем АМГ у женщины и количеством яйцеклеток, извлеченных после успешной процедуры стимуляции яичников.
Большинство клиник по лечению бесплодия доверяют уровням АМГ и не рассматривают женщину с низким уровнем АМГ в качестве хорошего кандидата на донорство яйцеклеток или ЭКО. В некоторых случаях женщины с низким уровнем АМГ получают надлежащий курс лечения, чтобы избавиться от такого синдрома и получить здоровую беременность.
АМГ по номерам
Нормальный уровень АМГ — если уровень АМГ составляет от 1,5 до 4,0 нг / мл, он считается нормальным и имеет повышенную фертильность и лучшую реакцию на лечение бесплодия.
Низкий уровень АМГ — если уровень АМГ от 1,0 до 1,5 нг / мл, он считается низким и со снижением резерва яичников. Тем не менее, есть хорошие шансы на хорошие результаты беременности после лечения.
Очень низкий уровень АМГ — если уровень АМГ ниже 0,5 нг / мл, это указывает на чрезвычайно низкий резерв яичников. У таких женщин больше опасений по поводу фертильности, и они обычно не считаются донорами яйцеклеток.
Что влияет на уровни AMH?
Уровень АМГ у женщин регулируется гонадотропным гормоном.Он остается самым высоким на начальной стадии развития фолликула. Это когда количество фолликула составляет 4 мм. Секреция АМГ замедляется и в конечном итоге прекращается по мере постепенного увеличения фолликула. Исследования показывают, что производство АМГ почти прекращается, когда фолликулы достигают 8 мм.
Очень важно понимать естественные колебания циркуляции уровня АМГ. Уровень AMH показывает потенциальное ограничение количества или качества яйцеклеток у женщин.
Низкие уровни AMH
Уровень АМГ у женщины падает по мере того, как она начинает стареть.Другие элементы, влияющие на яичники и функции яичников:
Напряжение
Нездоровое питание
Низкое кровообращение в яичниках
Болезнь
Гормональный дисбаланс
Травма
Другие генетические факторы
Аутоиммунные расстройства
Факторы нарушенного образа жизни
Если уровень АМГ оказывается низким у более молодых женщин, то есть женщин в возрасте до 35 лет, это признак ранней менопаузы. Необходимо немедленно принять медицинские меры, чтобы справиться с ситуацией и сохранить и повысить фертильность женщины.
Надежда на будущее
В случае, если ваш уровень AMH в отчете об обследовании низкий и вы беспокоитесь о его последствиях, вы должны помнить, что одного теста на AMH не всегда достаточно для прогнозирования вашей фертильности. Существуют и другие подходы к тестированию для оценки вашего уровня AMH. Другие тесты на фертильность могут принести вам еще один отчет о состоянии здоровья, в отличие от этого.
Существуют различные лекарства, связанные со здоровьем яиц, которые повышают фертильность. Существует множество лечебных процедур, которые могут помочь женщине нормализовать уровень АМГ.Медицинские методы лечения и природные средства значительно повышают фертильность женщин.
Diet Doc сотрудничает с AMG, чтобы предложить пациентам биоидентичную гормональную заместительную терапию по всей стране
ХЬЮСТОН, 10 февраля 2016 г. (ГЛОБАЛЬНАЯ ИНФОРМАЦИЯ) — Гормональный дисбаланс имеет множество побочных эффектов, вызывающих целый ряд симптомов, включая усталость, депрессию, головные боли и даже снижение либидо. Гормоны также могут играть важную роль в способности похудеть или сопротивляться увеличению веса с возрастом. До недавнего времени снижение уровня гормонов в организме было просто фактом жизни, неуклонно происходящим с возрастом.Однако благодаря новейшим технологиям и способности создавать биоидентичные гормоны в лаборатории заместительная гормональная терапия стала преобладающей в американской культуре. Чтобы помочь в лечении гормонального дисбаланса, Diet Doc заключила партнерские отношения с известным поставщиком биоидентичных гормональных препаратов AMG, сделав заместительную гормональную терапию доступной для пациентов Diet Doc по всей стране.
По мере старения организма многочисленные симптомы гормонального дисбаланса становятся все более распространенными, что в конечном итоге влияет на качество жизни многих.Мужчины начинают терять свободный тестостерон в организме со скоростью около 2% в год после 30 лет. Признаками низкого уровня тестостерона являются чрезмерная усталость, снижение мышечного тонуса и силы, депрессия и снижение полового влечения. Женщины не застрахованы от гормонального дисбаланса. По мере того как женщины стареют, наиболее резкое падение уровня гормонов начинается в период менопаузы. Симптомами менопаузы могут быть бессонница, приливы, перепады настроения, проблемы с памятью и многое другое.
Отличный новый способ лечения гормонального дисбаланса — это заместительная биоидентичная гормональная терапия, или сокращенно BiHRT.Биоидентичные гормоны ценятся за их сходство с естественными гормонами и обладают заметно улучшенными физиологическими эффектами по сравнению с их синтетическими аналогами, которые имеют другую химическую структуру. Вся биоидентичная гормональная терапия проходит под тщательным наблюдением врача, но проводится в домашних условиях.
Для предоставления более полного спектра услуг Diet Doc объединилась с Andro Medical Group (AMG), лидером в области биоидентичной заместительной гормональной терапии.Как и система похудания Diet Doc, AMG предлагает индивидуальную заместительную гормональную терапию, разработанную с учетом индивидуальных факторов организма пациента, его потребностей и состава.
В течение ограниченного времени Diet Doc предлагает БЕСПЛАТНУЮ первичную консультацию заинтересованным пациентам для оценки гормонального дисбаланса. Просто свяжитесь с Diet Doc напрямую по телефону 888-934-4451 и назначьте встречу для сбора образцов на дому. Квалифицированные специалисты AMG придут к пациенту домой, чтобы забрать все лаборатории, поэтому нет необходимости ехать в местную лабораторию.
После получения результатов пациенты будут иметь возможность проконсультироваться с одним из лицензированных врачей Diet Doc по поводу вариантов заместительной гормональной терапии. Единственный надежный способ проверить гормональный дисбаланс — это тестирование, и Diet Doc предоставляет пациентам по всей стране простоту домашнего гормонального лечения с легкостью телефонного звонка.
О компании:
Diet Doc Weight Loss — национальный лидер в области медицинского снижения веса, предлагающий полный набор рецептурных лекарств, врачей, медсестер и поддержку наставников по питанию.Более десяти лет Diet Doc разработала сложную, разработанную врачом программу похудания, которая учитывает каждую индивидуальную потребность в здоровье, чтобы способствовать быстрой, безопасной и долгосрочной потере веса.
Diet Doc Контактная информация:
Оказание помощи в США
Штаб-квартира:
Сан-Диего, Калифорния
(888) 934-4451
[email protected]
http://www.dietdoc.com
Twitter: https: //twitter.com/DietDocMedical
Facebook: DietDocMedicalWeightLoss
Linkedin: https: // www.linkedin.com/company/diet-doc-weight-loss?trk=biz-brand-tree-co-logo
Anti-Muller Hormone (AMH) — surrogacycmc.com
В жизни каждой пары наступает момент, когда мужчина и женщина задумываются о планировании семьи. Для некоторых, кто добился результатов достаточно быстро, этот период связан с волнующим ожиданием положительного результата теста на беременность, а для других — с долгим процессом, полным разочарований.
При выявлении возможных причин бесплодия специалисты по репродуктологии назначают тест для определения уровня гормонального фона женщины уже на первом этапе подготовки.Если результаты стандартного теста не выходят за пределы нормы и не позволяют установить причину бесплодия, назначается тест на уровень Anti-Muller Hormone (AMG).
Антилегочный гормон (Anti-Muller Hormone) — один из наиболее важных гормонов, влияющих на фертильность. Он играет ключевую роль в дифференциации первичных половых признаков во внутриутробном периоде.
Этот составной белок получил свое название от имени немецкого биолога и естествоиспытателя Иоганна Мюллера, который впервые вывел общий канал-трубку из женского и мужского эмбрионов — ручей Мюллера.Благодаря АМГ на шестой неделе беременности у женских эмбрионов происходит формирование мюллерова оттока влагалища, маточной трубы и матки, а у мужских эмбрионов — предстательной железы матки и придатка яичка.
Антимюллеровский гормон у женщин вырабатывается клетками яичников, начиная с периода созревания фолликулов. Его можно определить только с начала полового созревания до наступления климакса. Уровень гормонов в крови женщины указывает на ее яичниковый резерв и фертильность.
Забор венозной крови используется для определения уровня АМГ. Для объективного анализа кровь следует сдавать утром натощак на 2-5 день менструального цикла. Если менструального цикла нет, забор крови проводится в любой день. Перед обследованием за несколько дней необходимо максимально ограничить эмоциональные и физические нагрузки. Прохождение теста при обострении хронических заболеваний и острых инфекционно-воспалительных заболеваний (ОРВИ, грипп и др.)) крайне нежелательно.
Уровень АМГ для женщин:
Низкий 0,01 — 0,9 нг / мл
Средний 1,0 — 2,5 нг / мл
Высокий Более 2,5 нг / мл
Обычно максимальное содержание АМГ наблюдается у женщин в возрасте от 20 до 20 лет. 30 лет, то есть на пике женской фертильности.
Тест на уровень антимюллеровского гормона в организме женщины информативен при:
- преждевременном половом созревании;
- преждевременная менопауза;
- бесплодие;
- уменьшение овариального резерва;
- поликистоз яичников;
- гранулярные опухоли яичников;
- ожирение в позднем репродуктивном возрасте.
На сегодняшний день тест AMH является наиболее точным индикатором овариального резерва для женщин репродуктивного возраста. Низкий уровень гормонов также свидетельствует о неэффективности терапии в рамках лечения бесплодия.
Кальцимиметик AMG 073 снижает уровень паращитовидных гормонов в плазме у гемодиализных пациентов с вторичным гиперпаратиреозом
Реферат
РЕФЕРАТ. Лечение стеролами витамина D может снизить уровень паратиреоидного гормона (ПТГ) в плазме у многих пациентов со вторичным гиперпаратиреозом из-за терминальной стадии почечной недостаточности, но во время лечения часто развиваются гиперкальциемия, гиперфосфатемия или и то, и другое.Таким образом, необходимы альтернативные терапевтические подходы к управлению избыточной секрецией ПТГ. Кальцимиметические агенты непосредственно подавляют секрецию ПТГ, активируя рецептор, чувствительный к кальцию, в паращитовидных железах, но клинический опыт их применения ограничен. Пятьдесят два гемодиализных пациента с вторичным гиперпаратиреозом получали однократные пероральные дозы кальцимиметического агента AMG 073 в диапазоне от 5 до 100 мг или плацебо. Уровни ПТГ в плазме снизились через 2 часа после доз 25, 50, 75 или 100 мг, упав максимум на 43 ± 29%, 40 ± 36%, 54 ± 28% или 55 ± 39%, соответственно.Уровни ПТГ в плазме снизились у всех пациентов, получавших дозы ≥25 мг, но не изменились у тех, кто получал плацебо. У пациентов, получавших ежедневные дозы 25 или 50 мг AMG 073 в течение 8 дней, уровни ПТГ в плазме снижались в течение первых 3-4 дней и оставались ниже исходных значений после 8 дней лечения. Концентрация кальция в сыворотке крови также снизилась на 5-10% по сравнению с уровнями до лечения у пациентов, получавших 50 мг AMG 073 в течение 8 дней, но значения не изменились у тех, кто получал более низкие дозы. Уровни фосфора в сыворотке и значения продукта иона кальция и фосфора снизились после лечения AMG 073.Таким образом, 8-дневное лечение AMG 073 эффективно снижает уровни ПТГ в плазме и улучшает некоторые нарушения минерального обмена, которые были связаны с кальцификацией мягких тканей и сосудов, а также с неблагоприятными сердечно-сосудистыми исходами у пациентов с терминальной стадией почечной недостаточности.
Лечение стеролами витамина D, такими как кальцитриол, парикальцитол или доксеркальциферол, эффективно снижает уровни паратиреоидного гормона (ПТГ) в плазме крови у многих пациентов со вторичным гиперпаратиреозом из-за терминальной стадии почечной недостаточности (ТПН) (1–5).Однако концентрации кальция и фосфора в сыворотке часто повышаются во время терапии витамином D, а эпизоды гиперкальциемии, гиперфосфатемии или того и другого часто ограничивают безопасные дозы (6,7). Поскольку гиперкальциемия и гиперфосфатемия могут усугубить кальцификацию мягких тканей и сосудов и могут способствовать развитию сердечно-сосудистых заболеваний у тех, кто проходит регулярный диализ (8–10), существует значительный интерес к поиску альтернативных стратегий контроля избыточной секреции ПТГ у таких пациентов.
Кальцимиметические агенты представляют собой небольшие органические соединения, которые действуют как аллостерические активаторы кальций-чувствительных рецепторов в паращитовидных железах и других тканях (11,12). Они снижают порог активации кальций-чувствительных рецепторов внеклеточными ионами кальция, тем самым уменьшая секрецию паратироидного гормона (ПТГ). Нацеливаясь непосредственно на молекулярный механизм, который модулирует регулируемое кальцием высвобождение ПТГ из клетки паращитовидной железы, кальцимиметические соединения обеспечивают новый подход к управлению избыточной секрецией ПТГ при некоторых клинических заболеваниях, включая вторичный гиперпаратиреоз, вызванный хронической почечной недостаточностью (13).
Предыдущие краткосрочные исследования показали, что пероральные дозы кальцимиметического агента R-568 снижают уровни ПТГ в плазме у гемодиализных пациентов с вторичным гиперпаратиреозом (14,15). Однако биодоступность R-568 ограничена, а фармакокинетика препарата значительно различается среди пациентов (15). Таким образом, влияние лечения R-568 на уровни ПТГ в плазме и, в частности, на концентрацию кальция в сыворотке неоднородно (15). Для решения этих проблем был разработан другой фенилалкиламин, известный как AMG 073, с кальцимиметическими свойствами, аналогичными свойствам R-568.Биодоступность AMG 073 после перорального приема выше, и он демонстрирует более последовательный фармакокинетический профиль, чем R-568 (Amgen Inc., неопубликованные данные).
Текущее предварительное исследование было предпринято для характеристики эффекта различных однократных перорально вводимых доз AMG 073 на уровни ПТГ в плазме и на концентрацию кальция в сыворотке у взрослых гемодиализных пациентов с вторичным гиперпаратиреозом. Также оценивалась биохимическая реакция на различные дозы AMG 073, вводимые один раз в день в течение 8 дней подряд.
Материалы и методы
Популяция исследования
Пациенты имели право на участие в исследовании, если им было 18 лет и старше, они были стабильны с медицинской точки зрения и получали лечение в течение не менее 3 месяцев с помощью гемодиализа три раза в неделю. Потенциальные участники исследования были оценены в течение 21-дневного интервала скрининга, непосредственно предшествующего их начальной дозе AMG 073. Чтобы убедиться, что биохимические данные, используемые для определения права на участие, точно отражают стационарные условия каждого кандидата в исследование, никаких корректировок доз витамина D не требуется. стерины, добавки кальция или фосфатсвязывающие агенты, или до концентрации кальция в растворах для гемодиализа были разрешены в течение периода скрининга.
Все кандидаты в исследование имели биохимические доказательства вторичного гиперпаратиреоза, о чем судили по результатам двух определений ПТГ в плазме, полученных с интервалом не менее 1 недели и в пределах 21 дня от начальной дозы AMG 073, которые были между 250 и 1500 пг / мл. Дополнительными критериями включения были значения общего кальция в сыворотке ≥9,0 мг / дл после поправки на концентрации сывороточного альбумина, уровни фосфора в сыворотке ≥2,5 мг / дл и уровни алюминия в сыворотке <40 мкг / л. Участники исследования также должны были иметь уровень гемоглобина ≥10 г / дл или гематокрит крови ≥30%, рентгенограмму грудной клетки за последние 6 месяцев, не показывающую признаков активного паренхиматозного заболевания, и индекс массы тела от 15 до 40 кг / м 2 .
Женщины детородного возраста были исключены из исследования, если они ранее не были стерилизованы хирургическим путем по другим медицинским причинам. Пациенты не включались в исследование, если сывороточные уровни печеночных трансаминаз или билирубина более чем в два раза превышали верхний предел нормы. Дополнительные критерии исключения включали в себя судороги в анамнезе в течение последних 12 месяцев, злокачественные новообразования в течение последних 5 лет, гипертиреоз, инфаркт миокарда в течение предыдущих 6 месяцев, нарушение сердечного желудочкового ритма, требующее активного лечения, желудочно-кишечное расстройство, которое может повлиять на абсорбцию лекарств. при пероральном приеме или при гранулематозных заболеваниях, которые могут вызвать гиперкальциемию.
Дизайн исследования
Исследование проводилось в две фазы, фазу однократного приема и фазу многократного приема, каждая из которых была завершена как рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое клиническое исследование. Все процедуры исследования были рассмотрены и одобрены наблюдательными советами учреждений в каждом исследовательском центре, и от каждого участника было получено письменное информированное согласие.
Однодозовая фаза
Первая фаза исследования была предпринята для оценки биохимического ответа на однократные пероральные дозы AMG 073 или плацебо.Первоначально участники были рандомизированы для лечения либо плацебо, либо 5 мг AMG 073. Последующие оценки, в которых использовались постепенно более высокие дозы AMG 073, проводились только после того, как клинические и биохимические результаты для предыдущей группы доз были рассмотрены консультативным комитетом по безопасности. Для фазы исследования однократной дозы пациентов случайным образом распределили на лечение 5 мг ( n = 8), 10 мг ( n = 8), 25 мг ( n = 6), 50 мг ( n = 6), 75 мг ( n = 6) или 100 мг ( n = 6) AMG 073 или плацебо ( n = 12).Девяносто восемь пациентов были отобраны как потенциальные участники исследования, и 52 из них были включены в исследование. Средний возраст пациентов, принимавших участие в фазе исследования с однократной дозой, составлял 48 ± 14 лет (от 19 до 75 лет).
Дозы AMG 073 были даны перорально в течение 3 часов после завершения регулярно запланированного лечения гемодиализом. Пациенты были госпитализированы на 3 дня сразу после гемодиализа для введения исследуемого препарата и для процедур мониторинга безопасности.При поступлении участники исследования прошли медицинский осмотр и взяли кровь для общего анализа крови и для различных исходных или предварительных биохимических определений. Они включали измерения уровней общего кальция и фосфора в сыворотке и концентрации ПТГ в плазме.
Дополнительные образцы крови были получены через 30 минут и 1, 2, 4, 8, 12, 24, 48 и 72 часа после введения AMG 073. Концентрации кальция в сыворотке и уровни ПТГ в плазме определялись для каждого образца.Последующие сеансы гемодиализа после тестовых доз AMG 073 были продолжены в соответствии с обычным графиком лечения пациента.
Фаза многократного введения
Для фазы исследования с несколькими дозами участники исследования были случайным образом распределены для приема однократных ежедневных пероральных доз 10 мг ( n = 8), 25 мг ( n = 6) или 50 мг ( n = 9) AMG 073 или плацебо ( n = 7) в течение 8 дней. Последующие оценки проводились на 11 и 15 дни исследования (3 и 7 дней соответственно) после последней дозы AMG 073 или плацебо.Пациенты, которые участвовали в фазе исследования с однократной дозой, имели право участвовать в 8-дневном многодозовом исследовании после 4-недельного интервала. Двадцать семь из 30 пациентов, которые вошли в фазу исследования с множественными дозами, ранее получали однократные пероральные дозы AMG 073; 3 не было. Средний возраст участников фазы многократного введения препарата составлял 46 ± 16 лет (диапазон от 19 до 77 лет).
Поскольку влияние повторных суточных доз AMG 073 на концентрацию кальция в сыворотке крови на момент начала исследования было неизвестно, участники были рандомизированы для лечения плацебо или самой низкой дозы AMG 073: 10 мг.Комитет по мониторингу безопасности рассмотрел клинические и биохимические результаты для когорты с дозировкой 10 мг, прежде чем пациенты были назначены на лечение следующей большей дозой AMG 073 (25 мг). Точно так же результаты когорты с дозировкой 25 мг были проанализированы до того, как пациенты были рандомизированы для лечения 50 мг AMG 073 или плацебо.
Начальные дозы AMG 073 в первый день исследования вводились в течение 3 часов после завершения плановых процедур гемодиализа и после того, как пациенты были госпитализированы.Последующие дозы для оставшихся 8 дней лечения вводились в то же время дня. За участниками исследования наблюдали в больнице на протяжении всего курса лечения. Все дозы AMG 073 в дни, соответствующие регулярно запланированным сеансам диализа, вводились после гемодиализа.
В первый и восьмой день лечения образцы крови были взяты непосредственно перед и через 0,5, 1, 2, 4, 8, 12 и 24 часа после доз AMG 073 для последующего определения уровней общего кальция в сыворотке и уровней ПТГ в плазме.Образцы крови для измерения ПТГ в плазме и сывороточного кальция собирали непосредственно перед дозированием в каждый день лечения, а уровни фосфора в сыворотке измеряли в первый, четвертый и восьмой день лечения. Дополнительные образцы крови были взяты через 4 и 12 часов после каждой дозы AMG 073 для мониторинга концентрации кальция в сыворотке в целях безопасности. Для всех дней, в которые вводили AMG 073, исходно или перед дозой, образцы крови для биохимических измерений были взяты непосредственно перед введением лекарства.Образцы крови для биохимических определений после обработки на 11-й и 15-й день исследования получали в одно и то же время дня. Гемодиализ продолжали на протяжении всего исследования с помощью ранее установленных индивидуализированных схем лечения. Все параметры диализа, включая концентрацию кальция в диализате, поддерживались постоянными на протяжении всего исследования.
У трех пациентов, которым первоначально назначалось лечение суточными дозами 50 мг AMG 073, доза была снижена до 25 мг на второй или третий день исследования.У 2 пациентов дозы были снижены, поскольку концентрация общего кальция в сыворотке временно упала ниже 8,0 мг / дл; доза была уменьшена у третьего пациента из-за тошноты, которая возникла вместе с концентрацией кальция в сыворотке 8,2 мг / дл. Ни у одного из этих пациентов не было симптомов гипокальциемии, и все успешно завершили 8 дней лечения AMG 073 в более низкой дозе 25 мг / день.
Лабораторные определения
Концентрация электролитов в сыворотке и уровни общего кальция, фосфора, аспартатаминотрансферазы и аланинаминотрансферазы в сыворотке измерялись с помощью автоанализатора Hitachi 747-200 (15).Уровни гемоглобина измеряли автоматическими методами, как описано ранее, а значения гематокрита определяли центрифугированием (15). Уровни ПТГ в плазме измеряли с помощью иммунорадиометрического анализа с двумя антителами (Allegro PTH; Nichols Institute Diagnostics, Сан-Хуан-Капистрано, Калифорния) (16). Концентрации кальция в сыворотке были скорректированы с учетом изменений уровней альбумина в плазме, и скорректированные значения представлены.
Статистический анализ
Все результаты выражены как среднее ± 1 стандартное отклонение.Для фазы исследования с однократной дозой максимальное снижение в процентах уровней ПТГ в плазме от значений до введения между группами сравнивалось с помощью ANOVA (17). Для фазы исследования с множественными дозами снова использовали ANOVA для сравнения процентного изменения от исходных значений уровней ПТГ в плазме на восьмой день лечения среди групп лечения (17). Для всех статистических тестов P <0,05 считалось значимым.
Результаты
Ответ на разовые дозы AMG 073
Исходные или предварительные уровни ПТГ в плазме не различались среди пациентов, получавших плацебо или различные дозы AMG 073.Уровни кальция и фосфора в сыворотке также не различались между группами (Таблица 1). Средний возраст пациентов, продолжительность лечения диализом перед исследованием, доля пациентов с диабетом, процент пациентов, которые ранее лечились стеролами витамина D, и количество пациентов, ранее перенесших паратиреоидэктомию, не различались среди пациентов, получавших плацебо. или различные дозы AMG 073 (данные не показаны).
Таблица 1.Исходные биохимические данные для пациентов, получавших однократные пероральные дозы AMG 073 или плацебо a
Уровни ПТГ в плазме снизились по сравнению со значениями до лечения в течение нескольких часов у пациентов, получавших однократные пероральные дозы 25, 50, 75 или 100 мг AMG 073.Напротив, значения оставались неизменными у пациентов, получавших 5- или 10-мг дозы AMG 073 (данные не показаны) или плацебо (Рисунок 1). Наибольшее процентное снижение концентраций ПТГ наблюдалось через 2-4 часа после введения лекарственного средства, и значения значительно различались между группами лечения ( P <0,0001 по ANOVA). Максимальное снижение составило 57 ± 24%, 59 ± 16%, 59 ± 23% и 72 ± 11% у пациентов, получавших 25, 50, 75 или 100 мг AMG 073, соответственно. Уровни ПТГ в плазме оставались ниже значений до лечения в течение 24 часов у пациентов, получавших 25-, 50- или 100-мг дозы AMG 073, но возвращались к уровням до введения через 8 часов у тех, кто получал дозы 75 мг.
Рис. 1. График, показывающий уровни паратироидного гормона (ПТГ) в плазме, выраженные в процентах от значений до введения дозы, в течение первых 24 часов после однократного перорального введения 25, 50, 75 или 100 мг AMG 073 при гемодиализе пациенты со вторичным гиперпаратиреозом. Планки погрешностей опущены для ясности.
Снижение уровней ПТГ в плазме после однократных доз AMG 073, выраженное либо в абсолютных единицах концентрации, либо в процентах от значений до лечения, не было связано с уровнем кальция или ПТГ перед введением дозы.Уровни ПТГ в плазме снизились у всех субъектов, получавших дозы от 25 до 100 мг AMG 073, независимо от биохимической тяжести вторичного гиперпаратиреоза, если судить по исходным или предварительным значениям ПТГ в плазме. Например, исходные уровни ПТГ в плазме варьировались от 402 до 1801 пг / мл у пациентов, получавших 100 мг AMG 073 (рис. 2A), но значения уменьшались на такой же процент у каждого пациента в течение первых 24 часов после введения препарата (рис. 2Б).
Рисунок 2. График, показывающий уровни паратиреоидного гормона (ПТГ) в плазме у 6 гемодиализных пациентов с вторичным гиперпаратиреозом в течение первых 24 часов после однократного перорального введения 100 мг AMG 073. Уровни ПТГ в плазме перед дозой варьировались от 402 до 1801 пг / мл, а значения снижались. у каждого пациента (А). Процентное снижение уровней ПТГ в плазме через различные интервалы после введения AMG 073 было сходным, несмотря на заметно разные значения перед дозой (B). Графики отражают значения для отдельных пациентов.
Концентрация общего кальция в сыворотке умеренно снизилась у пациентов, получавших 75- или 100-мг дозы AMG 073, но не изменилась у тех, кто получал меньшие дозы (рис. 3). Концентрация кальция в сыворотке достигла самого низкого уровня через 8–12 часов после доз 75 и 100 мг AMG 073 и оставалась ниже значений до лечения в течение 24 часов. Уровни кальция в сыворотке вернулись к значениям до введения и не отличались от них через 48 часов после доз 75 или 100 мг AMG 073. Ни у одного из пациентов, получавших однократные дозы AMG 073 или плацебо, не развились признаки или симптомы гипокальциемии.Максимальное снижение концентрации общего кальция в сыворотке составило в среднем 1,0 ± 0,7 мг / дл и 0,9 ± 0,4 мг / дл у пациентов, получавших 75 или 100 мг AMG 073, соответственно.
Рис. 3. График, показывающий концентрацию общего кальция в сыворотке до и в течение первых 24 часов после однократного перорального введения 25, 50, 75 или 100 мг AMG 073 или плацебо. Планки погрешностей опущены для ясности.
Ответ на ежедневные пероральные дозы AMG 073 в течение 8 дней
Уровни ПТГ в плазме до введения дозы в первый день исследования не различались у пациентов, которым назначалось 8 дней лечения 10, 25 или 50 мг AMG 073 или плацебо (таблица 2).Точно так же не было различий между группами в исходных концентрациях кальция или фосфора в сыворотке. У трех пациентов, которым первоначально вводили 50 мг AMG 073, доза была снижена до 25 мг, поскольку у одного возникла тошнота, а у двух других концентрация кальция в сыворотке крови временно упала ниже 8,0 мг / дл. Эти 3 пациента далее обозначены как группа 50/25 мг. Исходные концентрации кальция и фосфора в сыворотке и базальные уровни ПТГ в плазме у этой подгруппы пациентов не отличались от показателей в трех других группах.В целом, средний возраст пациентов, продолжительность лечения диализом, доля пациентов с диабетом, процент пациентов, которые ранее получали витамин D, и количество пациентов, перенесших паратиреоидэктомию, не различались среди 10-, Группы с дозами 25, 50 и 50/25 мг (данные не показаны).
Таблица 2.Исходные биохимические результаты для пациентов, получавших ежедневные пероральные дозы 10, 25, 50 или 50/25 мг AMG 073 или плацебо в течение 8 дней
Уровни ПТГ в плазме в первый день лечения существенно снизились по сравнению с исходными значениями после доз 25 или 50 мг AMG 073, но не изменились после доз 10 мг.Таким образом, результаты были аналогичны тем, которые наблюдались после однократного перорального введения. Наибольшее снижение уровня ПТГ в плазме произошло через 2 часа после приема препарата, в среднем 39,6 ± 33,1% и 44,5 ± 30,8% у пациентов, которые получали дозы AMG 073 в дозе 25 или 50 мг, соответственно. После этого уровни ПТГ в плазме постепенно повышались до значений до лечения, но оставались ниже исходных уровней в течение 24 часов у пациентов, получавших 25 или 50 мг AMG 073.
Аналогичное процентное снижение уровней ПТГ в плазме наблюдалось на восьмой день лечения.Значения упали с 401 ± 238 до 233 ± 84 пг / мл, или на 42%, через 4 часа после доз 25 мг и с 663 ± 624 до 455 ± 481 пг / мл, или на 32%, через 4 часа после приема 50 мг. дозы AMG 073. В отличие от этих результатов, уровни ПТГ в плазме не изменились на восьмой день лечения у пациентов, получавших плацебо или дозы AMG 073 в дозе 10 мг.
Уровни ПТГ в плазме, измеренные в образцах плазмы, полученных непосредственно перед каждой дозой и через 24 часа после введения дозы, снизились в течение первых 3-4 дней лечения у пациентов, получавших ежедневные дозы 25 или 50 мг AMG 073 в течение 8 дней (рис. 4).Значения также снизились в группе 50/25 мг, несмотря на раннее снижение дозы. Напротив, значения ПТГ в плазме оставались неизменными у пациентов, получавших плацебо или 10 мг AMG 073 в течение 8 дней. Снижение уровней ПТГ в плазме от исходных значений на восьмой день лечения составило в среднем 28 ± 17% в группе 25 мг, 27 ± 34% в группе 50 мг и 34 ± 39% в группе 50/25 мг. группа. В совокупности процентное изменение уровней ПТГ в плазме для этих трех групп лечения отличалось от такового у пациентов, получавших плацебо ( P = 0.05 по ANOVA).
Рис. 4. График, показывающий уровни паратироидного гормона (ПТГ) в плазме, выраженные как процент от значений до лечения, в течение 8 дней лечения кальцимиметическим агентом AMG 073 у гемодиализных пациентов с вторичным гиперпаратиреозом. Пациенты получали перорально однократно в день дозы 10 (данные не показаны), 25 или 50 мг. У 3 пациентов доза AMG 073 была снижена с 50 до 25 мг в первый или второй день лечения, обозначенная как группа 50/25 мг.Значения в первый день лечения представляют собой исходные определения, полученные до начальной дозы AMG 073. Планки погрешностей опущены для ясности. В совокупности процентное снижение уровней ПТГ в плазме от исходных значений отличалось у пациентов, получавших AMG 073, по сравнению с плацебо ( P = 0,05 по ANOVA).
Концентрация кальция в сыворотке крови оставалась неизменной у пациентов, получавших плацебо или 10 мг AMG 073 в течение 8 дней, но была несколько ниже после последнего дня лечения в группе пациентов с дозировкой 25 мг (рис. 5).Значения были на 5-10% ниже исходного уровня в течение пятого-восьмого дня лечения у пациентов, получавших дозы 50 мг. Концентрация кальция в сыворотке также была ниже на второй день лечения в группе 50/25 мг, но повысилась на третий день после того, как доза AMG 073 была снижена. Однако концентрации кальция в сыворотке снова были ниже с четвертого по восьмой день лечения, несмотря на более раннее снижение дозировки (рис. 5).
Рис. 5. График, иллюстрирующий уровни общего кальция в сыворотке во время лечения однократными пероральными дозами кальцимиметика AMG 073, вводимыми ежедневно в течение 8 дней, у гемодиализных пациентов с вторичным гиперпаратиреозом.Значения в первый день лечения представляют собой исходные определения, полученные до начальной дозы AMG 073. Планки погрешностей опущены для ясности.
Эпизоды гипокальциемии во время лечения AMG 073 были временными и произошли от 30 минут до 12 часов после приема лекарства. У 23 пациентов, получавших различные дозы AMG 073 в течение 8 дней, исходно или перед дозой, уровни кальция в сыворотке 3 раза были <8,0 мг / дл. Одно произошло на пятый день лечения, а другое - на седьмой день лечения у 2 разных пациентов из когорты, получавшей дозу 50 мг; третий произошел на пятый день лечения у пациента в группе 50/25 мг.
Концентрации фосфора в сыворотке крови через 8 дней лечения были ниже, чем исходные значения во всех 4 группах пациентов, получавших AMG 073, но не изменились у пациентов, получавших плацебо (рис. 6). Значения продукта ионов кальция и фосфора в сыворотке также были ниже, чем исходные уровни после 8 дней лечения AMG 073, но не отличались от исходных значений у пациентов, получавших плацебо (рис. 6).
Рис. 6. График, иллюстрирующий средние процентные изменения уровней фосфора в сыворотке и значений продукта ионов кальция и фосфора в сыворотке после 8 дней лечения однократными пероральными дозами кальцимиметического агента AMG 073 в день у гемодиализных пациентов с вторичным гиперпаратиреоз.Значения выражены как среднее ± SE.
Все пациенты успешно завершили 8 дней лечения AMG 073 или плацебо, и все пациенты наблюдались в течение дополнительных 7 дней после окончания лечения. Ни у одного из пациентов не было признаков или симптомов гипокальциемии. Частота побочных эффектов, приписываемых лечению, не различалась среди пациентов, получавших различные дозы AMG 073 или плацебо. Наиболее частыми событиями, о которых сообщалось как у пациентов, получавших плацебо, так и у пациентов, получавших AMG 073, были тошнота, рвота, головная боль и гипертония перед регулярными запланированными сеансами диализа.
Обсуждение
Результаты исследования, представленные здесь, показывают, что лечение кальцимиметиком AMG 073 эффективно снижает уровни ПТГ в плазме у пациентов со вторичным гиперпаратиреозом, вызванным ТПН. После однократного перорального приема доз в диапазоне от 25 до 100 мг уровни ПТГ в плазме снизились на 40-60% через 2 часа. Величина ответа во многом зависела от дозы. Самая низкая доза AMG 073, которая последовательно снижала уровни ПТГ в плазме, составляла 25 мг, тогда как большее процентное снижение уровней ПТГ в плазме было достигнуто при дозах 75 и 100 мг.Уровни ПТГ в плазме снизились у всех пациентов, получавших дозы от 25 до 100 мг, независимо от биохимической тяжести вторичного гиперпаратиреоза.
У пациентов, получавших ежедневные дозы 25 или 50 мг AMG 073 в течение 8 дней, уровни ПТГ в плазме снизились на 30-40% в течение первых нескольких дней лечения и оставались ниже исходных значений при оценке с использованием результатов, полученных непосредственно перед каждым ежедневным приемом. доза — то есть через 24 часа после предыдущей дозы. Однако значительно большее снижение уровней ПТГ в плазме было очевидным в первый и восьмой день лечения, когда измерения проводились в образцах плазмы, полученных чаще в течение 24 часов сразу после приема ежедневных доз AMG 073.Концентрации ПТГ в плазме были на 50-70% ниже значений перед введением через 2-4 часа после доз 25 или 50 мг, уровни существенно ниже, чем уровни, определенные через 12-24 часа. Таким образом, измерения ПТГ перед введением дозы занижают эффективность суточных доз AMG 073 в снижении уровней ПТГ в плазме в течение дня у пациентов со вторичным гиперпаратиреозом, вызванным ТПН.
Концентрация кальция в сыворотке незначительно снизилась в течение 8 дней лечения ежедневным пероральным приемом 25 или 50 мг AMG 073, но ни у одного из пациентов не развились признаки или симптомы гипокальциемии.Особый интерес представляет снижение уровня фосфора в сыворотке крови на 20–30%. Значения продукта ионов кальция и фосфора в сыворотке также снизились, в первую очередь в результате снижения уровней фосфора в сыворотке. Такие результаты показывают, что повторные ежедневные дозы AMG 073 не только снижают биохимическую тяжесть вторичного гиперпаратиреоза у пациентов, находящихся на регулярном гемодиализе, но также благоприятно влияют на некоторые нарушения минерального метаболизма, которые, как предполагается, способствуют кальцификации сосудов и мягких тканей и смертности от сердечно-сосудистых заболеваний у пациентов с ХПН (8,18).Однако потребуются более длительные исследования, чтобы определить, можно ли достичь аналогичных изменений уровней фосфора в сыворотке и значений продукта ионов кальция и фосфора в сыворотке во время длительного лечения AMG 073.
Механизм, ответственный за снижение концентрации кальция и фосфора в сыворотке крови во время лечения AMG 073 и другими кальцимиметическими соединениями, остается неясным. Снижение уровней кальция в сыворотке было постоянным обнаружением после введения достаточно больших доз кальцимиметиков крысам, подвергнутым субтотальной нефрэктомии (19–21), а концентрация кальция в сыворотке снизилась у некоторых взрослых гемодиализных пациентов с вторичным гиперпаратиреозом, которым давали фиксированные суточные дозы кальцимиметическое соединение R-568 в течение 15 дней (15).Поскольку уровни ПТГ в плазме резко падают после введения кальцимиметических агентов, отток кальция и фосфора из кости в плазму может существенно снижаться, что приводит к снижению уровней кальция и фосфора в сыворотке в течение нескольких часов. Этот механизм, вероятно, объясняет снижение концентрации кальция и фосфора в сыворотке, которое происходит после хирургической паратиреоидэктомии, клинического состояния, известного как «синдром голодных костей». С другой стороны, активация кальциевого рецептора в кости или других тканях теоретически может объяснять быстрые изменения уровней кальция и фосфора в сыворотке после введения кальцимиметических агентов (22,23).На сегодняшний день доступно мало информации, которая напрямую решает эту проблему.
Необходимы дополнительные исследования, чтобы прояснить роль одновременной терапии стеролами витамина D или перорально вводимыми кальциевыми добавками в качестве средства компенсации эффекта кальцимиметических агентов на снижение концентрации кальция в сыворотке. Доля пациентов, которым может потребоваться такое вмешательство, остается неопределенной, а роль альтернативных режимов дозирования, которые могли бы ослабить кальцимиметический эффект кальцимиметических соединений, еще предстоит полностью оценить.Однако кальцимиметические соединения могут быть особенно ценными при лечении пациентов со вторичным гиперпаратиреозом, у которых уровень кальция в сыворотке крови уже незначительно или явно повышен и у которых терапия витамином D часто приводит к дальнейшему повышению концентрации кальция и фосфора в сыворотке.
Текущее лечение вторичного гиперпаратиреоза, вызванного хронической почечной недостаточностью, в основном основывается на использовании пероральных добавок кальция и перорального или внутривенного введения стеролов витамина D для контроля избыточной секреции ПТГ (24).Оба вмешательства действуют непосредственно на клетки паращитовидной железы, уменьшая транскрипцию пре-про-ПТГ и синтез гормонов, но они также повышают концентрацию кальция в сыворотке, что косвенно приводит к снижению секреции ПТГ (24). Лечение витамином D часто увеличивает уровень фосфора в сыворотке и значения продукта ионов кальция и фосфора в сыворотке. Эти изменения вместе с повышением концентрации кальция в сыворотке часто ограничивают дозы, которые можно безопасно вводить пациентам с ТПН. Гиперкальциемия часто встречается во время терапии витамином D, особенно у тех, кто уже принимает внутрь большие дозы кальция в качестве фосфатсвязывающих агентов.Из-за опасений по поводу нарушений метаболизма кальция и фосфора и терапевтических вмешательств, используемых для их лечения, поскольку они являются потенциальными факторами кальцификации сосудов и мягких тканей у пациентов с хронической почечной недостаточностью, альтернативные стратегии контроля избыточной секреции ПТГ у таких пациентов представляют значительный интерес. (25).
Несколько новых стеролов витамина D стали доступны для лечения вторичного гиперпаратиреоза у пациентов с ТПН (24).К ним относятся 19-нор-1,25-дигидроксивитамин D 2 или парикальцитол и 1α-гидроксивитамин D 2 или доксеркальциферол (3–5). Было показано, что оба препарата эффективно снижают уровни ПТГ в плазме у гемодиализных пациентов с вторичным гиперпаратиреозом, а уровни кальция и фосфора в сыворотке мало изменяются или незначительно повышаются в течение 12–16 недель лечения. Однако концентрации кальция и фосфора в сыворотке не снижаются, даже когда уровни ПТГ в плазме падают у тех, кто положительно реагирует на лечение стеролами витамина D, тогда как уровни кальция и фосфора в сыворотке снизились во время лечения AMG 073.Различия в механизме действия кальцимиметических агентов и стеринов витамина D, вероятно, объясняют несопоставимые биохимические реакции на эти два разных класса терапевтических агентов (24).
Таким образом, повторные ежедневные пероральные дозы кальцимиметического агента AMG 073 эффективно снижают уровни ПТГ в плазме, снижают концентрацию фосфора в сыворотке и снижают содержание ионов кальция и фосфора у гемодиализных пациентов с вторичным гиперпаратиреозом. Кальцимиметические соединения представляют собой новый подход к контролю избыточной секреции ПТГ у пациентов с хронической почечной недостаточностью, и их использование может благоприятно повлиять на некоторые потенциально опасные нарушения минерального обмена у пациентов с ТПН.Для установления безопасности и долгосрочной пользы кальцимиметической терапии у пациентов с вторичным гиперпаратиреозом потребуются дополнительные исследования. Тем не менее, кальцимиметические соединения обеспечивают эффективное терапевтическое вмешательство для контроля избыточной секреции ПТГ с потенциально благоприятным воздействием на минеральный метаболизм у пациентов с ТПН.
Благодарности
Эта работа была поддержана Amgen Inc. и грантами USPHS DK-52905, DK-60107 и RR-00865. Мы благодарим следующих врачей за их усилия по включению пациентов и клиническому ведению участников этого клинического исследования: Хаим Чарытан, М.D., Медицинский центр Нью-Йоркской больницы, Нью-Йорк, штат Нью-Йорк; Памела Фолл, доктор медицины, Медицинский колледж Джорджии, Огаста, Джорджия; Марк С. Кипнес, доктор медицины, Клиника диабета и заболеваний желез, Сан-Антонио, Техас; Ричард Дж. Новек, доктор медицины, Центр клинических исследований, Новый Орлеан, Луизиана; Доменик А. Сика, доктор медицины, Медицинский колледж Вирджинии, Ричмонд, Вирджиния; Susan Swan, M.D., Total Renal Research — Медицинский центр округа Хеннепин, Миннеаполис, Миннесота; Мартин Топиль, доктор медицины, Институт матричных исследований, Mt. Лорел, штат Нью-Джерси; и Майкл Валчик, доктор медицины, Северо-западная почечная клиника — Центр исследований и технологий наследия, Портленд, штат Орегон.
- © 2002 Американское общество нефрологов
Ссылки
- ↵
Delmez JA, Tindira C, Grooms P, Dusso A, Windus DW, Slatopolsky E: Подавление паратироидного гормона внутривенным введением 1,25-дигидроксивитамина D: роль в повышенной чувствительности к кальцию. J Clin Invest 83: 1349–1355, 1989
Андресс Д.Л., Норрис К.С., Коберн Дж. В., Слатопольский Е. А., Шеррард Д. Д.: Внутривенное введение кальцитриола в лечении рефрактерного фиброзного остита хронической почечной недостаточности.N Engl J Med 321: 274–279, 1989
- ↵
Martin KJ, Gonzalez EA, Gellens M, Hamm LL, Abboud H, Lindberg J: 19-Nor-1-α-25-дигидроксивитамин D 2 (парикальцитол) безопасно и эффективно снижает уровень интактного паратироидного гормона у пациентов на гемодиализе. J Am Soc Nephrol 9: 1427–1432, 1998
Tan AUJr, Levine BS, Mazess RB, Kyllo DM, Bishop CW, Knutson JC, Kleinman KS, Coburn JW: Эффективное подавление паратироидного гормона 1 альфа-гидрокси-витамином D 2 у гемодиализных пациентов с вторичным гиперпаратиреоз.Почки Int 51: 317–323, 1997
- ↵
Frazao JM, Elangovan L, Maung HM, Chesney RW, Archiado SR, Bower JD, Kelly BJ, Rodriguez HJ, Norris KC, Robertson JA, Levine BS, Goodman WG, Gentile D, Mazess RB, Kyllo DM, Douglass LL, Bishop CW, Coburn JW: Прерывистая терапия доксеркальциферолом (1α-гидроксивитамин D 2 ) для вторичного гиперпаратиреоза. Am J Kidney Dis 36: 562–565, 2000
- ↵
Coburn JW, Salusky IB, Norris KC, Goodman WG: Пероральный и парентеральный кальцитриол для лечения терминальной стадии почечной недостаточности.Contrib Nephrol 90: 166–182, 1991
- ↵
Коричневый AJ: аналоги витамина D. Am J Kidney Dis 32 [Дополнение 2]: 25 – S39, 1998
- ↵
Goodman WG, Goldin J, Kuizon BD, Yoon C, Gales B, Sider D, Wang Y, Chung J, Emerick A, Greaser L, Elashoff RM, Salusky IB: Кальцификация коронарных артерий у молодых людей с терминальной почечной недостаточностью кто проходит диализ. N Engl J Med 342: 1478–1483, 2000
Guérin AP, London GM, Marchais SJ, Metivier F: Жесткость артерий и кальцификации сосудов при терминальной стадии почечной недостаточности.Трансплантат Nephrol Dial 15: 1014–1021, 2000
- ↵
Block GA, Hulbert-Shearon TE, Levin NW, Port FK: Ассоциация сывороточного фосфора и продукта кальция × фосфор с риском смертности у пациентов, находящихся на хроническом гемодиализе: национальное исследование. Am J Kidney Dis 31: 607–617, 1998
- ↵
Hammerland LG, Garrett JE, Hung BCP, Levinthal C, Nemeth EF: аллостерическая активация рецептора Ca 2+ , экспрессируемого в ооцитах Xenopus laevis с помощью NPS 467 или NPS 568.Mol Pharmacol 53: 1083–1088, 1998
- ↵
Nemeth EF, Steffey ME, Hammerland LG, Hung BC, Van Wagenen BC, DelMar EG, Balandrin MF: кальцимиметики с сильной и селективной активностью в отношении рецептора кальция паращитовидной железы. Proc Natl Acad Sci USA 95: 4040–4045, 1998
- ↵
Nemeth EF: Рецепторы кальция как новые мишени для лекарств. В: Принципы биологии костей., Под редакцией Билезикян Дж. П., Райс Л. Г., Родан Г. А., Сан-Диего, Academic Press, 1996, стр. 1019–1035
- ↵
Antonsen JE, Sherrard DJ, Andress DL: кальцимиметический агент резко подавляет уровни паратироидного гормона у пациентов с хронической почечной недостаточностью.Почки Int 53: 223–227, 1998
- ↵
Goodman WG, Frazao JM, Goodkin DA, Turner SA, Liu W., Coburn JW: Кальцимиметический агент снижает уровень паратиреоидного гормона в плазме у пациентов со вторичным гиперпаратиреозом. Почки Инт 58: 436–445, 2000
- ↵
Nussbaum SR, Zahradnik RJ, Lavigne JR, Brennan GL, Nozawa-Ung C, Kim LY, Keutmann T., Wang CA, Potts JTJr, Segre GV: высокочувствительный двухсайтовый иммунорадиометрический анализ паратирина и его клиническая полезность при оценке пациенты с гиперкальциемией.Clin Chem 33: 1364–1367, 1987
- ↵
Dixon WJ, Massey FJ: Введение в статистический анализ. 4-е изд., Нью-Йорк, McGraw Hill Book Co., 1983
- ↵
Marchais SJ, Metivier F, Guerin AP, London GM: Ассоциация гиперфосфатемии с гемодинамическими нарушениями при терминальной стадии почечной недостаточности. Трансплантат Nephrol Dial 14: 2178–2183, 1999
- ↵
Fox J, Lowe SH, Petty BA, Nemeth EF: NPS R-568: кальцимиметическое соединение типа II, которое действует на кальциевые рецепторы паратироидных клеток крыс, снижая уровни паратироидного гормона и кальция в плазме.J Pharmacol Exp Ther 290: 473–479, 1999
Wada M, Ishii H, Furuya Y, Fox J, Nemeth EF, Nagano N: NPS R-568 останавливает или обращает вспять фиброзный остит у уремических крыс. Почки Int 53: 448–453, 1998
- ↵
Wada M, Nagano N, Furuya Y, Chin J, Nemeth EF, Fox J: Кальцимиметик NPS R-568 предотвращает гиперплазию паращитовидных желез у крыс с тяжелым вторичным гиперпаратиреозом. Почки Инт 57: 50–58, 2000
- ↵
Ямагути Т., Чаттопадхьяй Н., Кифор О., Йе С., Василев П.М., Сандерс Дж. Л., Браун Е.М.: Экспрессия внеклеточного кальций-чувствительного рецептора в линии клеток остеобластов человека MG-63.Am J Physiol Cell Physiol 280: C382 – C393, 2001
- ↵
Yamaguchi T., Kifor O, Chattopadhyay N, Brown EM: Экспрессия внеклеточного кальциевого (Ca 2+ o ) рецептора в клональных линиях клеток, подобных остеобластам, UMR-106 и SAOS-2. Biochem Biophys Res Commun 243: 753–757, 1998
- ↵
Goodman WG: Последние достижения в лечении вторичного гиперпаратиреоза.Почки Int 59: 1187–1201, 2001
- ↵
Block GA, Port FK: переоценка рисков, связанных с гиперфосфатемией и гиперпаратиреозом у диализных пациентов: рекомендации по изменению руководства. Am J Kidney Dis 35: 1226–1237, 2000
Энциклопедия здоровья | Сан-Диего, Калифорния
Основы
Написано врачами и редакторами UpToDate
Что такое позднее половое созревание? — Половое созревание — это термин, обозначающий изменения в организме, которые происходят, когда ребенок становится взрослым.Позднее половое созревание — это когда ребенок начинает половое созревание намного позже, чем обычно. Изменения тела в позднем половом созревании такие же, как и в нормальном половом созревании. Они просто случаются, когда ребенок подрастает.
Половое созревание обычно начинается в возрасте от 9 до 12 лет у девочек и в возрасте от 10 до 13 лет у мальчиков. С поздним половым созреванием:
● К 12 годам девочка не проявляет никаких признаков полового созревания. Обычно первым признаком полового созревания у девочек является увеличение груди.
● Мальчик не проявляет никаких признаков полового созревания к 14 годам.Обычно первым признаком полового созревания у мальчиков является увеличение яичек (рис. 1).
Что вызывает позднее половое созревание? — Половое созревание вызвано гормонами в организме. Мозг вырабатывает гормоны, запускающие половое созревание. Эти гормоны попадают в яички (у мальчиков) и яичники (у девочек) (рисунок 1 и рисунок 2). Гормоны мозга сигнализируют яичкам о выработке гормона под названием «тестостерон». Они сигнализируют яичникам о выработке гормона под названием «эстроген». Эстроген и тестостерон вызывают изменения в организме.
Позднее половое созревание может наступить, если этот процесс не произойдет вовремя. Но это не значит, что у вашего ребенка проблемы со здоровьем. Некоторые дети поздно начинают половое созревание, потому что:
● Они растут медленнее, чем другие дети. Это нормально.
● Позднее половое созревание проходит в их семье. Если родитель поздно переживал половое созревание, велики шансы, что его ребенок тоже. Особенно это касается мальчиков.
Другие дети поздно начинают половое созревание из-за проблем со здоровьем или состояния.Сюда могут входить:
● Аномальный рост или другая проблема в головном мозге, яичниках или яичках
● Длительное заболевание или состояние
● Проблемы, вызванные аномальными генами, с которыми могут родиться дети
Дети (особенно девочки) также могут поздно начать половое созревание, если они слишком худые, недоедают или занимаются физическими упражнениями намного больше, чем обычно.
Потребуются ли моему ребенку анализы? — Да. Если у вашего ребенка нет признаков полового созревания, врач или медсестра захотят узнать, почему.Он или она поговорит с вами и вашим ребенком и проведет экзамен. Он или она тоже, вероятно, сделает:
● Анализы крови
● Рентгеновские снимки одной из рук и запястий вашего ребенка. Эти рентгеновские снимки могут показать, насколько быстро растет ваш ребенок.
В зависимости от этих результатов врач может провести другие анализы. Они могут включать дополнительные анализы крови или компьютерную томографию, УЗИ или другие визуализационные исследования мозга или живота вашего ребенка. Визуализирующие тесты создают изображения внутренней части тела.
Врач или медсестра также со временем будут проводить повторные осмотры, чтобы следить за ростом и развитием вашего ребенка.
Как лечится позднее половое созревание? — Лечение зависит от возраста вашего ребенка и причины позднего полового созревания.
Если половое созревание задерживается из-за проблемы со здоровьем, врач лечит проблему (если ее можно вылечить). Различные методы лечения могут включать в себя лекарства (например, гормоны) или хирургическое вмешательство. После лечения у вашего ребенка, скорее всего, начнется половое созревание.
Если ваш ребенок нормален, но растет медленно, или если в его или ее семье наступает поздний период полового созревания, лечение обычно включает «наблюдение и ожидание» начала полового созревания самостоятельно.
Если у вашего ребенка недостаточный вес или он слишком много упражняется, врач может посоветовать вам, как помочь вашему ребенку достичь здорового веса и вести здоровый образ жизни.
Некоторым детям (в основном мальчики), которые здоровы, но медленно растут, лечат гормональную терапию, чтобы ускорить половое созревание.Врачи обычно рекомендуют это лечение только в том случае, если позднее половое созревание оказывает большое влияние на жизнь ребенка.
Чем еще я могу помочь своему ребенку? — Вы можете помочь своему ребенку чувствовать себя хорошо. Укажите на сильные стороны ребенка, а не сосредотачивайтесь на его теле. Некоторым детям, которые поздно начинают половое созревание, трудно приспособиться, потому что они выглядят моложе других детей своего возраста.
Если вашего ребенка дразнят или плохо обращаются, поговорите с врачом или медсестрой о том, как получить помощь.
Все темы обновляются по мере появления новых доказательств и завершения нашего процесса экспертной оценки.
Эта тема получена из UpToDate: 21 апреля 2016 г.
Тема 16738 Версия 4.0
Выпуск: 24.2 — C24.83
© UpToDate, Inc., 2016 Все права защищены.
рисунок 1: мужская репродуктивная анатомия
На этом рисунке показано, как выглядят репродуктивные органы мужчины.
Graphic 68075 Версия 6.0
рисунок 2: Женская репродуктивная анатомия
Это внутренние органы, составляющие репродуктивную систему женщины.
Graphic 80271 Версия 5.0
Использование информации для потребителей и отказ от ответственности
Эта информация не является конкретной медицинской консультацией и не заменяет информацию, которую вы получаете от своего поставщика медицинских услуг.Это лишь краткое изложение общей информации. Он НЕ включает всю информацию о состояниях, заболеваниях, травмах, тестах, процедурах, лечении, терапии, инструкции по выписке или выбранном образе жизни, который может относиться к вам. Вы должны поговорить со своим врачом для получения полной информации о вашем здоровье и вариантах лечения. Эта информация не должна использоваться для принятия решения о том, следует ли принимать советы, инструкции или рекомендации вашего поставщика медицинских услуг. Только ваш лечащий врач обладает знаниями и подготовкой, чтобы дать совет, который подходит вам.Использование контента UpToDate регулируется Условиями использования UpToDate. © 2016 UpToDate, Inc. Все права защищены.
Авторские права
© UpToDate, Inc., 2016 Все права защищены.
Mercedes-AMG GT 63 S 4 двери в гормоны — Autotrader
Великолепное четырехдверное купе немецкой марки со звездой уже обладает большой мощностью и взглядом на землю. И снова немецкие аналоги Brabus, незамеченные, но столь же безумные, решили резко улучшить технические характеристики Mercedes-AMG GT 63 S 4-дверный, а не то.Подготовка двигателя также актуальна для Mercedes-AMG GT, GT S, GT C и GT-R, в частности.
ЧИТАЙТЕ ТАКЖЕ: НАШ ТЕСТ-ДИСК MERCEDES AMG GT 63 S
830 л.с. и 1100 Нм крутящего момента
Начать слайд-шоуPosaidon RS 830 | фото Mercedes-AMG GT 63 S 4 двери подготовлено + 17
Фото: Posaidon
Не менее 191 л.с. и 200 Нм крутящего момента были добавлены к уже очень высоким значениям для оригинального Mercedes-AMG с битурбированным двигателем V8 4.0.Эта мельница, состоящая из 8-цилиндрового двигателя, наполненного свежим воздухом, сжатым двумя турбинами, первоначально была разработана немецким автопроизводителем. Он отличается большой мощностью от 639 л.с. и крутящим моментом 900 Нм.
У Mercedes-AMG конфигурация двигателя уже достаточно хороша, чтобы разогнать 4-дверный AMG GT 63 S от 0 до 100 км / ч за 3,2 секунды, а затем достичь 315 км / ч с 830 л.с. и 1100 Нм крутящего момента. Предлагаемый Posaidon, AMG GT теперь разгоняется от 0 до 100 км / ч за 2,9 секунды, а максимальная скорость достигает 350 км / ч.
ЧИТАЙТЕ ТАКЖЕ: НАШ ТЕСТ-ДИСК MERCEDES AMG GT C EDITION 50
Всегда сильнее
Начать слайд-шоуPosaidon RS 830 | фото Mercedes-AMG GT 63 S 4 двери подготовлено + 17
Фото: Posaidon
Если такая методика настройки вас раздражает, потому что этого все же недостаточно, тренер также предлагает комплект, который добавляет 50 л.с. и 100 Нм крутящего момента к предыдущим значениям. Препарат Posaidon RS 830+ развивает и 880 л.с. и 1200 Нм крутящего момента поступают на колеса с помощью автоматической коробки передач 9 сообщений, что близко к своим пределам на этом уровне camionesque.Для сравнения: Mercedes Actros 2019, успешный тяжеловесный трактор, может развивать 1000 Нм крутящего момента на своих менее мощных двигателях (и до 3000 Нм на самых мощных).
В отличие от Mercedes-AMG GT 63 S, практически ничего не тронуто, даже диски. Эти маркировки, как правило, визуально отличаются от стандартных моделей немецких мастеров, на которые это не влияет. Только матовая краска с дискретными серыми полосами по бокам, капоту и крыше придает индивидуальный вид.Если у вас уже есть модель с этим двигателем, подготовитель попросит вас около 30 000 евро, чтобы применить свое волшебство к вашему большому V8.
Специалист по хроническим запорам — Кинстон, Северная Каролина и Джексонвилл, Северная Каролина: Эрик Ибегбу, доктор медицины: Гастроэнтеролог: Atlantic Medical Group
Что вызывает хронический запор?
Каждый человек в какой-то момент своей жизни сталкивается с запором. Однако хронический запор — более серьезная проблема, которая часто требует лечения у врача.
Хронический запор может иметь несколько различных причин. Вот некоторые из возможных причин этого состояния:
- Состояния, которые влияют на ваши гормоны, например беременность или диабет
- Проблемы с мышцами, задействованными во время дефекации
- Проблемы с нервами, контролирующими испражнение
- Закупорки в вашем теле. толстая кишка
- Выбор образа жизни
Определение причины хронического запора — важная часть процесса выздоровления, поскольку разные типы запоров требуют разного лечения.
Как диагностируется причина?
Доктор Ибегбу начинает диагностику хронического запора с тщательного медицинского осмотра и изучения вашей истории болезни. Он также может задать вопросы о вашем образе жизни и симптомах.
В зависимости от результатов этого начального обследования доктор Ибегбу может порекомендовать другие тесты для выявления конкретных причин запора. Например, если он подозревает закупорку толстой кишки, вам может потребоваться визуализирующий тест. В других случаях он может просто порекомендовать лечение и проконтролировать результаты.
Можно ли вылечить?
Хронический запор обычно поддается правильному лечению. Однако конкретное лечение, которое вам нужно, будет зависеть от причины запора. Например, если у вас хронический запор из-за закупорки толстой кишки, вам может потребоваться операция по удалению закупорки. Если закупорка злокачественная, может потребоваться дополнительное лечение.
Если ваш хронический запор связан с гормональными проблемами, проблемами нервной системы или мышц, вам может быть полезно принимать лекарства, такие как стимуляторы, осмотики, пищевые добавки с клетчаткой и смягчители стула.
Как пациенты могут справиться с хроническим запором в домашних условиях?
Если хронический запор протекает в легкой форме и не связан с серьезным заболеванием, вы можете справиться с этим заболеванием самостоятельно. Некоторые изменения в образе жизни, которые могут помочь при хроническом запоре, включают:
- Регулярные упражнения
- Диета с высоким содержанием клетчатки
- Избегание продуктов, усугубляющих ваши симптомы
- Уделение большего внимания своим побуждениям в туалет
Даже если вы Если вы принимаете лекарства, эти изменения в образе жизни все еще могут помочь с вашим заболеванием.
Записаться на прием
ПОЗВОНИТЬ НАМ
.
