Белок в моче
Нормальное содержание белка в моче человека – не больше 0,033 граммов на литр. Если белка больше, это говорит о развитии протеинурии.
Причины возникновения. Уровень белка в моче повышается вследствие таких причин, как:
-
Неправильное питание; диета с высоким содержанием протеинов;
-
Частые стрессы, нервное перенапряжение;
-
Беременность;
-
Гастроэнтерологические патологии;
-
Патологии почек, которые формируются на фоне уже имеющихся недугов; пиелонефрит, гломерулонефрит, карцинома почек, липоидный нефроз;
-
Токсическое отравление;
-
Переохлаждение, обезвоживание;
-
-
Длительный прием некоторых групп медикаментов;
-
Заболевания мочеполовой системы.

Повышение уровня белка в моче во время беременности может говорить о:
-
Несбалансированным питанием беременной;
-
Повышенным артериальным давлением;
-
Пиелонефритом;
-
Развитием гестоза.
Дополнительные факторы риска. Иммунное нарушение, ожирение, возрастные изменения в организме.
Симптомы. Если повышение белка в моче незначительно, то дополнительных симптомов не наблюдается. Если наличие белка в моче является симптомом определенного патологического процесса, могут наблюдаться:
-
Боли в суставах;
-
Сонливость, утомляемость;
-
Тошнота, с позывами к рвоте;
-
Изменение окраса мочи – при повышенных показателях уровня белка моча красноватая, при пониженных – белая;
-
Озноб, лихорадка, появление отеков, болевой синдром, ухудшение аппетита.

Диагностика. Сводится к установлению причин повышения белка в моче.
-
Физикальный осмотр: проводится врачом-терапевтом и включает сбор анамнеза, осмотр, подробный опрос.
-
Лечение. Назначается только врачом и только по итогам проведенного обследования. В зависимости от причин явления, пациенту могут быть назначены противовоспалительные препараты, строгая сбалансированная диета, антибиотики и т.д.
Профилактика. Специфических методов профилактики нет, так как это не отдельный недуг. В целом следует придерживаться общих правил по ведению здорового образа жизни, своевременно и правильно лечить все недуги и не заниматься самолечением.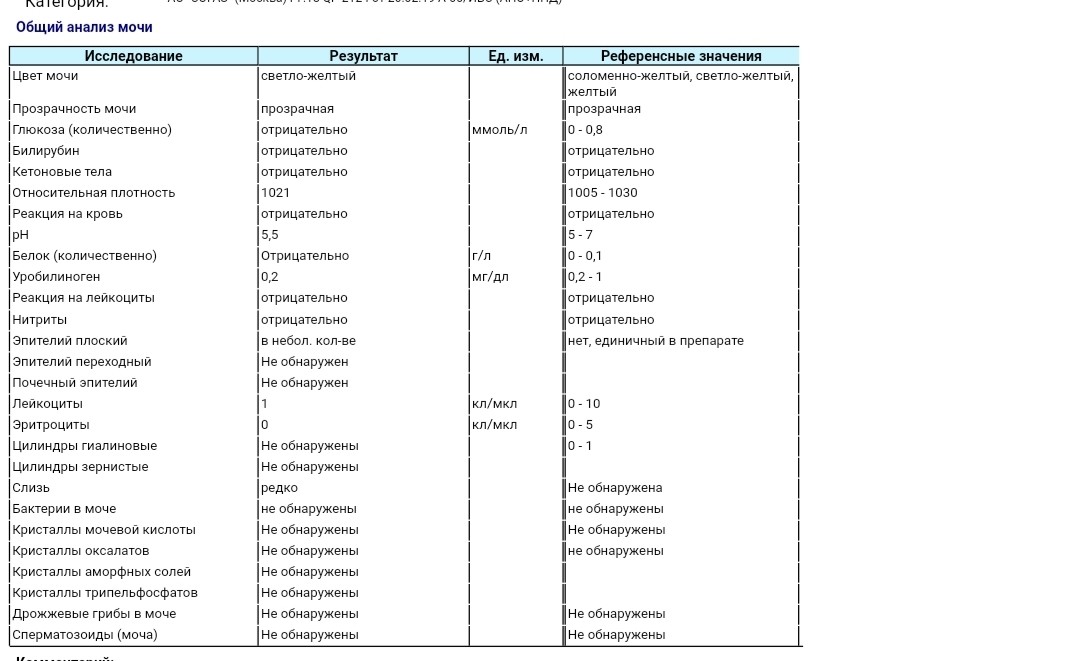
Куда обращаться?
При обнаружении подозрительных симптомов необходимо обратиться за первичной консультацией к врачу-специалисту
Также на первичный прием к специалисту можно записаться в поликлинике по месту прикрепления. Для этого необходим паспорт и полис ОМС.причины повышения на ранних и поздних сроках
Анализы мочи проводят с целью выявления инфекций, определения уровня глюкозы, кальция, лейкоцитов или кетоновых тел. Беременным женщинам дополнительно рекомендуется контролировать количество белка в урине. Отклонение показателя от нормы называется протеинурией и свидетельствует об ухудшении состояния здоровья будущей матери. Игнорирование патологии может завершиться выкидышем или преждевременными родами.
Нормальные показатели белка в моче беременной женщины
У здоровых людей белок в моче отсутствует. Показатель до 150 мг в сутки является вариантом нормы.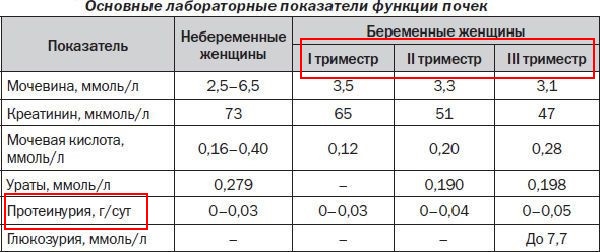 У беременных женщин предельное значение, не требующее вмешательства врача: 300 мг в сутки. Изменения показателя объясняется тем, что в процессе вынашивания малыша увеличивается нагрузка на почки.
У беременных женщин предельное значение, не требующее вмешательства врача: 300 мг в сутки. Изменения показателя объясняется тем, что в процессе вынашивания малыша увеличивается нагрузка на почки.
Повышенный белок в моче при беременности является маркером отклонений в состоянии здоровья
Повышенный белок в моче изменяет результаты теста на беременность. ХГЧ — белковый гормон, поэтому тест-полоски могут показать ложноположительный результат. Необходимо устранить причину повышения уровня белка еще на этапе планирования зачатия.
Также лаборант может выявить в моче особый тип белка: альбумин. Среднее количество печеночного протеина у здорового человека: <30 мг в сутки. У беременных женщин, страдающих от высокого кровяного давления, наблюдается значительное превышение нормы.
Зачем назначают анализ мочи на белок
Во время постановки беременной женщины на учет проводится полный спектр анализов крови и мочи.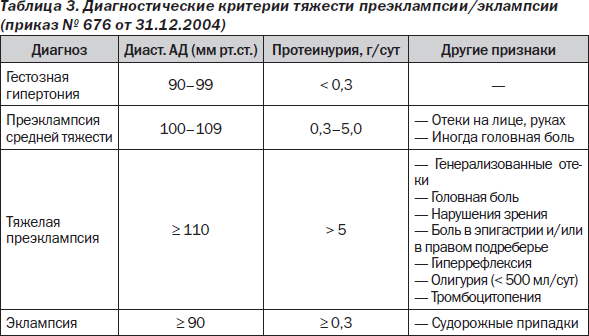 Однако состояние будущей матери может измениться буквально за несколько недель. Регулярное проведение комплексного обследования организма нецелесообразно. Простейший анализ мочи помогает быстро выявить наличие распространенных отклонений, негативно влияющих на процесс вынашивания плода.
Однако состояние будущей матери может измениться буквально за несколько недель. Регулярное проведение комплексного обследования организма нецелесообразно. Простейший анализ мочи помогает быстро выявить наличие распространенных отклонений, негативно влияющих на процесс вынашивания плода.
Повышение уровня белка в моче на поздних сроках может привести к преждевременным родам
Если в урине будет выявлен белок, глюкоза или лейкоциты, то назначаются дополнительные диагностические обследования. Особенно важно следить за качеством мочи на поздних сроках беременности, когда наблюдается предельная нагрузка на органы мочевыделительной системы.
Как выявить протеинурию в домашних условиях
Проверить белок в моче при беременности можно в домашних условиях. Необходимо приобрести набор тест-полосок и собрать утреннюю урину. Благодаря нанесенному реагенту, бумага поменяет цвет после взаимодействия с белком. Каждый производитель вкладывает в упаковку палитру для расшифровки результатов:
- норма — полоска желтая, не меняет цвет;
- есть следы белка — бумага принимает светло-зеленый или салатовый оттенок;
- высокий уровень: насыщенно-зеленый, синий цвет полоски.

Разные реагенты могут незначительно менять итоговый цвет тест-полоски. Важно сравнивать результаты с палитрой, напечатанной на упаковке, а не с фото в интернете.
Проведение анализа в лаборатории
В лабораторных условиях урину выпаривают либо проверяют электронным анализатором. Ручной метод более длительный и трудоемкий, но позволяет выявить не только белок, но и эритроциты. Электронные аппараты помогают получить максимально точный результат за короткое время. Женщине нужно просто собрать утреннюю мочу и принести в лабораторию.
Причины повышения белка в моче поможет определить только лабораторный анализ
Для получения комплексной картины назначается суточный анализ на белок. В специальную емкость собирается вся моча, которая выделялась в течение 24-х часов. Первую утреннюю урину собирать не нужно. Во избежание порчи, образец рекомендуется хранить в холодильнике.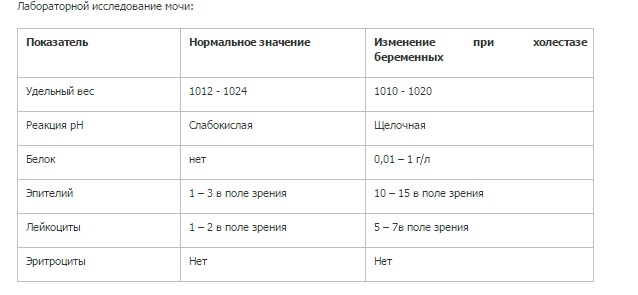
По каким признакам можно заподозрить повышение уровня белка в моче
Даже если под рукой нет полосок для проведения экспресс-теста, характерные признаки протеинурии должны стать поводом обращения за помощью к врачу. Необходимо обратить внимание на внешний вид мочи. Пенистая урина с видимым белым осадком — первый признак повышенного уровня белка. Неявный симптом протеинурии: сильная отечность. Чрезмерное скапливание жидкости в тканях, гестоз обычно проявляется в последнем триместре. Но если отеки появились на первых месяцах вынашивания ребенка, стоит сделать внеплановый лабораторный анализ мочи.
Норму белка в моче можно проверить тест-полосками
Самым опасным последствием протеинурии в последнем триместре беременности является преэклампсия. Патология сопровождается следующими симптомами:
Патология сопровождается следующими симптомами:
- ухудшение зрения;
- боль под ребрами;
- мигрень;
- рвота;
- изжога.
Любые отклонения в состоянии здоровья должны стать причиной обращения в больницу. Не стоит убирать неприятные симптомы домашними средствами без предварительного разрешения врача.
Инфекции мочевыводящих путей
Постоянное желание помочиться обычно возникает на поздних сроках беременности из-за того, что плод давит на мочевой пузырь. Но если процесс мочеиспускания сопровождается жжением, необходимо сдать анализ на суточную протеинурию. Скорее всего дискомфорт спровоцирован воспалением мочевыводящих путей.
Если проигнорировать инфекцию, разовьется:
- лихорадка;
- тошнота и рвота;
- боли в спине.
Сами по себе симптомы инфекции мочевыводящих путей не повлияют на плод, но могут спровоцировать преждевременные роды.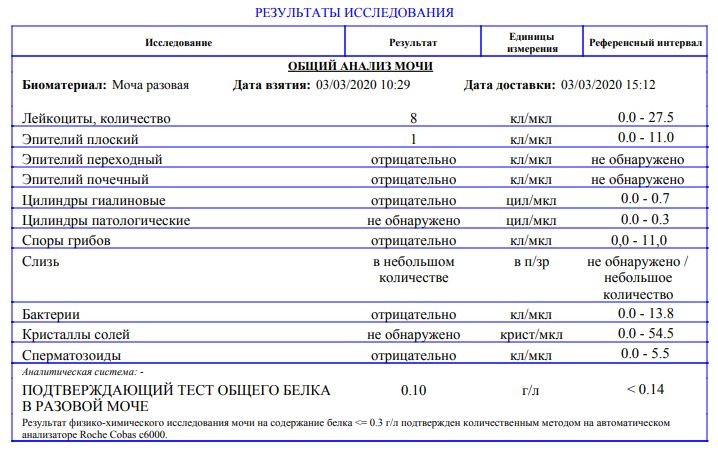
Преэклампсия: что это значит, как влияет на уровень белка в моче
Протеинурия на поздних сроках в большинстве случаев является признаком преэклампсии. Патологическое состояние возникает после 20-й недели беременности. Болезнь опасна развитием судорог, преждевременным рождением ребенка с низким индексом массы тела.
Суточный анализ мочи на белок поможет выявить преэклампсию на ранней стадии
Во время преэклампсии ухудшаются фильтрующие функции почек, в результате чего в мочу попадает белок. Ранняя диагностика позволяет предотвратить осложнения, обойтись без медикаментозной терапии.
Менее распространенные причины повышения уровня белка в моче
HELLP-синдром — редкая патология, которая характеризуется резким повышением уровня белка в моче при беременности вместе с одновременным снижением количества тромбоцитов в крови. Синдром диагностируют у женщин с эклампсией. Если не обратиться за медицинской помощью вовремя, разовьются такие серьезные последствия, как мертворождение, истончение плаценты.
Если не обратиться за медицинской помощью вовремя, разовьются такие серьезные последствия, как мертворождение, истончение плаценты.
Незначительное повышения уровня белка в моче может спровоцировать:
- стресс;
- обезвоживание;
- воспалительные заболевания;
- диабет.
Самостоятельно выявить, что именно спровоцировало протеинурию, практически невозможно.
Домашние методы снижения уровня белка в моче
Так как протеинурия не считается болезнью, то нет какого-то определенного протокола лечения. Необходимо устранить причину появления белка в моче. Если выявлено незначительное превышение нормы, можно справиться с патологией без приема синтетических медикаментов.
Последствия высокого белка в моче опасны для здоровья матери и плода
Основные рекомендации:
- Снизить потребление соли. На ранних сроках беременности у женщин возникает тяга к кислой и соленой пище.
 Резкое увеличение потребления соли приводит к повышению уровня белка в моче. Если нет сил устоять перед соленьями, стоит хотя бы отказаться от закусок с глутаматом натрия в составе.
Резкое увеличение потребления соли приводит к повышению уровня белка в моче. Если нет сил устоять перед соленьями, стоит хотя бы отказаться от закусок с глутаматом натрия в составе. - Снизить потребление сахара. Отказ от сладостей поможет предотвратить гестационный диабет. Слишком частое употребление сладкого провоцирует сильное чувство жажды. Женщина начинает пить больше воды, что нагружает почки, приводит к повышению уровня белка.
- Контролировать вес. Слишком быстрое увеличение веса не идет на пользу ребенку. Высокий индекс массы тела будущей матери провоцирует выделение белка с мочой.
- Избегать стрессовых ситуаций. Полноценный ночной сон помогает зарядиться бодростью. Постоянное нервное напряжение не просто негативно влияет на плод, но и провоцирует увеличение выработки кортизола. Ослабленный организм хуже противостоит инфекциям.
- Соблюдать правила гигиены. Чтобы бактерии не проникли в мочевыводящие пути, необходимо подмываться после каждого похода в туалет.
 Подтираться нужно спереди назад, носить только хлопчатобумажное белье.
Подтираться нужно спереди назад, носить только хлопчатобумажное белье.
Нужно помнить, что такие простые правила помогут устранить лишь незначительные отклонения. Слишком высокий белок в моче при беременности однозначно требует медицинского вмешательства.
Медикаментозное снижение уровня белка
Прием любых лекарственных средств во время беременности необходимо согласовывать с лечащим врачом. Сначала специалист определит триггер повышения уровня белка, а затем подберет препараты, безопасные для плода. Если основной причиной протеинурии является гестационный диабет, необходимо принимать сахароснижающие средства, отказаться от сладкого. При гипертонии назначают блокаторы рецепторов ангиотензина, а при тяжелых инфекционных болезнях — антибиотики.
Если причиной появления белка в моче стали бактерии, без антибиотиков не обойтись
Лечение преэклампсии направлено на сохранение беременности. Первый признак того, что терапия проходит успешно — снижение уровня белка в моче. Но если диагностирована тяжелая эклампсия или HELLP-синдром, женщине прописывают кортикостероидные препараты. Медикаменты улучшают функцию печени, способствуют выработке тромбоцитов. Кортикостероиды также ускоряют созревание легких плода.
Первый признак того, что терапия проходит успешно — снижение уровня белка в моче. Но если диагностирована тяжелая эклампсия или HELLP-синдром, женщине прописывают кортикостероидные препараты. Медикаменты улучшают функцию печени, способствуют выработке тромбоцитов. Кортикостероиды также ускоряют созревание легких плода.
Интенсивный курс гормональной терапии повышает шансы выживания недоношенного ребенка. Если эклампсия осложнилась судорогами, дополнительно назначаются препараты на основе сульфата магния. Как только УЗИ покажет, что плод достаточно развился, вызываются роды.
Небольшое количество белка в моче беременной женщины является вариантом нормы. Резкое развитие протеинурии указывает на отклонения в состоянии здоровья. Если регулярно контролировать такой важный показатель, угрозы преждевременных родов можно избежать. Стоит купить домашние тест-системы и проверять уровень белка в моче хотя бы раз в неделю.
Видео
youtube.com/embed/m0O_Aerut8Q?autoplay=true»/>Читайте также: можно ли беременным пить кофе
Почему появляется белок в моче и что с этим делать
Какова норма белка в моче
В сутки у здорового человека с мочой выделяется до 150 мг белка. Это настолько мало, что при общем анализе мочи обнаружить там вещество невозможно. Тест просто нечувствителен к такому количеству.
Белок попадает в мочу из крови, которую непрерывно фильтруют через себя почки. Она проходит через клубочки, сплетение мелких сосудов — капилляров. Те пропускают через свои стенки воду, ионы и некоторые токсичные вещества, но не дают пройти крупным белкам и клеткам. А вот мелкие протеины просачиваются, поэтому в небольшом количестве могут оказаться в моче.
Если работа почек нарушается, они перестают задерживать крупные молекулы белка, поэтому в моче его становится больше 150 мг. Это состояние называют протеинурией.
Как узнать, что в моче есть белок
Человек не может по внешнему виду мочи определить, что в ней много белка.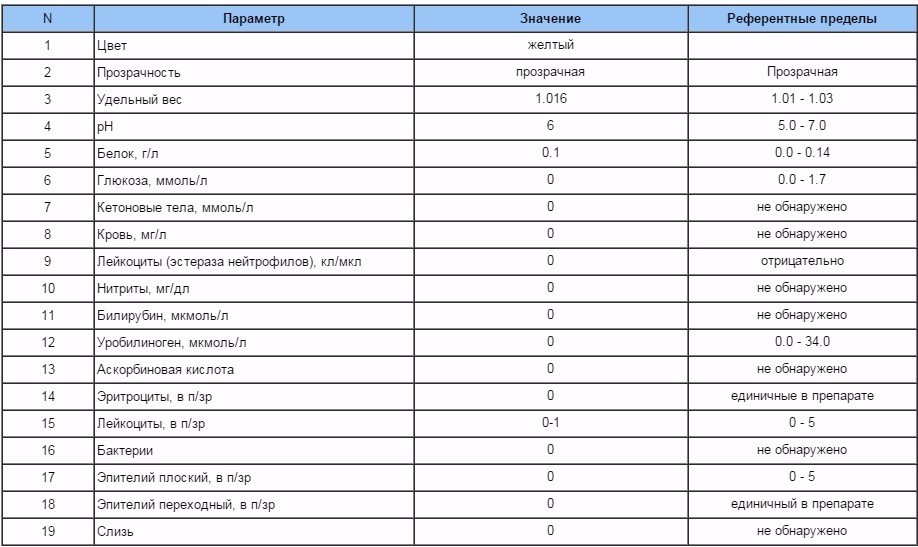 Хотя врачи отмечают, что в этом случае она сильно пенится. Единственный достоверный способ подтвердить догадки — сдать анализ. Терапевт может назначить такие варианты:
Хотя врачи отмечают, что в этом случае она сильно пенится. Единственный достоверный способ подтвердить догадки — сдать анализ. Терапевт может назначить такие варианты:
- Общий анализ мочи. Собирают в любое время суток. Лаборанты определяют белок при помощи специальной тест‑полоски. Она меняет цвет, если его уровень превышает норму.
- Суточный анализ мочи. Человек после пробуждения и в течение 24 часов опорожняется в специальную тару. Затем в лаборатории определяют общее количество выделенного белка.
Обычно, если протеинурия незначительная, то самочувствие не изменяется. Симптомы появляются у тех, кто страдает от болезней почек или других систем, из‑за чего теряется много белка с мочой. Самые частые признаки — это отёки на лице, животе, ступнях. Иногда на первый план выходят другие симптомы:
- одышка;
- усталость;
- тошнота и рвота;
- частое мочеиспускание;
- судороги по ночам.
Почему появляется протеинурия
Иногда белковые молекулы проникают в мочу из‑за временного ухудшения здоровья. Например, при сильном обезвоживании, высокой температуре тела, из‑за стресса, физической нагрузки или переохлаждения. Это не опасно и проходит само собой.
Например, при сильном обезвоживании, высокой температуре тела, из‑за стресса, физической нагрузки или переохлаждения. Это не опасно и проходит само собой.
Но есть различные заболевания, которые сопровождаются повреждением почек, нарушением их работы и развитием почечной недостаточности. Учёные считают, что протеинурия может быть признаком таких болезней:
- Амилоидоз почек — это патология, при которой в органах накапливаются вредные белки.
- Гломерулонефрит — хроническое воспалительное заболевание.
- Пиелонефрит — инфекционное поражение почек.
- Аутоиммунные болезни. Например, системная красная волчанка, ревматоидный артрит.
- Сердечно‑сосудистые заболевания, в том числе артериальная гипертензия.
- Сахарный диабет.
- Опухолевые процессы. К примеру, саркоидоз, лимфома Ходжкина, миелома, рак почки.
- Преэклампсия — заболевание беременных женщин, при котором повышается артериальное давление, определяется белок в моче и возникают отёки.

- Отравление, действие лекарств. Часто это побочный эффект нестероидных противовоспалительных средств.
- Перенесённые тяжёлые травмы.
Протеинурия может возникнуть и после того, как человек долго простоял. Такое случается редко и обычно у подростков или людей после 30 лет. Почему так происходит, никто не знает. Но и лечить это состояние не нужно, угрозы для здоровья нет.
Что делать, если в моче обнаружили белок
Если в одном анализе мочи нашли белок, терапевт будет направлять на исследование каждые 30 дней. Только при повторных отклонениях нужна углублённая диагностика. Для этого используют следующие методы:
- Анализ крови на креатинин. Это продукт обмена веществ, который должен выводиться почками. Но при нарушении их функции он задерживается в кровотоке.
- Скорость клубочковой фильтрации. Специальное исследование, которое помогает определить интенсивность выведения креатинина и уровень белка альбумина в крови в зависимости от пола, возраста, массы и расы пациента.

- Исследование концентрации всех белков сыворотки крови.
- УЗИ почек или МРТ. Нужно, чтобы рассмотреть структуру органа.
- Электрофорез белков мочи. С его помощью определяют, какие именно протеины выводятся. Это помогает поставить более точный диагноз.
- Биопсия почки. У пациента под анестезией берут кусочек ткани этого органа. Применяется в крайнем случае при подозрении на рак.
Врач назначит лечение в зависимости от того, что привело к повышению белка в моче. В некоторых случаях терапия не нужна, в других — выписывают лекарства. Если протеинурия появилась из‑за хронической почечной недостаточности, иногда единственный способ улучшить состояние — это гемодиализ. Так называют метод лечения, когда кровь фильтрует специальный аппарат.
Читайте также 💦🩺💊
норма и патология (протеинурия). Что значит и чем опасен повышенный белок в моче во время беременности? Анализ на потерю белка у беременных
Беременной женщине приходится регулярно сдавать разнообразные анализы: врачи должны контролировать процесс вынашивания малыша.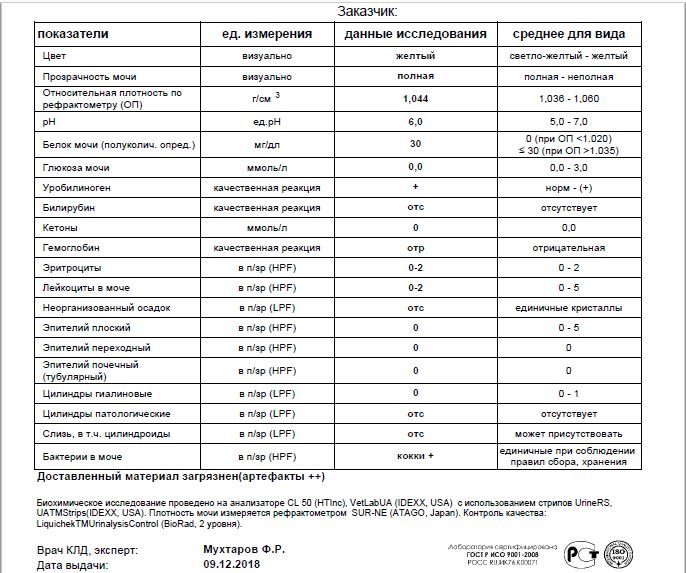 И суточный анализ мочи на белок — одно из самых значимых исследований. Показатель белка в моче важен, так как демонстрирует уровень здоровья мочевыводящей системы женщины.
И суточный анализ мочи на белок — одно из самых значимых исследований. Показатель белка в моче важен, так как демонстрирует уровень здоровья мочевыводящей системы женщины.
Данное исследование наглядно показывает, есть ли какие-то инфекции или воспаления в мочеполовой сфере, в почках, поэтому без сдачи этого анализа не обходится ни одна беременная. В статье рассмотрим, как сдавать суточный анализ мочи на белок при имеющейся беременности, выясним: какие показатели должны быть нормой, и как правильно подготовить биоматериал для исследования.
Нормы
Повышенное содержание белка в мочевой жидкости по-научному называется ложная протеинурия. Если анализ в первый раз выдал этот показатель выше нормы, врач в обязательном порядке назначит повторный, чтобы удостовериться, что первый не был случайным и ошибочным.
Необходимо заметить, что незначительно превышающее норму содержание белка может обнаружиться в моче абсолютно любого человека. К тому же во время вынашивания плода в связи с возросшей нагрузкой на почки этот уровень часто повышается. В норме данный показатель обычно не превышает 0,033 гр/литр, а превышение до 0,14 гр/литр не считается каким-то серьезным отклонением. Но у беременной женщины этот показатель может вырасти до 50-100 мг/сутки.
В норме данный показатель обычно не превышает 0,033 гр/литр, а превышение до 0,14 гр/литр не считается каким-то серьезным отклонением. Но у беременной женщины этот показатель может вырасти до 50-100 мг/сутки.
Причины высокого уровня белка
Выясним, с чем связано повышение количества белка в моче беременной женщины, и чем опасен данный факт.
Один из наиболее распространенных фактов, который не несет, к счастью угрозы здоровью мамы и плода, это несоблюдение правил гигиены при сборе мочи. Если вы некачественно вымыли контейнер, забыли совершить гигиенические процедуры, то моча с белком — вполне ожидаемый результат.
Ощутимые физические нагрузки перед сдачей анализа тоже могут повлиять на увеличение белковой массы в моче.
Нервные потрясения, стрессы, кроме очевидной угрозы для самочувствия и настроения будущей мамы, еще и влияют на уровень белка.
Если вы едите слишком много белковых продуктов: яиц, мяса, молочных блюд, то повышенное количество белка в моче удивлять не должно.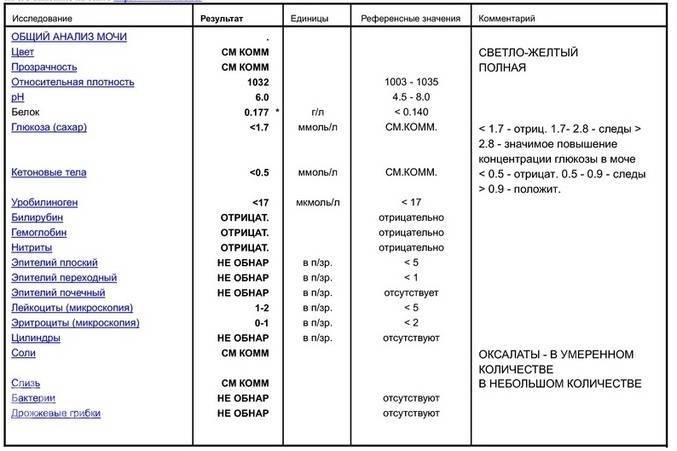
В случае пиелонефрита количество белка в моче сильно возрастает. Кроме пиелонефрита, повышение уровня белка могут спровоцировать следующие заболевания:
- преэклампсия;
- нефропатия;
- гестоз;
- эклампсия;
- водянка;
- гломерулонефрит;
- острое воспаление почек.
Именно эти болезни и хотят исключить врачи, когда назначают беременной женщине суточный анализ. Имейте в виду, что эти заболевания обычно сопровождаются болями в поясничной области, а иногда и повышенной температурой. Воспаление почек и гломерулонефрит, кроме того, еще окрашивают мочу в розовато-красный цвет. Данный факт свидетельствует о том, что мочевой пузырь поражен.
Как сдать мочу для суточного анализа на белок
Суточный анализ на белок назначают в том случае, когда общий анализ мочи показал наличие этого вещества. Но белок мог попасть в мочу случайно, поэтому перед постановкой окончательного диагноза, врач должен удостовериться, что это не так.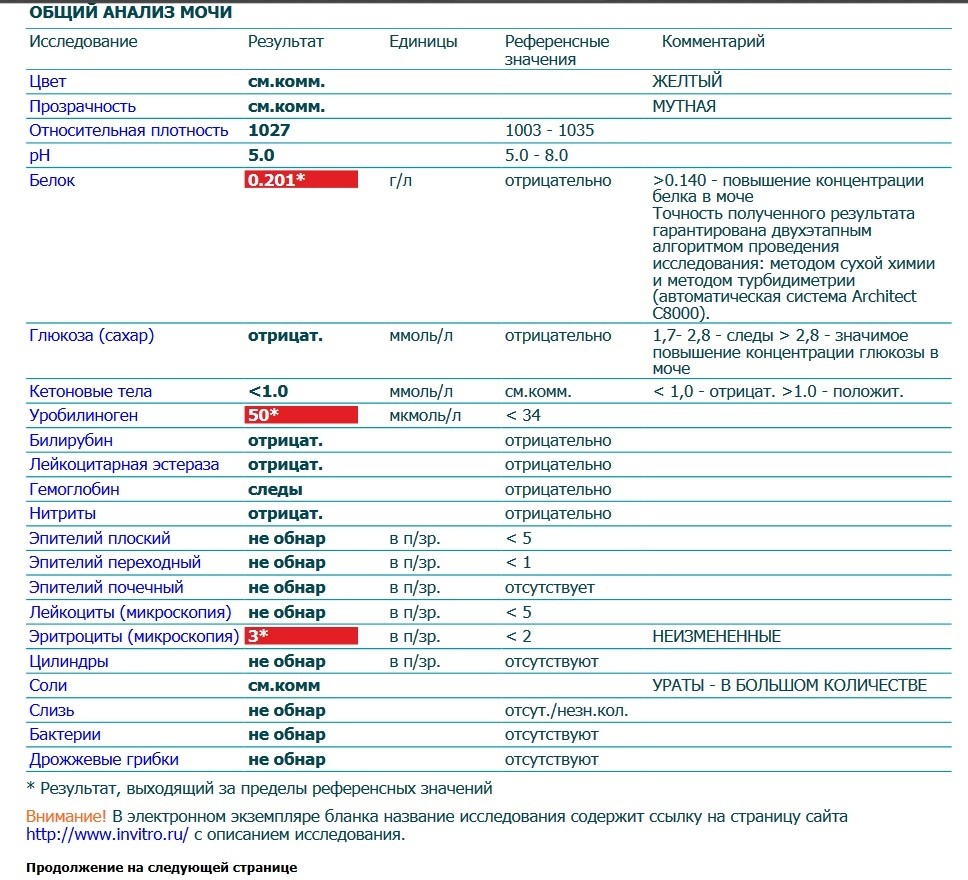
Необходим стерильный пластиковый контейнер небольшого объема или стеклянная баночка, чисто вымытая и простерилизованная в кипятке. Важно уничтожить все возможные бактерии, чтобы в сдаваемый материал не попали посторонние микроорганизмы. Эта емкость нужна, чтобы поместить в нее окончательно подготовленную мочу, собранную за сутки. А для того, чтобы в течение дня собирать материал, необходима большая стеклянная банка объемом в два литра. Эта емкость тоже должна быть абсолютно чистой и простерилизованной.
Сбор суточного анализа начинается с утра после пробуждения и продолжается, как понятно из названия, в течение суток. Перед тем, как наполнять банку, необходимо совершить все процедуры по личной гигиене, чтобы в емкость попадала лишь моча, без посторонних примесей. Если имеется молочница в острой фазе, влагалище необходимо изолировать ватным тампоном, чтобы выделения не смешались с мочой.
За один раз достаточно наполнить банку уриной в количестве четверти стакана. Таким образом перед каждым посещением туалета «по маленькому» совершайте гигиенические процедуры, и собирайте мочу в большую банку.
Таким образом перед каждым посещением туалета «по маленькому» совершайте гигиенические процедуры, и собирайте мочу в большую банку.
Внимание: иногда суточный анализ на белок не должен включать утреннюю мочу, а иногда и должен. Необходимо уточнить у врача, весь ли объем мочи необходим.
Перед сном поместите закрытую плотной крышкой банку в холодильник. На следующее утро мочу в большой банке нужно перемешать и наполнить ею маленький контейнер. Эту небольшую емкость надо отнести на анализ в лабораторию, а большую банку с остатками мочи утилизировать.
Лечение
Если и повторный анализ показал наличие белка, врач имеет все основания назначить соответствующее лечение. В случае серьезного диагноза беременную женщину могут даже поместить в стационар для прохождения терапевтического курса.
Приемы лечения
В случае пиелонефрита и прочих заболеваний воспалительного характера женщине выписываются антибиотики для подавления болезнетворных организмов. Кроме того, необходим прием и противовоспалительных средств: подойдут такие препараты, как Фитолизин, Канефрон. Лекарства-диуретики тоже выписываются в этом случае.
Кроме того, необходим прием и противовоспалительных средств: подойдут такие препараты, как Фитолизин, Канефрон. Лекарства-диуретики тоже выписываются в этом случае.
При воспалительных процессах в почках беременным не рекомендуется длительное время лежать на спине, даже не разрешается спать в этой позе. Зато полезно больше ходить, а также выполнять несложные упражнения на четвереньках.
Если моча с высоким содержанием белка является следствием гестоза, то опасность для здоровья матери и развития плода повышается многократно. К тому же существует изрядный риск преждевременных родов.
При гестозе необходимо придерживаться определенной диеты, исключив из рациона следующие продукты:
- с большим содержанием белка;
- цитрусовые;
- шоколад и кондитерские изделия с ним;
- специи;
- кофе;
- вредную, жареную пищу, полуфабрикаты;
- сладкую газировку.
Профилактика
Какие меры может предпринять женщина, чтобы исключить появление подобной проблемы.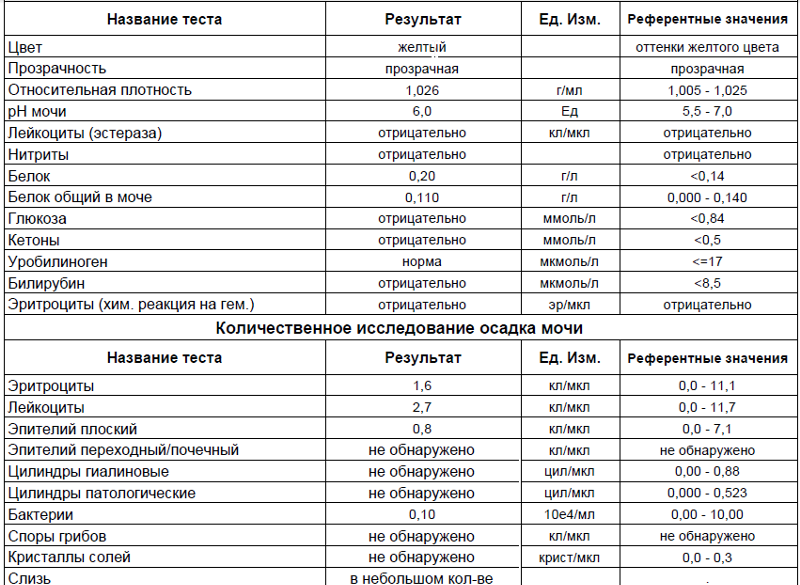
В течение всей беременности следите за весом: взвешивайтесь и не допускайте большого набора массы тела.
Внимательно следите за тем, что едите. Не употребляйте слишком большое количество белковых блюд и вредных продуктов. Ограничьте количество сладостей, шоколада, кофе, газированных напитков.
Измеряйте давление и занимайтесь посильной физкультурой, гуляйте на воздухе.
Мы рассмотрели, чем опасен повышенный белок в моче при беременности. Как видите, наличие этого вещества может свидетельствовать о довольно серьезных заболеваниях. Хотя, к счастью, в большинстве случаев это все-таки не подтверждается. Рекомендуем сдавать материал на анализ с соблюдением всех правил гигиены и выполняя все несложные рекомендации, приведенные выше. В этом случае результат исследования будет достоверным и точным.
От чего возникает протеинурия, как избежать заболевания?
Что такое протеинурия при беременности?
Протеинурия — наличие в моче белка. Почки в человеческом организме так устроены, что попасть белок в мочу не может. Тем не менее, бывают случаи, когда в моче обнаруживается белок. При показателе более 0,033 г/л, ставится диагноз протеинурия. Во время беременности достаточно часто встречающееся явление. Возникает по разным причинам.
Почки в человеческом организме так устроены, что попасть белок в мочу не может. Тем не менее, бывают случаи, когда в моче обнаруживается белок. При показателе более 0,033 г/л, ставится диагноз протеинурия. Во время беременности достаточно часто встречающееся явление. Возникает по разным причинам.Причины развития протеинурии при беременности
При беременности в моче может обнаружится белок по таким причинам:- Чрезмерные физические нагрузки.
- Патологические процессы в почках.
- Инфекция в мочеиспускательных каналах.
- Перегрузка почек в связи с увеличением количества жидкости в организме.
- Почечная недостаточность.
- Гормональные изменения.
- Обезвоживание.
- Нарушение обмена веществ.
- Поздний токсикоз (гестоз).
Симптомы заболевания
Протеинурия проявляется следующим образом:- Боли чуть выше поясницы, тянущие или острые.

- Частые позывы «по-маленькому», моча при этом выходит в небольшом количестве и сопровождается резью или болью.
- Тошнота.
- Мигрень.
- Рвота.
- Лихорадочное состояние.
- Звон в ушах.
- Головокружение.
Диагностика и лечение протеинурии во время беременности
После того, как анализ мочи показал присутствие белка, скорее всего будет назначена повторная сдача. Иногда белок в моче определяется ошибочно, например, из-за нарушения правил личной гигиены или по какой иной причине. Если повторный анализ подтвердит диагноз, то необходимо пройти дополнительное исследование в виде:- Внутривенной пиелографии.
- Компьютерной томографии.
- Магнитно резонансной урографии.
- Биопсии через кожу.
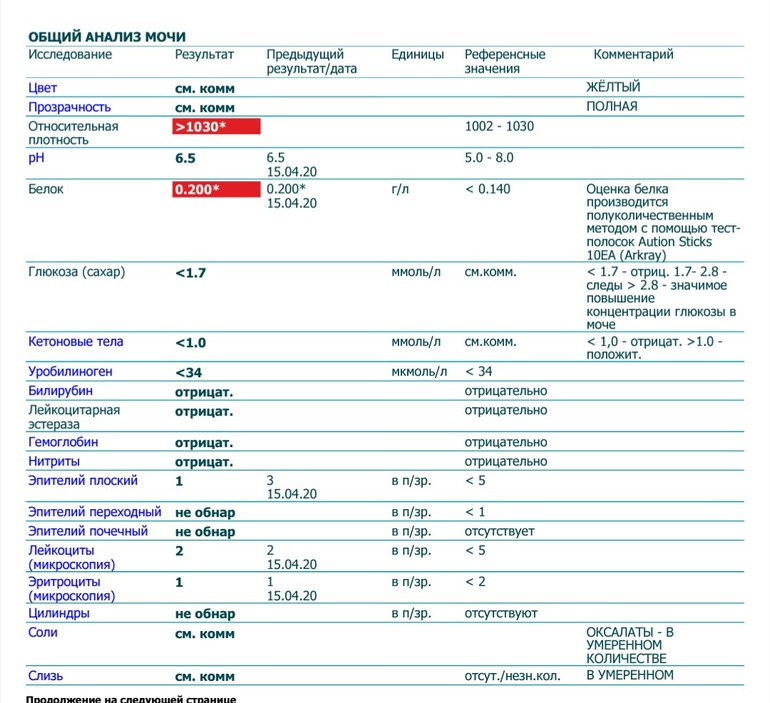 Протеинурия может сопровождать серьезное заболевание почек.
Протеинурия может сопровождать серьезное заболевание почек.Лечение тоже назначается согласно диагнозу, ведь следы белка в моче могут быть из-за разных заболеваний. Обычно в схему лечения почек при беременности входят: противовоспалительные средства, диуретики, антибиотики.
Бывает, что болезни почек не совместимы с беременностью, тогда предлагают ее прервать, особенно при угрозе жизни матери, но такое случается крайне редко, в большинстве случаев, белок в моче появляется из-за повышенной нагрузки на почки.
Как избежать заболевания при беременности?
Чтобы предупредить возникновение заболевания, необходимо:- Правильно ухаживать за половыми органами.
- Не находится в местах скопления людей в периоды эпидемий различных инфекций.
- Регулярно измерять артериальное давление.
- Стараться держать вес в пределах нормы.
- Больше питаться отварной пищей или приготовленной с помощью пара.
- При склонности к отечности регулировать потребление воды.

- Свести потребление соли к минимуму.
- По возможности придерживаться рационального питания.
Даже при нормальном протекании беременности, делать анализ мочи рекомендуется каждый месяц, на последнем триместре не менее, чем раз в неделю, чтобы своевременно диагностировать отклонения в работе почек и исправить ситуацию.
Даже самая здоровая беременность нарушает функциональную деятельность внутренних органов и систем женского организма, которые все 9 месяцев вынуждены подстраиваться под потребности растущего человечка. Эти перемены неизбежно отображаются в лабораторных анализах. Очень часто врачи имеют дело с такой патологией, как протеинурия, вызванная беременностью.
Термином «протеинурия» медики обозначили заболевание, при котором концентрация белка в моче превышает допустимую границу. Разделение мочи и крови происходит в почечных клубочках. Их стенки практически не пропускают молекулы белка и, как следствие, в моче, которая выводится наружу, его почти нет.
Разделение мочи и крови происходит в почечных клубочках. Их стенки практически не пропускают молекулы белка и, как следствие, в моче, которая выводится наружу, его почти нет.
В одной порции урины здорового человека 0,033 г/л белка — такая концентрация считается допустимой. Для беременных женщин показатели нормы другие — максимально допустимые границы снижены:
- 1 триместр — самый большой возможный показатель 0,002 г/л;
- 2 триместр — уровень белка в моче не должен превышать 0,1 г/л;
- 3 триместр — максимальное значение 0,033г/л.
Суточные показатели протеинурии при беременности в норме 0,08 — 0, 2 г/сутки.
Повышенное содержание белка в моче в период вынашивания ребенка показывает, что мочевыделительная система будущей матери не справляется со своими прямыми функциями на почве гестоза. В большинстве случаев женщина сталкивается с таким отклонением на поздних сроках беременности, примерно после 30 недель.
Причины развития протеинурии во время беременности
Есть физиологически обусловленные причины повышения концентрации белка в моче — это увлечение белковой пищей, стрессы, физические нагрузки.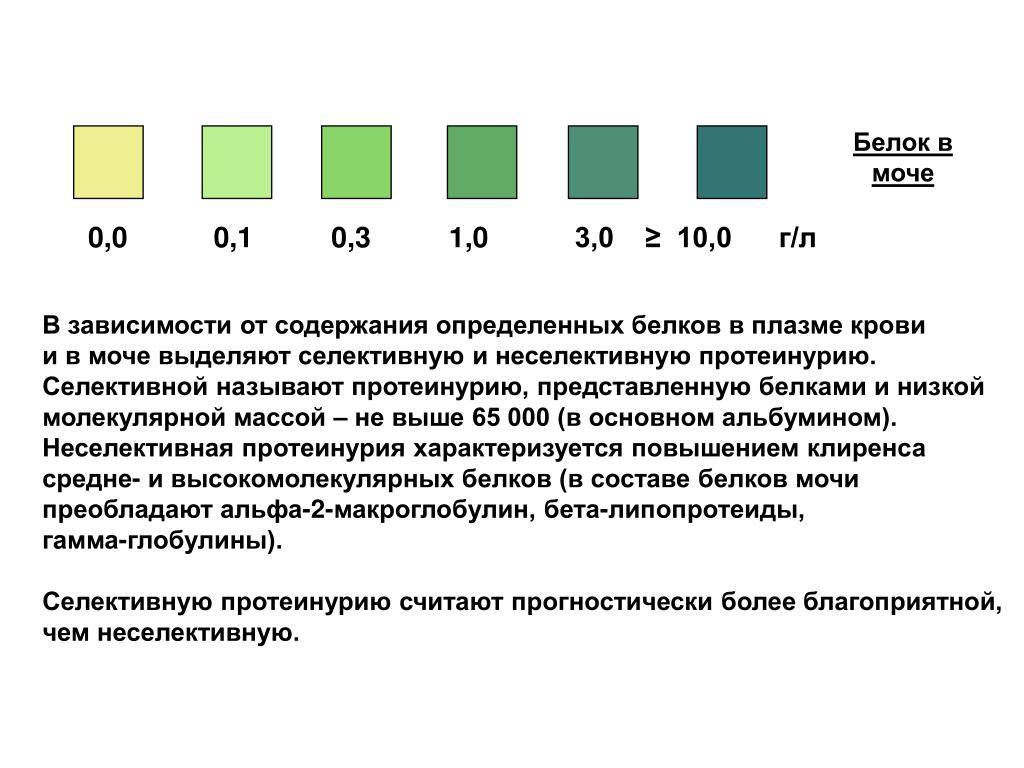 При беременности это явление возникает на почве адаптации женского организма к своему новому состоянию. Матка увеличивается в размерах, сдавливает почки и мочевой пузырь, а сами органы мочевыделительной системы работают в условиях большой нагрузки. Физиологическая протеинурия при беременности развивается вследствие перемены гормонального фона, из-за чего меняется степень проницаемости мембранных стенок сосудов.
При беременности это явление возникает на почве адаптации женского организма к своему новому состоянию. Матка увеличивается в размерах, сдавливает почки и мочевой пузырь, а сами органы мочевыделительной системы работают в условиях большой нагрузки. Физиологическая протеинурия при беременности развивается вследствие перемены гормонального фона, из-за чего меняется степень проницаемости мембранных стенок сосудов.
Среди патологических причин развития протеинурии у будущей мамы отметим:
- пиелонефрит — воспаление почек, затрагивающее паренхиму органа. Возбудители заболевания атакуют ослабленную беременностью иммунную систему организма женщины. Протеинурия развивается вследствие хронического пиелонефрита;
- гломерулонефрит — болезнь поражает клубочковую систему почки. Хроническая форма патологии крайне опасна для будущих мам;
- артериальная гипертензия — при этом сосудистом расстройстве наблюдается регулярное повышение артериального давления. Среди осложнений заболевания отмечена протеинурия;
- системные аутоиммунные заболевания — чаще всего обостряются, когда женщина в положении, и проявляются различными симптомами, один из которых — протеинурия;
- сахарный диабет — заболевание поражает кровеносные сосуды, что в первую очередь сказывается на фильтрационных способностях почек;
- преэклампсия — серьезное осложнение течения беременности, которое сопровождает повышенное артериальное давление, рвота, судороги и повышенная концентрация белка в моче;
- гестоз — поздний токсикоз при беременности, вызванный хроническими заболеваниями будущей мамы, резус-конфликтом, гормональными нарушениями.

Протеинурия при беременности негативным образом влияет на работу почек и требует ответственного лечения.
Клинические признаки протеинурии при беременности
Наличие протеинурии во время беременности указывает на наличие какого-либо серьезного заболевания у матери. Основные симптомы нарушения такие:
- высокая температура тела;
- тошнота и рвота;
- артериальная гипертензия;
- отеки;
- болезненные ощущения в поясничном отделе спины;
- обострение хронически протекающих заболеваний.
Чаще всего вызванные беременностью отеки в сочетании с протеинурией являются предпосылками развития у будущей мамы тяжелого гестоза. Это состояние появляется на почве перестраивания деятельности всех систем организма под потребности плода. По сути, внешние признаки гестоза дают все основания говорить о тяжелом токсикозе, который существенно ухудшает самочувствие матери и ребенка. В самом крайнем случае гестоз приводит к другому опасному состоянию — эклампсии. Патология диагностируется по следующим очевидным признакам:
Патология диагностируется по следующим очевидным признакам:
- судороги;
- высокое артериальное давление;
- проблемы с оттоком урины;
- крайняя степень отечности;
- иногда — потеря сознания.
Протеинурия на разных стадиях развития гестоза
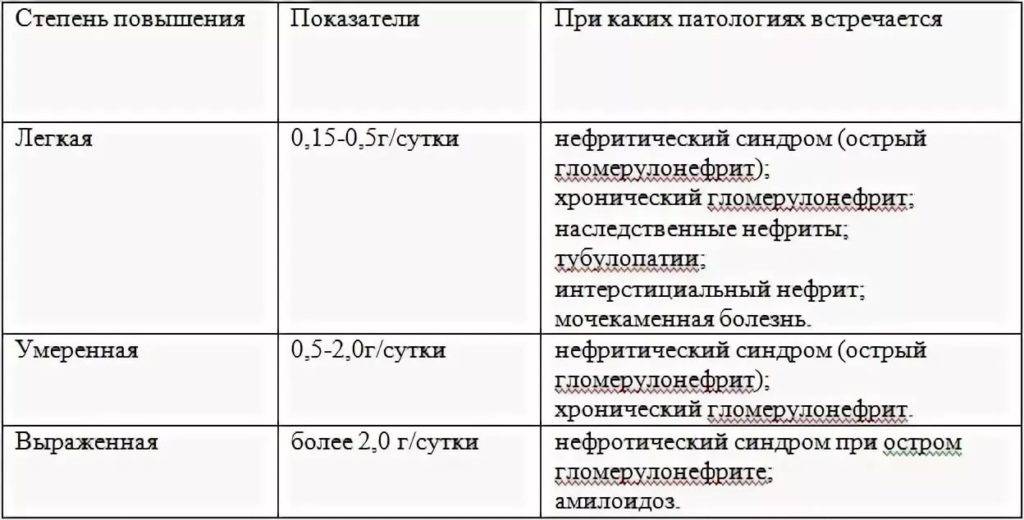
Выделяют 4 степени гестоза при беременности:
- Легкая — не сильно выраженные отеки ног, давление слегка повышено (около 150/90 мм. рт. ст.). В большинстве случаев самочувствие будущей мамы удовлетворительное, поэтому на первые «звоночки» гестоза внимания она не обращает. Концентрация белка в моче равняется 0,33 — 0,1 г/л.
- Средняя — отеки которые распространяются на живот и в некоторых случаях на лицо, уже хорошо заметны. Показатели кровяного давления достигают 170/100 мм. рт. ст., а белок в моче повышается до 1 г/л.
- Тяжелая — самочувствие беременной очень плохое, отеки к этому моменту уже «расползлись» по всему телу, а показатели артериального давления не могут не вызывать опасений за здоровье женщины — 200/110 мм.
 рт. ст. Концентрация белка в моче высокая и превышает 1 г. Это состояние известно в медицине как эклампсия, сопровождается потерей сознания, судорогами, рвотой, высоким давлением.
рт. ст. Концентрация белка в моче высокая и превышает 1 г. Это состояние известно в медицине как эклампсия, сопровождается потерей сознания, судорогами, рвотой, высоким давлением.
При отсутствии своевременной медицинской помощи жизни и здоровью больной угрожает большая опасность. Последствия эклампсии тяжелые:
- серьезное нарушение мозгового кровообращения;
- патологии нервной системы;
- сердечно-сосудистая недостаточность;
- угасание зрительной функции глаза;
- кома.
Диагностика протеинурии при беременности
У здорового человека причиной временной протеинурии могут быть высокая температура тела, стрессы, большая физическая нагрузка, прием богатой белком пищи, переохлаждение. Показатели нормализуются, как только провоцирующий фактор будет устранен. У беременных ситуация обстоит несколько иначе: почки при вынашивании ребенка работают активнее обычного, поэтому провоцирующий фактор не только вызывает повышение уровня белка в моче, но и способствует обострению латентных, раннее не проявлявшихся заболеваний.
Тест на белок в моче — обязательная процедура для всех будущих мамочек. Направление на анализ выписывает акушер-гинеколог, который следит за тем, как протекает беременность.
Суточная протеинурия при беременности: как сдавать анализ
Чтобы повысить достоверность предстоящего исследования, накануне сбора биологического материала беременной рекомендуют:
- не тревожиться и не нервничать;
- сократить до минимума или вообще не есть творог, яйца, молоко, мясо и рыбу;
- сократить насколько возможно физическую активность и не допускать повышенного потоотделения;
- не принимать никакие лекарственные средства и обязательно поставить врача в известность о тех лекарствах, от приема которых нельзя отказаться по состоянию здоровья;
- не принимать холодный душ.
Для сбора мочи подойдет специальный контейнер из аптеки или тщательно продезинфицированная баночка объемом 200 мл. Анализ предполагает исследование суточной порции урины, собранной в течение 24 часов. Первая порция мочи сразу после пробуждения для теста не понадобится, и ее спускают в унитаз.
Первая порция мочи сразу после пробуждения для теста не понадобится, и ее спускают в унитаз.
Остальные порции выделяемой урины собираются после гигиенической обработки наружных половых органов. До сдачи в лабораторию емкость с мочой хранят в прохладном месте, не доступном для солнечного света. После сбора последней за прошедшие сутки порции содержимое контейнера осторожно перемешивают и отливают в другую стерильную емкость 35 — 40 мл мочи. Материал для анализа нужно доставить в лабораторию в течение 2 часов, не позже. Во время транспортировки важно не трясти и не взбалтывать мочу.
В эталонной моче белка не обнаруживается. Однако при беременности норма суточной протеинурии составляет 0,025 — 0,150 г/сутки.
Лечение протеинурии при беременности
Если белок в моче повышен незначительно, будущей маме показано пить больше обычной воды и уменьшить в рационе процент продуктов белковой природы. Чтобы нормализовать существенно повышенную концентрацию белка в моче у беременной, лечат в первую очередь причину этого состояния:
- При обострении хронического заболевания, медикаментозная терапия направлена на облегчение его протекания.

- Если наличие белка в моче спровоцировано гестозом, больную госпитализируют для сохранения беременности в условиях стационара. Амбулаторное лечение возможно только при легкой стадии патологии.
- Лечение повышенной протеинурии на почве эклампсии предусматривает купирование болевого синдрома, чтобы облегчить состояние беременной и защитить малыша от возможных осложнений в развитии.
В процессе коррекции повышенных показателей белка в моче при беременности применяют сосудистые лекарственные средства, антикоагулянты, противосудорожные и диуретические препараты.
Как избежать протеинурии при беременности
Статистика свидетельствует о частом проявлении патологии среди женщин, ожидающих ребенка. Чтобы контролировать течение беременности, будущие мамы ежемесячно сдают кровь и мочу на анализ. Когда срок беременности перевалит за 30 недель, посещать лабораторию придется чаще — 1 раз в 7 — 10 дней. Делают это, чтобы предупредить опасную для здоровья беременной эклампсию.
Для профилактики развития гестоза важно регулярно контролировать качество выделяемой мочи. Если на поверхности выделяемой урины появляется обильная пенка, то такой тревожный симптом указывает на то, что белка в составе мочи много. Об этом нужно непременно рассказать гинекологу. Риск развития гестоза увеличивается при наличии хронических заболеваний мочевыделительной системы. Таким пациенткам показан бессолевой режим питания и обильный питьевой режим. Также не обойтись без измерения артериального давления и контроля прибавки в весе на каждом плановом осмотре.
Моча – побочный продукт жизнедеятельности человеческого организма, по состоянию которого и наличия в нем различных веществ делается заключение о состоянии здоровья человека. Проходя через мочевыводящие пути, урина смывает патогенную микрофлору, химические макро и микроэлементы, концентрация которых повышается при развитии воспалений и инфекций.
– один из пунктов
общего анализа мочи
, который показывает концентрацию в биологической жидкости
белка
. Результаты исследования дают возможность определить наличие в организме патологических процессов и воспалений на их ранней стадии. Анализ проводится, как при наличии определенных симптомов, с высокой долей вероятность указывающих на заболевания, так и в профилактических целях.
Результаты исследования дают возможность определить наличие в организме патологических процессов и воспалений на их ранней стадии. Анализ проводится, как при наличии определенных симптомов, с высокой долей вероятность указывающих на заболевания, так и в профилактических целях.
Белок – органическое соединение, необходимый элемент для клеток, их «строительный» материал. Моча с нормальным состоянием здоровья человека должна быть чистой, то есть не содержать в себе каких-либо органических соединений, в том числе и белка или же их концентрация должна быть минимальной.
Если количество белка в моче превышает показатель нормы, это признак развития в организме воспалительных или инфекционных заболеваний, либо обострения хронических патологий.
Суточная протеинурия – анализ мочи на определение концентрации белка – альбумина и иммуноглобулина. Анализ мочи на определение суточной протеинурии сдается в следующих случаях:
- злокачественные образования различной локации;
- инфекционные заболевания мочевого пузыря и других органов мочевыделительной системы;
- патологии аутоиммунного характера.

В обязательном порядке анализ на определение суточной протеинурии сдается во время беременности. Не реже 1 раза в 3 месяца анализ мочи необходимо сдавать людям, имеющим хронические заболевания в стадии ремиссии .
Анализ мочи и альбуминыБелок это высокомолекулярное органическое вещество, представленное в организме человека двумя элементами – альбумином и иммуноглобулином. Альбумин – белок, имеющий низкую молекулярную массу, растворим в воде.
Глобулин – белок, имеющий низкую степень растворимости в водной среде, имеющий высокую молекулярную массу.
Альбумины имеют достаточно крупный размер и не могут попасть в мочу из-за почечных
клубочков
, выполняющих функцию фильтра. Если в урине обнаружились альбумины, значит, почечные клубочки перестали выполнять свои функции. Наблюдается это при воспалительных и инфекционных заболеваниях органов
мочевыделительной системы
. Чем выше концентрация белковых
веществ
в биологической жидкости, тем интенсивней степень тяжести заболевания.
Обнаружение в моче глобулинов – явление крайне редкое. Альбумины в невысокой концентрации встречаются чаще, и нередко их появление в урине носит физиологический, не патологический характер. До конца 20 века наличие альбуминов в крови выделялось в отдельную патологию, которая называлась альбуминурия .
Подготовка к исследованию уриныАнализ на определение концентрации белка в моче имеет важнейшее значение для постановки диагноза. Чтобы анализ дал точный результат, к нему необходимо правильно подготовиться. За несколько дней до сбора урины пациент должен отказаться от:
- алкогольных и спиртосодержащих напитков;
- продуктов с высоким содержанием витамина С;
- приема мочегонных средств;
- физических нагрузок.
Перед тем, как сдавать анализ , в течение 1-2 дней важно соблюдать эмоциональную стабильность, оградиться от стрессовых ситуаций и психических потрясений.
Особенность сбора урины для анализа на протеинурию в том, что необходимо собрать суточную мочу. Если человек в первый раз собрал мочу в 7 утра, последний сбор должен быть в 7 утра следующего дня. В течение
суток
моча собирается в одну большую, стерильную тару. В течение суток урина должна храниться при температуре от 2
0
С до 8
0
С выше нуля.
Если человек в первый раз собрал мочу в 7 утра, последний сбор должен быть в 7 утра следующего дня. В течение
суток
моча собирается в одну большую, стерильную тару. В течение суток урина должна храниться при температуре от 2
0
С до 8
0
С выше нуля.
Для анализа нужно взять с общей посуды 50-70 мл и слить мочу в специальную емкость , приобретенную в аптеке. Перед взятием нужного количества мочи банку с общим количеством урины нужно хорошо взболтать. Пациенту необходимо записать, какой объем жидкости получился за сутки.
Отвести собранную мочу в лабораторию нужно в течение 2 часов после последнего сбора мочи.
Анализ не сдается при наличии у пациента вирусных и инфекционных заболеваний, например простуд, гриппа. Сначала нужно посетить лор-врача , получить от него предписание на лекарство , что не спровоцирует повышение белка в моче. После полного выздоровления должно пройти не меньше 2-3 суток, прежде чем собирать урину для исследования суточной протеинурии.
Нормы протеинов моче для взрослых (мужчин, женщин, беременных)Показатели нормы протеина (белка) у взрослых людей и у женщин в период беременности :
Показатели протеинурии у беременных женщин носят индивидуальный характер. Нормой считается повышение концентрации протеина до 0.14 г/л.
Нормой считается повышение концентрации протеина до 0.14 г/л.
Наличие протеинов в биологической жидкости человека может носить непатологический характер, то есть быть физиологической нормой и патологический, вызванный наличием определенных заболеваний.
Непатологический факторФизиологическое повышение белка в урине может быть вызвано следующими факторами:
- неправильное, несбалансированное питание;
- чрезмерные физические нагрузки;
- переохлаждение организма.
Если человек ежедневно употребляет пищу, в которой преобладает белок, концентрация протеина в урине будет отличаться в большую сторону от показателей нормы. Достаточно сбалансировать рацион, чтобы в нем были и белок и жиры и углеводы, чтобы устранить физиологическую протеинурию.
Еще одной причиной повышения протеина в собранной моче – регулярные физические нагрузки. Наблюдается физиологическая протеинурия у профессиональных спортсменов.
Норма показателей протеинурии всегда повышается при наличии инфекционных заболеваний. Не всегда это болезни органов мочевыделительной системы. Есть понятие – ортостатическая протеинурия, что наблюдается у маленьких детей и в подростковом возрасте.
Ортостатическая протеинурия это присутствие высокой концентрации белка в моче по причине развития острых или хронических инфекций, вне зависимости от места локации патогенного очага. Отреагировать организм повышением протеина может на развитие гриппа, отита и других болезней органов дыхательной системы.
Внутренние травмыПротеинурия повышается при любых патологических изменениях в состоянии внутренних органах. Белок появляется в моче после черепно-мозговых травм, что сопровождались повреждением головного мозга. Наблюдается временная протеинурия после хирургических операций.
Ожоговая болезньОжоги сопровождаются не только нарушением
целостности
кожного покрова и мягких тканей, но и развитием некротических процессов, вследствие которых организм испытывает тяжелую интоксикацию. Вследствие интенсивного отравления страдают
почки
, которые не могут выполнять свою функцию, почечные клубочки теряют свои фильтрационные свойства, пропуская через себя большое количество белка.
Вследствие интенсивного отравления страдают
почки
, которые не могут выполнять свою функцию, почечные клубочки теряют свои фильтрационные свойства, пропуская через себя большое количество белка.
При ожоговом поражении возникает почечная форма протеинурии, когда клетки не получают нужного количества кислорода, нарушается кровообращение, а белок попадает в мочу непосредственно из кровяного русла.
Радиационное поражениеРадиационная нефропатия – поражение почек высокими дозами облучения. Патология может возникнуть вследствие частого прохождения рентгена, либо введения определенных лекарственных средств, в составе которых радионуклиды. Возникает радиационное поражение у людей, занятых на вредных производствах.
Вредные вещества задерживаются в почках, приводя к структурным и функциональным изменениям мягкой ткани органа. Поражаются почечные клубочки, которые перестают задерживать протеин.
Мочекаменная болезньОдна из наиболее частых причин протеинурии – развитие мочекаменной болезни. Белок в моче появляется задолго до того, как у человека возникнут первые признаки болезни. Концентрация протеина повышается по мере развития патологии.
Симптомы
, сопровождаемые заболевание:
Белок в моче появляется задолго до того, как у человека возникнут первые признаки болезни. Концентрация протеина повышается по мере развития патологии.
Симптомы
, сопровождаемые заболевание:
- боль в пояснице, которая постоянно усиливается;
- нарушение мочеиспускания;
- болезненность и дискомфорт в нижней части живота;
- изменение цвета урины;
- повышение температуры тела;
- ухудшение общего состояния.
Диагностика при данных признаках всегда включает проведение анализа на протеинурию.
ОнкологияРазвитие онкологического новообразования всегда сопровождается повышением концентрации белка. По мере роста опухоль начинает сдавливать сосуды, нарушая кровообращение. Застой крови приводит к развитию клубочковой формы протеинурии.
Протеинурия возникает вне зависимости от того, в каком органе локализуется новообразование. Когда опухоль повреждает костную ткань, приводя к ее распаду, продукты этого процесса проникают в кровяное русло, с которого попадают в мочевыделительную систему и выводятся из организма с
уриной
с высоким содержанием белка.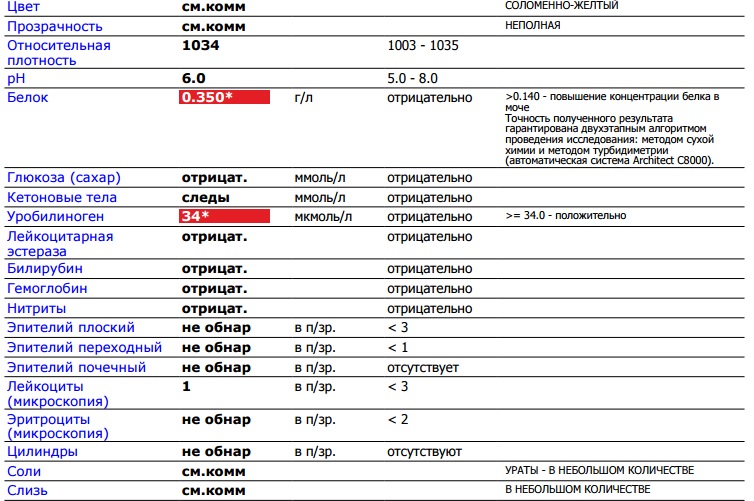
Во время беременности почки испытывают повышенную нагрузку, из-за чего наличие невысокой концентрации белка является нормой. Причина развития протеинурии во время беременности в том, что у женщины повышается артериальное давление, в том числе и в почках. Повышение давления становится причиной повреждения мелких капилляров, почечных клубочков и белковых молекул. Протеин проходит через прорехи в почечных клубочках, попадая в мочу.
Разрушение мелких капилляров с дальнейшим попаданием белка в мочу вызвано увеличивающейся в размере маткой, которая сдавливает кровеносные сосуды, приводя к застою крови в малом тазу.
При отсутствии воспалительных и инфекционных заболеваний, наличие белка в моче у беременной женщины является нормой. После родов протеин из урины пропадет.
Если анализ на суточную протеинурию показал повышенное содержание белка, не стоит впадать в панику, думая о самом плохом. На концентрацию протеина в суточной моче оказывает влияние множество факторов, например физическая нагрузка и эмоциональная нестабильность. Всегда есть вероятность того, что человек не соблюдал рекомендации по сбору мочи, что и привело к ложному результату.
Всегда есть вероятность того, что человек не соблюдал рекомендации по сбору мочи, что и привело к ложному результату.
Если у пациента нет симптомов, указывающих на развитие каких-либо патологий в организме, анализ на суточную протеинурию рекомендуется сдать повторно, чтобы исключить диагностическую ошибку.
Лечение протеинурии тесно связано с причиной ее возникновения. Пока не будет ликвидирован фактор, приведший к появлению белка в моче, терапия не даст положительного терапевтического эффекта. Для уменьшения белка в моче назначаются препараты группы станины, блокаторы кальциевых каналов и ингибиторы АПФ.
Дополнительно могут быть применены народные рецепты, например отвары на основе трав и природных компонентов – ромашки, зверобоя, коры дуба. Такие отвары помогут снять воспаление с внутренних органов, за счет чего понизиться концентрация протеина в урине.
Дополнительно с лечением причины появления протеинурии и приемом лекарств, пациенту придется соблюдать диету с низким содержанием белка и
натуральным
рационом питания, без добавления в продукты каких-либо усилителей вкуса, овощами и фруктами, нежирным мясом.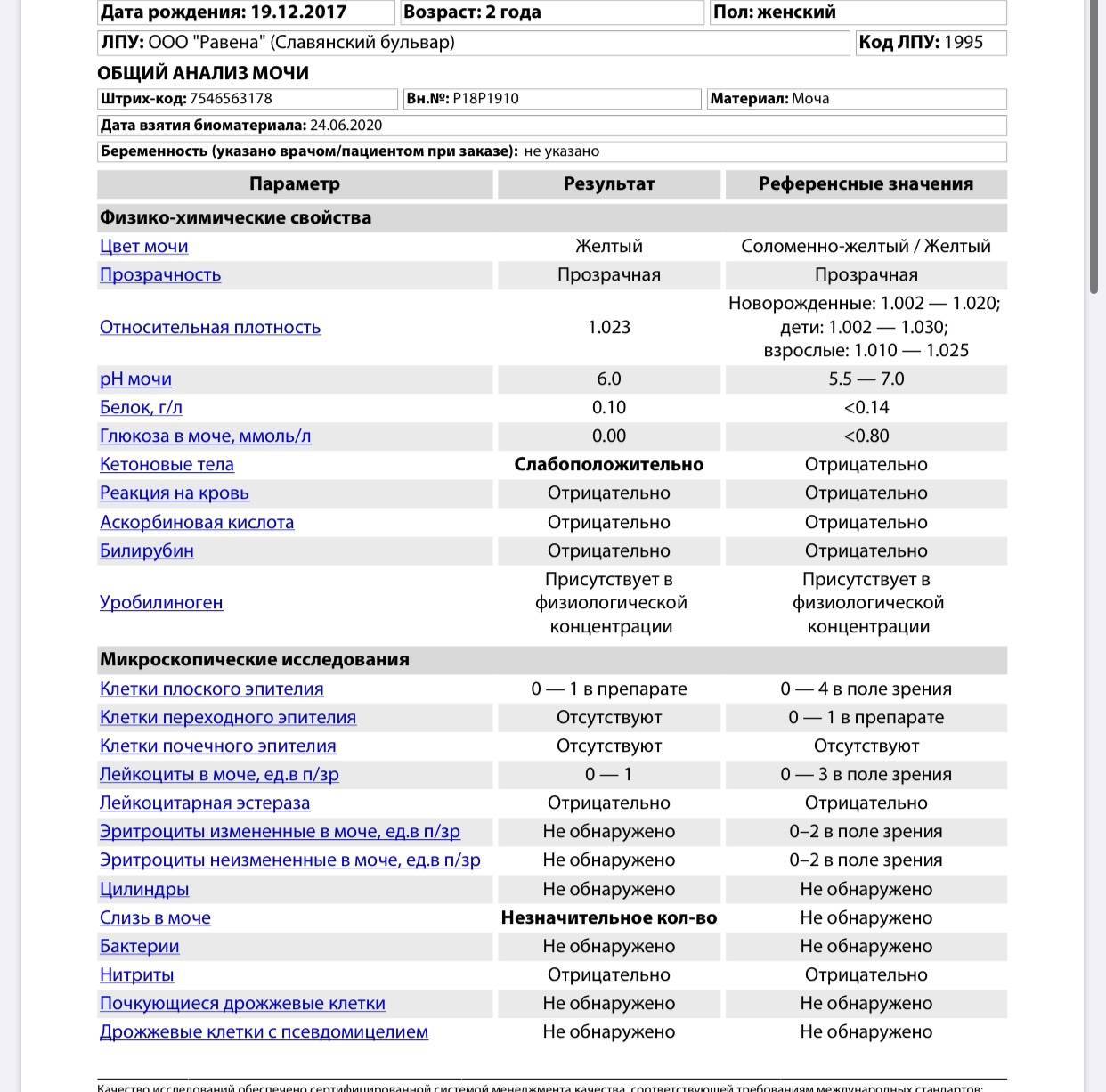
Суточная протеинурия – анализ, показывающий состояние здоровья человека, помогающий определить наличие патологических процессов. По результатам лабораторного теста можно выявить, как простые инфекции органов мочевыделительной системы, так и тяжелые, опасные для жизни патологии, например наличие онкологических новообразований.
Анализ на определение суточной протеинурии рекомендуется сдавать не только людям с наличием хронических заболеваний, но и в качестве профилактики. Многие болезни, в том числе и формирование онкологического новообразования, протекают в скрытой форме, и не сопровождаются какими-либо признаками в течение долгого времени. Выявляются они посредством прохождения лабораторного анализа на суточную протеинурию.
Учитывая диагностическую ценность и информативность лабораторного исследования урины, важно тщательно соблюдать рекомендации касательно подготовки к сбору биологического материала, чтобы исключить диагностическую ошибку.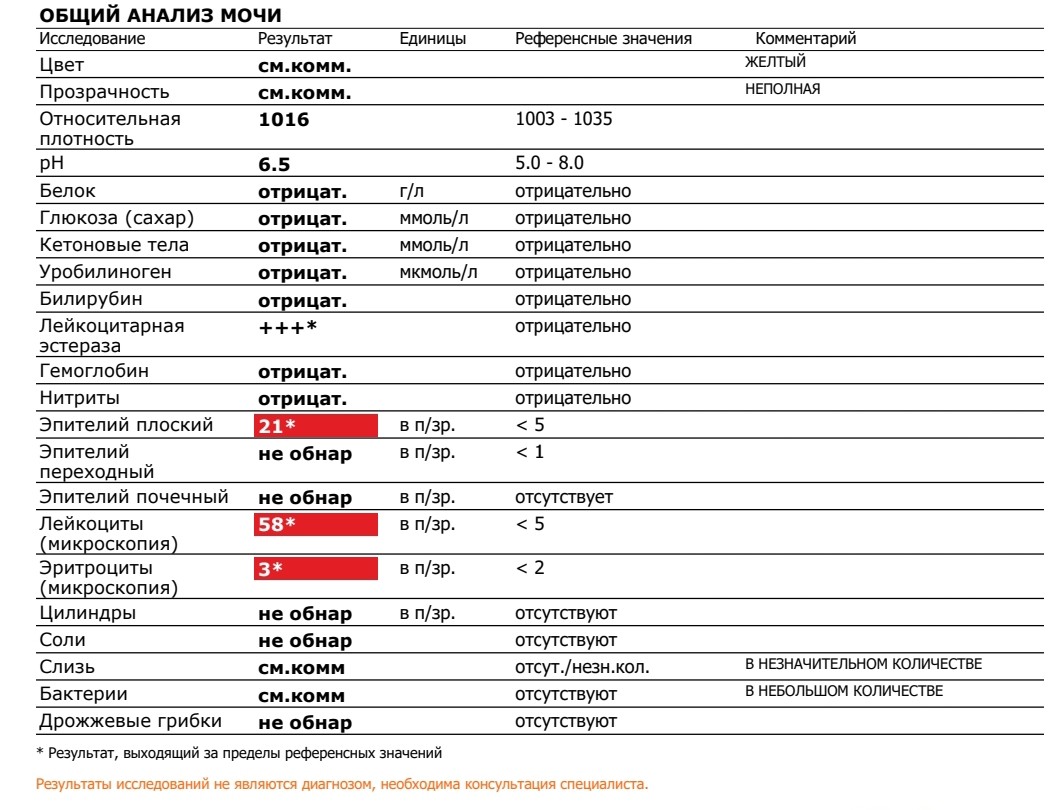
Протеинурия — это одна из видов патологии беременных женщин, возникающая вследствие перестройки организма. Выявляется заболевание путем анализа и выявления количества . После 30 недели этот диагноз ставится чаще всего. Указывает это на то, что мочевыводящая система беременной женщины не справляется со своими функциями.
Основные причины протеинурии
- Сложное течение болезни, связанное с поздним токсикозом, артериальной гипотензией, или судорогами. Все это может вызвать концентрацию белка в моче.
- Повышение артериального давления часто провоцирует патологию.
- Из-за того что иммунитет беременной женщины ослаблен, под действием возбудителей заболеваний, может развиться пиелонефрит. Хроническое течение болезни может спровоцировать протеинурию.
- 3. Протеинурия может, является симптомом аутоимонного заболевания женщины, обострившегося во время вынашивания ребенка.
- Гормональные нарушения, резус конфликт либо конфликт по группе крови, так же могут влиять на результат анализов.

Основные признаки, на которые стоит обратить внимание:
- Обострение заболеваний
Существует несколько стадий заболевания, разделенных по тяжести течения:
- Средняя стадия. Отеки более выражены и могут перейти на лицо или живот. Давление уже выше нормы (в среднем 175/ 100 мм. РТ. Ст.) Показатели белка в моче существенно превышают норму.
- Легкая стадия. На этом этапе, самочувствие будущей матери удовлетворительное. Давление слегка повышено, иногда наблюдается незначительные скачки температуры. Имеются небольшие отеки. Количество белка в моче немного выше нормы.
- Тяжелая стадия. Данная стадия несет весомую опасность жизни ребенка и матери. При ней наблюдаются существенные отеки по всему телу, очень высокое артериальное давление. Так же такое состояние может повлечь потерю сознания, судороги и рвоту. В медицине данная стадия называется эклампсия.
Опасность данной патологии заключается в том, что она может привести к нарушению мозговой деятельности, нарушению в работе нервной и сердечнососудистой систем, и даже состоянию комы. Поэтому своевременное обследование под контролем лечащего врача так важно.
Поэтому своевременное обследование под контролем лечащего врача так важно.
Лечение протеинурии беременным женщинам назначает врач. Если по итогам обследования, показатели не высокие, то назначается обильное питье. Так же дается рекомендация по уменьшению в рационе белковой пищи.
Если уровень белка в моче растет, выясняют и купируют состояние, приведшее к данной патологии.
Суточный анализ мочи — когда назначается, как собирать. Суточный диурез
Автор
Андрюхин Михаил Иванович
Врач
Доктор медицинских наук, профессор
Уролог
Суточный анализ мочи – это метод лабораторной диагностики, при котором объектом исследования является сразу весь суточный диурез (моча, выделенная пациентом за сутки).
Когда назначается суточный анализ мочи
Суточный анализ мочи назначается, прежде всего, для проверки функционирования почек, а также в целях контроля веществ, выводимых из организма с мочой в течение суток.
Показаниями к назначению суточного анализа мочи являются:
- подозрения на некоторые заболевания почек;
- сахарный диабет. Анализ используется для контроля суточного уровня глюкозы в моче;
- беременность. Анализ используется для оценки, насколько хорошо почки будущей матери справляются с повышенной нагрузкой.
Подготовка к суточному анализу мочи
Специальной подготовки к суточному анализу мочи не требуется. В день сбора мочи должен быть исключен прием мочегонных препаратов. Также необходимо в этот день соблюдать обычный питьевой режим (количество потребленной жидкости должно быть таким, как обычно).
Как собрать суточную мочу на анализ
Суточный анализ мочиСбор мочи осуществляется в большую стерильную емкость.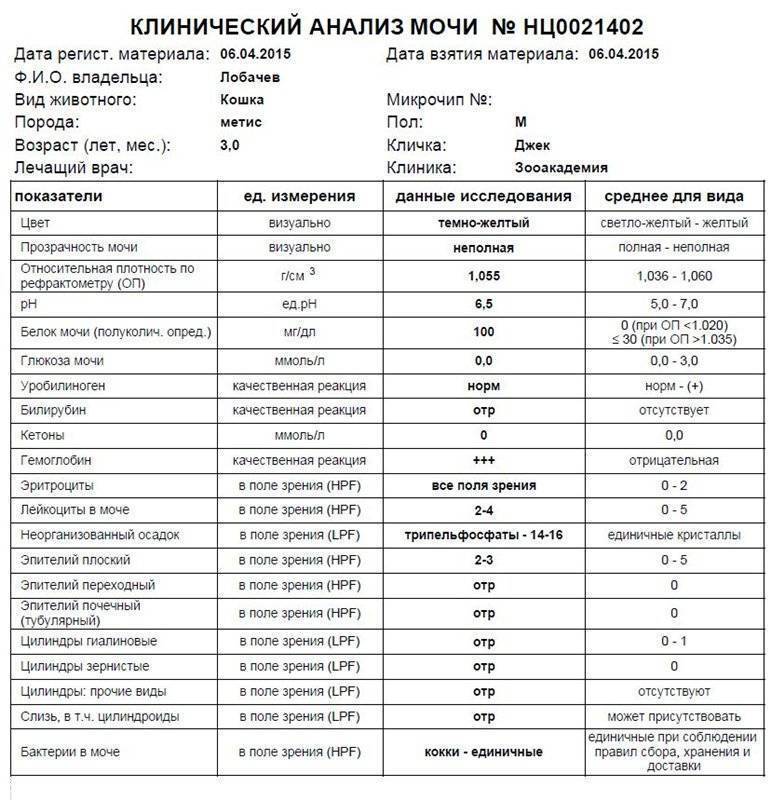 Предпочтительно использовать емкость, имеющие мерные деления (потом надо будет установить весь объем собранной мочи).
Предпочтительно использовать емкость, имеющие мерные деления (потом надо будет установить весь объем собранной мочи).Утренняя порция мочи выпускается в унитаз. При следующем мочеиспускании моча собирается в ёмкость. Необходимо будет заметить, во сколько это произошло. Далее, вся моча в течение суток (до того же времени следующего дня) должна собираться в эту же ёмкость.
Крайне важно, чтобы была собрана вся суточная моча, поэтому на день сбора материала анализа не следует планировать дальних поездок.
Ёмкость с мочой необходимо держать в холодильнике.
По окончании сбора материала надо будет самостоятельно оценить общий объём собранной мочи. После чего моча перемешивается и часть её (до 200 мл) отливается в специальный контейнер. Именно этот контейнер доставляется в лабораторию (весь объём мочи доставлять не надо).
При сдаче мочи в лабораторию необходимо указать с какого по какое время собиралась моча; каков получился общий объем мочи.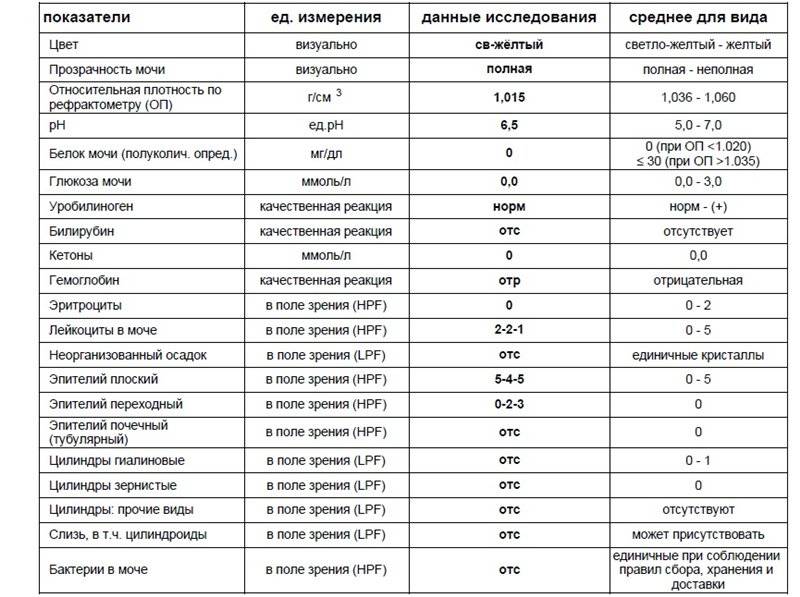 В некоторых случаях потребуется указать свой точный рост и вес.
В некоторых случаях потребуется указать свой точный рост и вес.
Показатели суточного анализа мочи
Основными показателями, которые оцениваются при суточном анализе мочи, являются:
- общий объем мочи (суточный диурез). В норме суточный диурез должен составлять: у женщин – 1000-1600 мл, у мужчин – 1000-2000 мл;
- креатинин. Норма для этого показателя составляет 5,3-16 ммоль/сут для женщин и 7-18 ммоль/сут для мужчин. Повышенные значения могут указывать на сахарный диабет, острые инфекции, гипотериоз (заболевание щитовидной железы) и некоторые другие патологии. Значения ниже нормы могут наблюдаться при заболеваниях почках, анемии и других патологиях;
- мочевина. Норма – 250-570 ммоль/сут. Повышенные значения характерны для гиперфункции щитовидной железы или злокачественной анемии; они также могут наблюдаться при значительных физических нагрузках или приеме в пищу продуктов с большим содержанием белка;
- белок.
 Суточный анализ мочи на белок назначается, как правило, после того, как повышенный белок был обнаружен при общеклиническом анализе. Нормальные значения для суточного анализа: выделение белка 0,08-0,24 г/сут, концентрация – 0,0 – 0,14 г/л;
Суточный анализ мочи на белок назначается, как правило, после того, как повышенный белок был обнаружен при общеклиническом анализе. Нормальные значения для суточного анализа: выделение белка 0,08-0,24 г/сут, концентрация – 0,0 – 0,14 г/л; - глюкоза. Суточный анализ мочи на глюкозу назначается при сахарном диабете. С его помощью контролируют состояние больного и эффективность проводимой терапии. Нормальное значение этого показателя – не более 1,6 ммоль/сут.
- оксалаты. Норма: 228-626 мкмоль/сут или 20-54 мг/сут (для женщин) и 228-683 мкмоль/сут или 20-60 мг/сут (для мужчин).
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Общий анализ мочи ОАМ: расшифровка норм и отклонений
Общий анализ мочи все чаще оценивает аппарат, а результат больше похож на чек в супермаркете. Мы поможем разобраться в медицинских иероглифах.

В прошлый раз мы рассказали о том, как расшифровать показатели общего анализа крови. Сегодня наш эксперт объясняет, как трактовать отклонения от нормы в анализе мочи.
Расшифровка анализа мочи — нормы показателей
Color (цвет). Норма цвета мочи — соломенно-желтый
Естественный цвет мочи – соломенно-желтый. Пигменты мочи – урохромы – придают концентрированной моче более насыщенную, тёмную окраску. Когда же моча слабоконцентрированная и пигмента в ней мало, цвет становится светло-желтым. Изменения цвета мочи могут быть физиологическими, например, после появления в ней пищевых хромогенов: красный цвет появляется после употребления свёклы, желто-коричневый – после ревеня или моркови.
Краснеть моча будет при появлении следов распада гемоглобина после переохлаждения, длительной ходьбы или бега. Также изменение мочи может быть следствием заболеваний: потемнение мочи – при гепатите, циррозе, механической желтухе, посветление –при сахарном диабете, покраснение – при появлении крови в моче.
Показатель прозрачности мочи (полная/неполная). Норма — полная
Помутнение мочи – признак наличия эпителия или слизи (в норме), либо лейкоцитов, эритроцитов, бактерий, выпадения осадков солей (при патологии).
Относительная плотность (S.
G). Норма – 1010−1023Этот показатель оценивает способность почек концентрировать мочу, то есть выполнять свою основную функцию. При незначительном поражении почек плотность мочи в течение дня может колебаться от 1004 до 1023. 1023 – минимальная верхняя граница, при которой почки рассматриваются как здоровые.
Повышение значений характерно для обезвоживания, сахарного диабета, выделения белка при заболеваниях почек, заболеваний печени и сердечной недостаточности, снижение значений – при несахарном диабете, хронической почечной недостаточности, обильном питье или приеме мочегонных.
Показатель кислотности мочи (pH).
 Норма – 5,0−7,0
Норма – 5,0−7,0
Показатель кислотности здорового человека в норме колеблется между 5,0 и 7,0 и во многом определяется характером диеты. При мясной диете моча закисляется, pH снижается до 4,6−5,0. Овощная и молочная диета, напротив, вызывают защелачивание мочи и pH выше 7,0. Из патологических состояний снижение pH характерно для обезвоживания, длительного голодания, сахарного диабета, лихорадки, диареи. Повышение встречается при хронической почечной недостаточности, длительной рвоте, гиперфункции паращитовидных желез, опухолях мочеполовой системы.
Белок (PRO). Норма – до 0,033 г/л
В норме количество белка, выделяемого почками за сутки, не превышает 100−150 мг/сут. (0,1
– 0,15 г/л), а в однократной пробе мочи его не должно быть больше 0,033 г/л. При нарушении
почечной функции и различных заболеваниях белок в моче может появляться в гораздо большем количестве.
Выделяют так называемую транзиторную протеинурию – эпизодическое появление белка в моче, связанное с физической
работой, стрессом.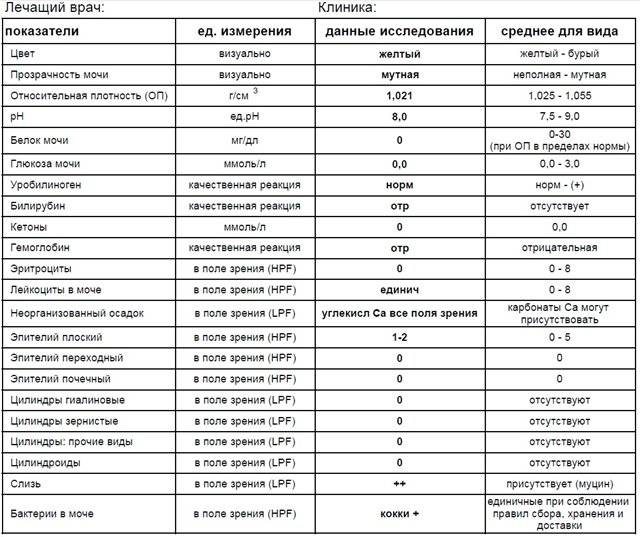 Также белок появляется в моче при лихорадке. Остальные причины связаны с развитием
патологии, это острые и хронические гломерулонефриты, пиелонефриты, воспалительные заболевания мочевых путей
(цистит, уретрит) и опухоли, гипертоническая болезнь и выраженная сердечная недостаточность.
Также белок появляется в моче при лихорадке. Остальные причины связаны с развитием
патологии, это острые и хронические гломерулонефриты, пиелонефриты, воспалительные заболевания мочевых путей
(цистит, уретрит) и опухоли, гипертоническая болезнь и выраженная сердечная недостаточность.
Глюкоза в моче (GLU). Норма отсутствует
В норме глюкоза в моче отсутствует или обнаруживается в минимальных количествах, так как подвергается в почечных канальцах обратному всасыванию. При концентрации глюкозы в крови более 9−10 ммоль/л эта способность утрачивается. С возрастом, а также под влиянием диабета и гипертонии уровень снижается до 8,8 ммоль/л и даже меньше. Кроме диабета причинами глюкозурии могут оказаться острый панкреатит, инфаркт миокарда, тяжелая травма, ожоги, беременность и одновременный прием большого количества углеводов.
Билирубин (BIL). Норма отсутствует
Моча здоровых людей содержит минимальные, неопределяемые количества билирубина. Он появляется, главным образом,
при поражении паренхимы печени (вирусный гепатит, цирроз печени, опухоли печени или метастазы в неё) либо при
механическом затруднении оттока желчи (механическая желтуха).
Он появляется, главным образом,
при поражении паренхимы печени (вирусный гепатит, цирроз печени, опухоли печени или метастазы в неё) либо при
механическом затруднении оттока желчи (механическая желтуха).
Уробилиноген (UBG). Норма – равно 17 мколь/л или менее
Это вещество – производное билирубина, которое в норме выделяется с мочой и калом. При этом содержание уробилиногена в моче не должно превышать 17 мкмоль/л. Если с мочой выделяется больше уробилиногена, это состояние носит название уробилиногенурия. Характерно для гемолиза (внутрисосудистого разрушения эритроцитов), но также может появляться при рассасывании массивных гематом, различных поражениях паренхимы печени (острые и хронические гепатиты, отравления, опухоли печени) и заболеваниях кишечника (энтероколиты, запоры, кишечная непроходимость, гнойные процесс в кишечнике).
Кетоновые тела (KET). Норма отсутствует
К ним относятся ацетон и близкие ему вещества.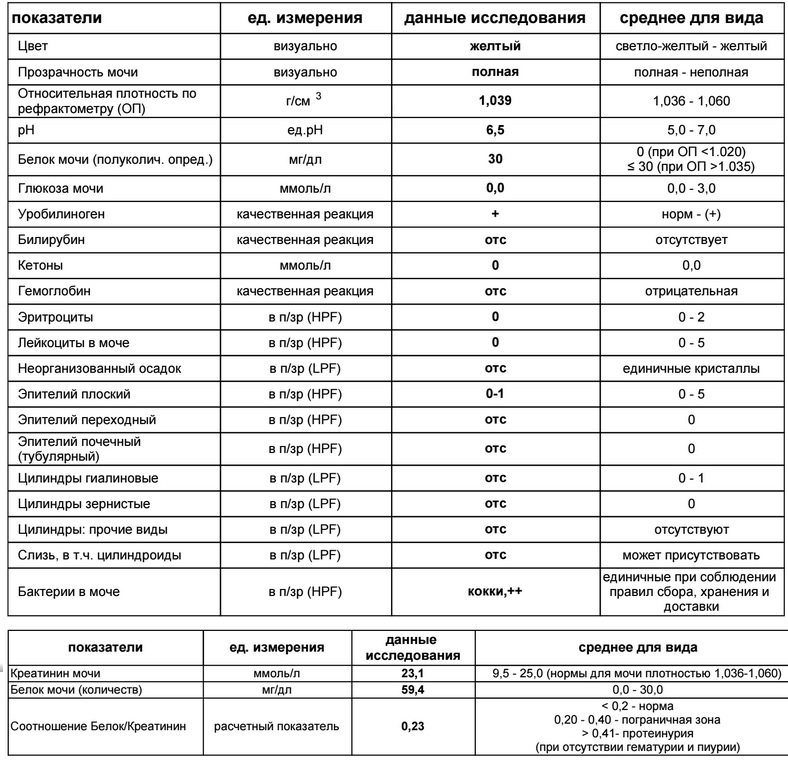 Появление кетоновых тел – главный признак
декомпенсации сахарного диабета. Также имеет место алкогольный кетоацидоз на фоне запоя, кетонурия при остром
панкреатите, тиреотоксикозе, но также они могут появиться по физиологическим причинам (прием белковой пищи
или длительное голодание, большие операции и травмы).
Появление кетоновых тел – главный признак
декомпенсации сахарного диабета. Также имеет место алкогольный кетоацидоз на фоне запоя, кетонурия при остром
панкреатите, тиреотоксикозе, но также они могут появиться по физиологическим причинам (прием белковой пищи
или длительное голодание, большие операции и травмы).
Гемоглобин в моче. Норма отсутствует
Появление в моче гемоглобина может свидетельствовать либо о разрушении эритроцитов в кровеносном русле (гемолизе), либо о кровотечении из мочеполовых путей. Тест на гемоглобин дает лишь положительный или отрицательный результат, дальнейшую диагностику нужно проводить, изучая мочевой осадок и содержащиеся в нем в этом случае эритроциты.
Нитриты (NIT). Норма отсутствует
В норме нитриты в моче отсутствуют. Их обнаружение говорит о длительном нахождении мочи в мочевом
пузыре (более 4 часов), особенно в случае, когда употреблялись богатые нитратами продукты. Но чаще
появление нитритов свидетельствует о наличии в мочеполовой системе бактерий, вызывающих воспаление. Для
подтверждения этого необходимо пристально изучить мочевой осадок (выявление лейкоцитов, бактерий и т. д.), о чём мы расскажем во второй части статьи про
общеклинический анализ мочи.
Но чаще
появление нитритов свидетельствует о наличии в мочеполовой системе бактерий, вызывающих воспаление. Для
подтверждения этого необходимо пристально изучить мочевой осадок (выявление лейкоцитов, бактерий и т. д.), о чём мы расскажем во второй части статьи про
общеклинический анализ мочи.
Задать вопрос врачу-терапевту или врачу-урологу о своём здоровье Вы всегда можете в мобильном приложении Доктис. Первая консультация бесплатно! Скачивайте прямо сейчас!
Читайте также по теме
Антибиотики при бактериальной инфекции в моче во время беременности при отсутствии симптомов
В чем суть проблемы?
Может ли применение антибиотиков во время беременности у женщин с мочевой инфекцией, но с отсутствием симптомов, улучшить исходы у женщин и их детей?
Почему это важно?
Бактериальная инфекция в моче без каких-либо характерных симптомов, связанных с инфекцией мочевыводящих путей (асимптоматическая/бессимптомная бактериурия), происходит в ряде случаев (от 2% до 15%) беременностей. Из-за изменений, происходящих в организме, у беременных женщин чаще развивается почечная инфекция (пиелонефрит), если у них есть инфекция мочевыводящих путей. Инфекция может также способствовать преждевременному рождению ребенка (до 37 недель) или рождению ребенка с низкой массой тела (менее 2500 г (5,5 фунтов)).
Из-за изменений, происходящих в организме, у беременных женщин чаще развивается почечная инфекция (пиелонефрит), если у них есть инфекция мочевыводящих путей. Инфекция может также способствовать преждевременному рождению ребенка (до 37 недель) или рождению ребенка с низкой массой тела (менее 2500 г (5,5 фунтов)).
Какие доказательства мы нашли?
Мы обнаружили 15 рандомизированных контролируемых исследований с участием более 2000 беременных женщин с бессимптомными инфекциями мочевыводящих путей. Антибиотики могут быть эффективными в снижении частоты инфекции почек у матери (12 исследований, 2017 женщин) и санации [очищении] мочи от инфекции (четыре исследования, 596 женщин). Они также могут снизить частоту преждевременных родов (три исследования, 327 женщин) и рождения детей с низкой массой тела (шесть исследований, 1437 младенцев). Ни в одном из исследований не были адекватно оценены какие-либо неблагоприятные эффекты антибиотикотерапии у матери или ее ребенка, и часто способ проведения исследования не был описан должным образом.
Мы оценили три основных исхода с помощью подхода GRADE и обнаружили доказательства низкой определенности, что лечение антибиотиками может предотвратить развитие пиелонефрита, преждевременные роды и рождение детей с массой тела менее 2500 г.
Что это значит?
Антибактериальная терапия может снизить риск инфекций почек у беременных женщин с бессимптомной мочевой инфекцией. Антибиотики могут также уменьшить вероятность рождения ребенка на слишком ранних сроках или с низкой массой тела при рождении. Однако из-за низкой определенности доказательств сделать выводы сложно; необходимы дополнительные исследования.
Анализ мочи в сравнении с соотношением белка и креатинина в моче для прогнозирования значительной протеинурии при беременности
Исследуемая популяция
Всего было оценено 116 парных образцов. Из них 48% имели значительную протеинурию. Сорок один процент были от первобеременных. В общей сложности 41% образцов были получены от женщин европеоидной расы, 31% от латиноамериканок, 16% от азиатских женщин и 12% от афроамериканок. У многих испытуемых были медицинские условия, предрасполагающие к преэклампсии (таблица 1).
У многих испытуемых были медицинские условия, предрасполагающие к преэклампсии (таблица 1).
Соотношение белок-креатинин мочи и анализ мочи коррелировали с золотым стандартом, 24-часовой протеинурией.Коэффициент корреляции соотношения белок/креатинин в моче составил 0,83 (95% ДИ от 0,76 до 0,88). Для анализа мочи он составил 0,64 (95% ДИ от 0,52 до 0,74).
Кривые рабочих характеристик приемника
ROC-кривые для отношения белка к креатинину в моче и анализа мочи представлены на рис. 1. Диагностический тест с площадью под ROC-кривой, наиболее близкой к 1,0, имеет наилучшую дискриминационную способность. Площадь под ROC-кривой соотношения белок/креатинин в моче равнялась 0.89 (95% ДИ от 0,83 до 0,95), а площадь под ROC-кривой для анализа мочи составила 0,71 (95% ДИ от 0,64 до 0,77). Площади под этими кривыми значительно различались ( P <0,001).
Площади под этими кривыми значительно различались ( P <0,001).
Кривые рабочих характеристик приемника (ROC) для соотношения белок/креатинин мочи ( a ) и для анализа мочи ( b ). Площадь под ROC-кривой для соотношения белок-креатинин в моче составляет 0,89 (95% ДИ от 0,83 до 0,95), а площадь под ROC-кривой для анализа мочи равна 0.71 (95% ДИ от 0,64 до 0,77). Площади под этими кривыми значительно различаются ( P <0,001). Выбранные значения для каждой меры, а также чувствительность или специфичность выделяются.
Чувствительность и специфичность соотношения белок-креатинин мочи и анализа мочи для прогнозирования значительной протеинурии (⩾300 мг протеинурии за 24-часовой период)
Соотношение белок-креатинин мочи является более чувствительным тестом для прогнозирования к анализу мочи, даже при сопоставлении по специфичности.Таблица 2 демонстрирует чувствительность и специфичность обоих тестов при выбранных пороговых значениях. Эти точки были выбраны потому, что они демонстрируют диапазон от максимальной чувствительности до максимальной специфичности. Обратите внимание, что автоматические тест-полоски не сообщают о «следовой» протеинурии.
Эти точки были выбраны потому, что они демонстрируют диапазон от максимальной чувствительности до максимальной специфичности. Обратите внимание, что автоматические тест-полоски не сообщают о «следовой» протеинурии.
Чувствительность соотношения белок-креатинин в моче различалась в зависимости от используемой отсечки.Мы выделяем два клинически полезных предельных значения, полученных из кривой ROC, одно из которых обеспечивает максимальную чувствительность, а другое — максимальную специфичность. Пороговое значение ⩾0,15 имело чувствительность 96% (95% ДИ от 87 до 99%) и специфичность 53% (95% ДИ от 40 до 66%). Пороговое значение ⩾0,28 имело чувствительность 66% (95% ДИ от 52 до 78%) и специфичность 95% (95% ДИ от 86 до 99%).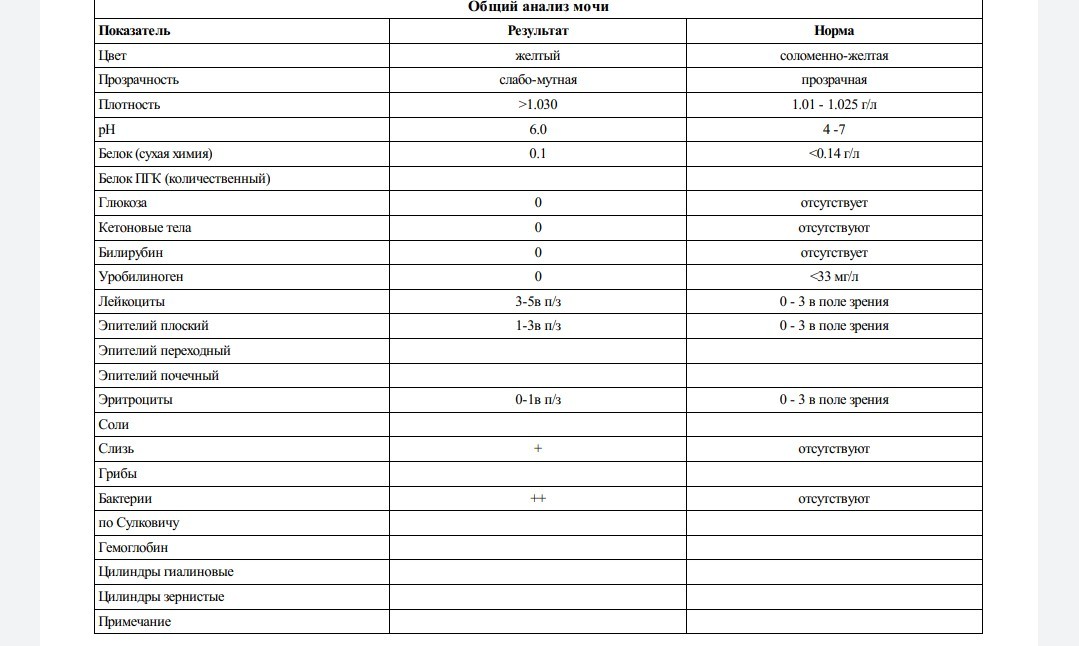 Обратите внимание, что пороговое значение ⩾0,19 максимизирует как чувствительность (89, 95% ДИ от 78 до 96%), так и специфичность (70, 95% ДИ от 59 до 83%), но значительно ухудшает оба измерения.
Обратите внимание, что пороговое значение ⩾0,19 максимизирует как чувствительность (89, 95% ДИ от 78 до 96%), так и специфичность (70, 95% ДИ от 59 до 83%), но значительно ухудшает оба измерения.
Чувствительность анализа мочи варьировалась от 11 до 41% в зависимости от используемого порога (таблица 2). Протеинурия выше или равная 1+ на тест-полоске имела чувствительность 41% (95% ДИ от 28 до 55%) и специфичность 100% (95% ДИ от 93 до 100%).
Эти данные показывают, что при использовании порогового значения ⩾0,15 соотношение белок-креатинин мочи является значительно более чувствительным, чем анализ мочи (96 против 41%, P <0,001). Даже при сопоставлении двух тестов по клинически значимой специфичности с пороговым значением соотношения белок/креатинин в моче ⩾0.28 и пороговое значение анализа мочи ⩾1+ (специфичность 95 и 100% соответственно), чувствительность соотношения белок/креатинин мочи лучше, чем у анализа мочи (66 против 41%, P =0,001).
Отношения правдоподобия для отношения белка к креатинину в моче и анализа мочи
В отличие от прогностических значений, LR менее подвержены колебаниям распространенности заболевания в данной популяции.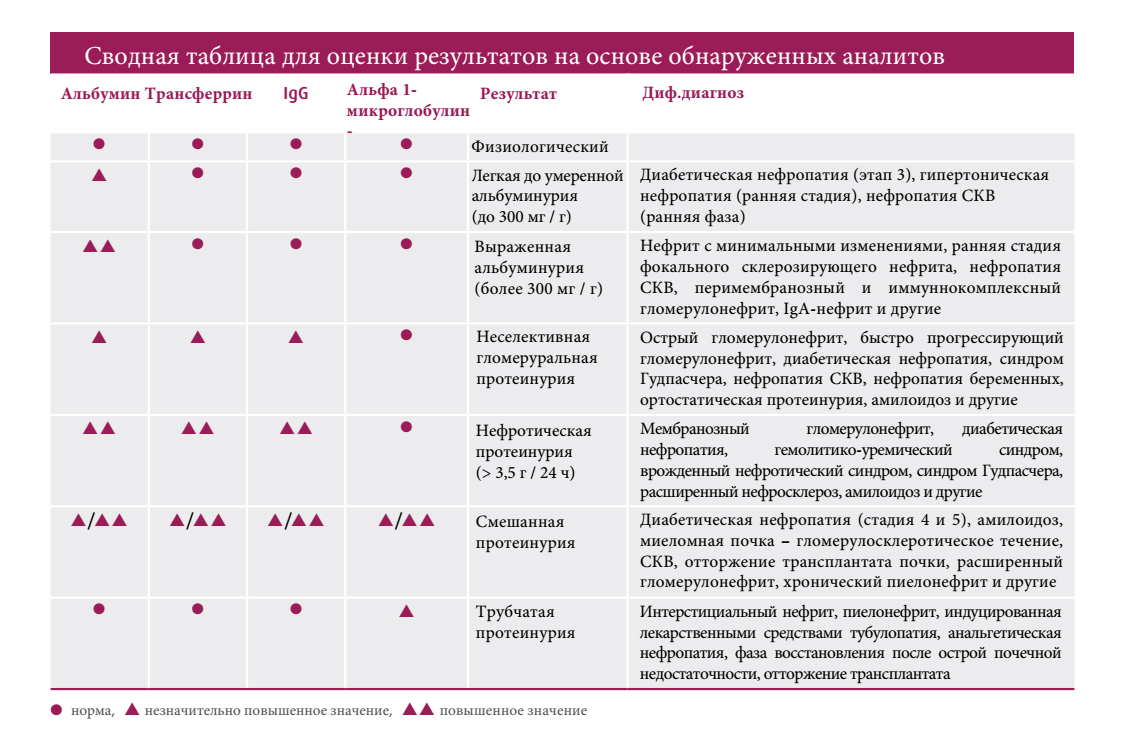 17 Перечислим LR для диапазонов каждого теста (табл. 3). Как правило, диагностический тест с LR>10 или <0.10 резко изменяет претестовую вероятность и считается сильным диагностическим тестом. 20
17 Перечислим LR для диапазонов каждого теста (табл. 3). Как правило, диагностический тест с LR>10 или <0.10 резко изменяет претестовую вероятность и считается сильным диагностическим тестом. 20
Однако значения соотношения белок/креатинин мочи от 0,15 до 0,27 (LR=0,73, 95% ДИ 0,44-1,20) и отрицательный анализ мочи (LR=0,59, 95% ДИ 0,47-0,73) не оказывают существенного влияния на предтестовую вероятность . Следовательно, образцы мочи с такими результатами являются неопределенными.
Следовательно, образцы мочи с такими результатами являются неопределенными.
Таким образом, соотношение белок/креатинин в моче полезно для диагностики, когда значение <0,15 или ⩾0,28, но неопределенно в среднем диапазоне. Точно так же анализ мочи полезен, когда значение ⩾1 + белок, но неопределенно, когда оно отрицательно для белка. В нашем исследовании соотношение белок-креатинин мочи было диагностическим в 64% наших образцов, тогда как анализ мочи был диагностическим только в 19% наших образцов ( P <0,001).
Чувствительность и специфичность соотношения белок-креатинин мочи и анализа мочи для прогнозирования тяжелой протеинурии (⩾5000 мг протеинурии за 24-часовой период) — отношение креатинина и каждое отсечение анализа мочи, чтобы продемонстрировать точность каждого теста для прогнозирования ⩾5000 мг протеинурии за 24-часовой период (таблица 4).Только у трех пациентов в нашем исследовании была протеинурия ⩾5000 мг белка. В качестве скринингового теста для выявления пациентов, у которых может быть тяжелая протеинурия, соотношение белок-креатинин в моче и анализ мочи являются очень хорошими.
 Оба они также обладают хорошей специфичностью, в частности соотношение белок/креатинин в моче ≥ 5,0 и анализ мочи ⩾ 3+. На самом деле, для прогнозирования тяжелой протеинурии маловероятно, что соотношение белок-креатинин в моче может повысить полезность только анализа мочи. Следует соблюдать осторожность при использовании выборочных исследований мочи, а не 24-часового сбора мочи для постановки диагноза тяжелой протеинурии, поскольку этот анализ ограничен относительно небольшим числом пациентов с тяжелой протеинурией в этом исследовании и, следовательно, невозможностью точно описать диапазон. Таблица 4 Чувствительность, специфичность, положительная прогностическая ценность и отрицательная прогностическая ценность для выбранных пороговых значений соотношения белок/креатинин в моче и анализа мочи для прогнозирования ⩾5000 мг белка на 24 ч мочи из нашей когорты были от пациентов, которые ранее предоставили образцы, мы провели анализ чувствительности, сравнив результаты нашей начальной когорты с когортой за вычетом этих 21 образца.
Оба они также обладают хорошей специфичностью, в частности соотношение белок/креатинин в моче ≥ 5,0 и анализ мочи ⩾ 3+. На самом деле, для прогнозирования тяжелой протеинурии маловероятно, что соотношение белок-креатинин в моче может повысить полезность только анализа мочи. Следует соблюдать осторожность при использовании выборочных исследований мочи, а не 24-часового сбора мочи для постановки диагноза тяжелой протеинурии, поскольку этот анализ ограничен относительно небольшим числом пациентов с тяжелой протеинурией в этом исследовании и, следовательно, невозможностью точно описать диапазон. Таблица 4 Чувствительность, специфичность, положительная прогностическая ценность и отрицательная прогностическая ценность для выбранных пороговых значений соотношения белок/креатинин в моче и анализа мочи для прогнозирования ⩾5000 мг белка на 24 ч мочи из нашей когорты были от пациентов, которые ранее предоставили образцы, мы провели анализ чувствительности, сравнив результаты нашей начальной когорты с когортой за вычетом этих 21 образца. Каждая приведенная выше статистическая величина была рассчитана для каждой группы, включая коэффициенты корреляции Спирмена, площадь под ROC-кривыми, чувствительность и специфичность для выбранных пороговых значений и LR для выбранных диапазонов. Все эти результаты тестов были идентичны или почти идентичны значениям, рассчитанным для всей исследуемой группы. Как и ожидалось, доверительные интервалы для чувствительности, специфичности и LR были несколько шире для группы с меньшим количеством образцов.
Каждая приведенная выше статистическая величина была рассчитана для каждой группы, включая коэффициенты корреляции Спирмена, площадь под ROC-кривыми, чувствительность и специфичность для выбранных пороговых значений и LR для выбранных диапазонов. Все эти результаты тестов были идентичны или почти идентичны значениям, рассчитанным для всей исследуемой группы. Как и ожидалось, доверительные интервалы для чувствительности, специфичности и LR были несколько шире для группы с меньшим количеством образцов.Преэклампсия: основы практики, обзор, патофизиология
[рекомендации] Американский колледж акушеров и гинекологов, Целевая группа по гипертензии у беременных.Гипертония при беременности. Отчет Целевой группы Американского колледжа акушеров и гинекологов по гипертонии у беременных. Акушерство Гинекол . 2013 ноябрь 122 (5): 1122-31. [Ссылка QxMD MEDLINE]. [Полный текст].
Taylor RN, de Groot CJ, Cho YK, et al. Циркулирующие факторы как маркеры и медиаторы дисфункции эндотелиальных клеток при преэклампсии. Semin Reprod Endocrinol . 1998. 16(1):17-31. [Ссылка QxMD MEDLINE].
Barron WM, Heckerling P, Hibbard JU, et al. Сокращение ненужных тестов на коагуляцию при гипертензивных расстройствах беременности. Акушерство Гинекол . 1999 сен. 94(3):364-70. [Ссылка QxMD MEDLINE].
Сибай БМ. Профилактика сульфатом магния при преэклампсии: уроки, извлеченные из недавних испытаний. Am J Obstet Gynecol . 2004 г., июнь 190(6):1520-6.[Ссылка QxMD MEDLINE].
Сибай БМ. Диагностика и лечение гестационной гипертензии и преэклампсии. Акушерство Гинекол . 2003 г., июль 102 (1): 181–92. [Ссылка QxMD MEDLINE].
Несс Р.Б., Робертс Дж.М.Гетерогенные причины, составляющие единый синдром преэклампсии: гипотеза и ее значение. Am J Obstet Gynecol . 1996 ноябрь 175(5):1365-70. [Ссылка QxMD MEDLINE].
Vatten LJ, Skjaerven R. Является ли преэклампсия более чем одним заболеванием?. БЖОГ . 2004 г., апрель 111(4):298-302. [Ссылка QxMD MEDLINE].
Виллар Дж., Бетран А. П., Гулмезоглу М. Эпидемиологическая основа планирования служб охраны материнства. ВОЗ/RHR .2001.
П., Гулмезоглу М. Эпидемиологическая основа планирования служб охраны материнства. ВОЗ/RHR .2001.
Хедун С.М., Мудли Дж., Найкер Т. и др. Медикаментозное лечение гипертонических расстройств беременных. Фармакол Тер . 1997. 74(2):221-58. [Ссылка QxMD MEDLINE].
Ngoc NT, Merialdi M, Abdel-Aleem H, Carroli G, Purwar M, Zavaleta N, et al. Причины мертворождений и ранней неонатальной смертности: данные о 7993 беременностях в шести развивающихся странах. Bull World Health Organ . 2006 Сентябрь 84 (9): 699-705. [Ссылка QxMD MEDLINE].[Полный текст].
Отчет рабочей группы Национальной образовательной программы по высокому кровяному давлению по высокому кровяному давлению у беременных. Am J Obstet Gynecol . 2000 г., июль 183 (1): S1-S22. [Ссылка QxMD MEDLINE].
Mackillop L. Преэклампсия: снижение риска с помощью добавок кальция. БМЖ Клин Эвид . 2015 г., 7 декабря. 2015 г.: [Ссылка на MEDLINE QxMD].
Витлин А.Г., Фридман С.А., Сибай Б.М. Влияние терапии сульфатом магния на продолжительность родов у женщин с легкой преэклампсией в срок: рандомизированное двойное слепое плацебо-контролируемое исследование. Am J Obstet Gynecol . 1997 март 176(3):623-7. [Ссылка QxMD MEDLINE].
Livingston JC, Livingston LW, Ramsey R, et al.Сульфат магния у женщин с легкой преэклампсией: рандомизированное контролируемое исследование. Акушерство Гинекол . 2003 фев. 101(2):217-20. [Ссылка QxMD MEDLINE].
Акушерство Гинекол . 2003 фев. 101(2):217-20. [Ссылка QxMD MEDLINE].
Беллами Л., Касас Дж. П., Хингорани А. Д. и др. Преэклампсия и риск сердечно-сосудистых заболеваний и рака в более позднем возрасте: систематический обзор и метаанализ. БМЖ . 2007 г., 10 ноября. 335 (7627): 974. [Ссылка QxMD MEDLINE].
Харскэмп Р.Е., Зееман Г.Г. Преэклампсия: риск отдаленных сердечно-сосудистых заболеваний. Am J Med Sci . 2007 г., октябрь 334 (4): 291-5. [Ссылка QxMD MEDLINE].
Cunningham FG, Veno KJ, Bloom SL, et al. Беременность Гипертония. В: Williams Obstetrics . 23е. 2010.
ВОЗ, 2004 г. Bethesda, MD. Глобальное бремя болезней за 2001 год по регионам Всемирного банка, для использования в приоритетах борьбы с болезнями в развивающихся странах, Национальные институты здравоохранения: ВОЗ. Сделайте так, чтобы каждая мать и ребенок имели значение. Доклад о состоянии здравоохранения в мире, 2005 г., Женева: Всемирная организация здравоохранения.. . 2-е изд.
Сделайте так, чтобы каждая мать и ребенок имели значение. Доклад о состоянии здравоохранения в мире, 2005 г., Женева: Всемирная организация здравоохранения.. . 2-е изд.
Redman CW, Сарджент, Иллинойс. Последние достижения в понимании преэклампсии. Наука . 2005 г., 10 июня. 308 (5728): 1592-4. [Ссылка QxMD MEDLINE].
Чжоу Ю., Дамский Ч., Фишер С.Дж. Преэклампсия связана с неспособностью цитотрофобластов человека имитировать фенотип сосудистых спаек. Одна из причин дефектной эндоваскулярной инвазии при этом синдроме? Дж Клин Инвест . 1997 г., 1 мая. 99(9):2152-64. [Ссылка QxMD MEDLINE].[Полный текст].
Чжоу Ю., Дамский Ч., Фишер С.Дж. Преэклампсия связана с неспособностью цитотрофобластов человека имитировать фенотип сосудистых спаек. Одна из причин дефектной эндоваскулярной инвазии при этом синдроме? Дж Клин Инвест .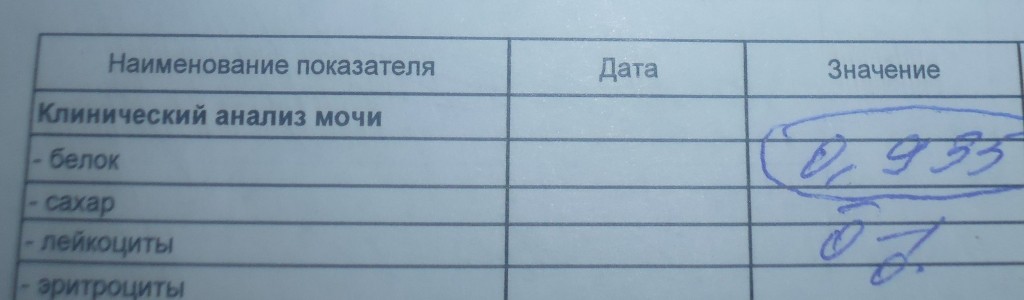 1997 г., 1 мая. 99(9):2152-64. [Ссылка QxMD MEDLINE].
1997 г., 1 мая. 99(9):2152-64. [Ссылка QxMD MEDLINE].
Zhou Y, Damsky CH, Chiu K, et al. Преэклампсия связана с аномальной экспрессией молекул адгезии инвазивными цитотрофобластами. Дж Клин Инвест .1993, март 91(3):950-60. [Ссылка QxMD MEDLINE].
Лим К.Х., Чжоу Ю., Джанатпур М. и др. Дифференцировка/инвазия цитотрофобласта человека ненормальна при преэклампсии. Ам Дж. Патол . 1997 г., декабрь 151 (6): 1809-18. [Ссылка QxMD MEDLINE].
Friedman SA, Schiff E, Emeis JJ, et al. Биохимическое подтверждение поражения эндотелия при тяжелой преэклампсии. Am J Obstet Gynecol . 1995, янв. 172 (1 часть 1): 202-3. [Ссылка QxMD MEDLINE].
Тейлор Р.Н., Гримвуд Дж., Тейлор Р.С. и др. Продольные концентрации плацентарного фактора роста в сыворотке: свидетельство аномального плацентарного ангиогенеза при патологической беременности.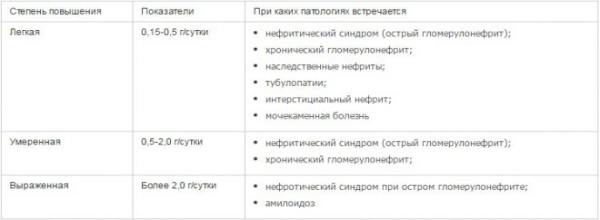 Am J Obstet Gynecol . 2003 янв. 188(1):177-82. [Ссылка QxMD MEDLINE].
Am J Obstet Gynecol . 2003 янв. 188(1):177-82. [Ссылка QxMD MEDLINE].
Maynard SE, Min JY, Merchan J, et al. Избыток плацентарной растворимой fms-подобной тирозинкиназы 1 (sFlt1) может способствовать дисфункции эндотелия, гипертонии и протеинурии при преэклампсии. Дж Клин Инвест . 2003 март 111(5):649-58. [Ссылка QxMD MEDLINE].
Levine RJ, Maynard SE, Qian C, et al. Циркулирующие ангиогенные факторы и риск преэклампсии. N Английский J Med . 2004 г., 12 февраля. 350(7):672-83. [Ссылка QxMD MEDLINE].
Тадхани Р., Муттер В.П., Вольф М. и др. Плацентарный фактор роста первого триместра и растворимая fms-подобная тирозинкиназа 1 и риск преэклампсии. J Clin Endocrinol Metab .2004 г., февраль 89(2):770-5. [Ссылка QxMD MEDLINE].
Levine RJ, Lam C, Qian C, et al. Растворимый эндоглин и другие циркулирующие антиангиогенные факторы при преэклампсии. N Английский J Med . 2006 г., 7 сентября. 355(10):992-1005. [Ссылка QxMD MEDLINE].
Венкатеша С., Топорсян М., Лам С. и др. Растворимый эндоглин способствует патогенезу преэклампсии. Nat Med . 2006 12 июня (6): 642-9. [Ссылка QxMD MEDLINE].
Germain SJ, Sacks GP, Sooranna SR и др. Системное воспалительное праймирование при нормальной беременности и преэклампсии: роль циркулирующих микрочастиц синцитиотрофобласта. Дж Иммунол . 2007 1 мая. 178(9):5949-56. [Ссылка QxMD MEDLINE].
[Ссылка QxMD MEDLINE].
Ликке Дж.А., Пайдас М.Дж., Лангхофф-Роос Дж.Повторяющиеся осложнения при второй беременности. Акушерство Гинекол . 2009 июнь 113(6):1217-24. [Ссылка QxMD MEDLINE].
Sweeting AN, Ross GP, Hyett J, et al. Гестационный сахарный диабет на ранних сроках беременности: доказательства неблагоприятных исходов беременности, несмотря на лечение. Лечение диабета . 2016 39 января (1): 75-81. [Ссылка QxMD MEDLINE].
Conde-Agudelo A, Villar J, Lindheimer M. Материнская инфекция и риск преэклампсии: систематический обзор и метаанализ. Am J Obstet Gynecol . 2008 янв. 198(1):7-22. [Ссылка QxMD MEDLINE].
Шанд А., Нассар Н., Фон Дадельсен П., Иннис С., Грин Т. Статус витамина D у матери во время беременности и неблагоприятные исходы беременности в группе высокого риска преэклампсии. БЖОГ . 2010 Декабрь 117 (13): 1593-8. [Ссылка QxMD MEDLINE].
БЖОГ . 2010 Декабрь 117 (13): 1593-8. [Ссылка QxMD MEDLINE].
Knight M, Kurinczuk JJ, Spark P, Brocklehurst P. Экстремальное ожирение во время беременности в Соединенном Королевстве. Акушерство Гинекол .2010 май. 115(5):989-97. [Ссылка QxMD MEDLINE].
Фокс С. Преэклампсия с ранним и поздним началом: 2 разных состояния?. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/810245. Доступ: 6 сентября 2013 г.
Лисонкова С., Иосиф К.С. Заболеваемость преэклампсией: факторы риска и исходы, связанные с ранним и поздним началом заболевания. Am J Obstet Gynecol . 22 августа 2013 г. [Ссылка на MEDLINE QxMD].
Курей С.Д., Эдмондс С.М., Тонг С., Самарасекера С.П., Уайтхед С.Л.Характеристика симптомов, непосредственно предшествующих эклампсии. Акушерство Гинекол . 2011 ноябрь 118 (5): 995-9. [Ссылка QxMD MEDLINE].
Акушерство Гинекол . 2011 ноябрь 118 (5): 995-9. [Ссылка QxMD MEDLINE].
Андрус С.С., Вольфсон А.Б. Послеродовая преэклампсия, возникающая после разрешения дородовой преэклампсии. J Emerg Med . 2010 38 февраля (2): 168-70. [Ссылка QxMD MEDLINE].
Сибай БМ. Диагностика, противоречия и лечение синдрома гемолиза, повышенных ферментов печени и низкого количества тромбоцитов. Акушерство Гинекол . 2004 май. 103 (5 часть 1): 981-91. [Ссылка QxMD MEDLINE].
Waugh JJ, Clark TJ, Divakaran TG, et al. Точность методов анализа мочи в прогнозировании значительной протеинурии во время беременности. Акушерство Гинекол . 2004 г., апрель 103 (4): 769-77. [Ссылка QxMD MEDLINE].
Durnwald C, Mercer B. Проспективное сравнение соотношения общего белка и креатинина с содержанием белка в моче за 24 часа у женщин с подозрением на преэклампсию.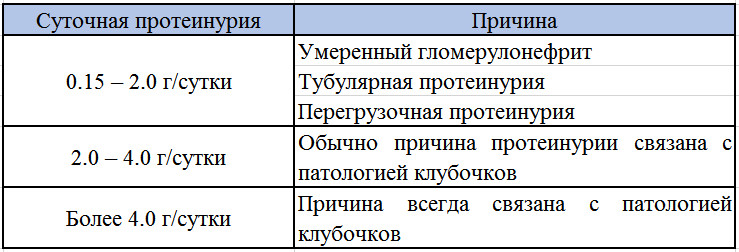 Am J Obstet Gynecol . 2003 г., сентябрь 189(3):848-52. [Ссылка QxMD MEDLINE].
Am J Obstet Gynecol . 2003 г., сентябрь 189(3):848-52. [Ссылка QxMD MEDLINE].
Чесли Л.С. Гипертоническая болезнь беременных . Нью-Йорк: Appleton-Century-Crofts; 1978. стр. 421-43.
Фишер К.А., Люгер А., Спарго Б.Х. и др. Артериальная гипертензия при беременности: клинико-патологические корреляции и отдаленный прогноз. Медицина (Балтимор) . 1981 г., июль 60(4):267-76. [Ссылка QxMD MEDLINE].
Ларсон, Н.Ф.Анализ мочи Congo Red Dot может предсказать и диагностировать преэклампсию. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/716741?src=rss\t_blank.
Baweja S, Kent A, Masterson R, Roberts S, McMahon L. Прогнозирование преэклампсии на ранних сроках беременности путем оценки соотношения альбумина и креатинина в моче с использованием высокоэффективной жидкостной хроматографии. БЖОГ . 2011 авг. 118(9):1126-32. [Ссылка QxMD MEDLINE].
БЖОГ . 2011 авг. 118(9):1126-32. [Ссылка QxMD MEDLINE].
Рука Л.Анализ мочи на неправильно свернутые белки может диагностировать преэклампсию. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/828545. Доступ: 28 июля 2014 г.
Buhimschi IA, Nayeri UA, Zhao G, Shook LL, Pensalfini A, Funai EF, et al. Неправильный фолдинг белков, конгофилия, олигомеризация и дефектный процессинг амилоида при преэклампсии. Sci Transl Med . 2014 16 июля. 6(245):245ra92. [Ссылка QxMD MEDLINE].
Chappell LC, Duckworth S, Seed PT, Griffin M, Myers J, Mackillop L, et al.Диагностическая точность плацентарного фактора роста у женщин с подозрением на преэклампсию: проспективное многоцентровое исследование. Тираж . 2013 5 ноября. 128(19):2121-31. [Ссылка QxMD MEDLINE].
MacReady N. На шаг ближе к прогнозированию риска преэклампсии при диабете.Доступно на http://www.medscape.com/viewarticle/809509. Доступ: 20 августа 2013 г.
Холмс В.А., Янг И.С., Паттерсон С.С., Мареш М.Дж., Пирсон Д.В., Уокер Д.Д. и др. Роль ангиогенных и антиангиогенных факторов во втором триместре в прогнозировании преэклампсии у беременных с сахарным диабетом 1 типа. Лечение диабета . 6 августа 2013 г. [Ссылка на MEDLINE QxMD].
Zeisler H, Llurba E, Chantraine F, et al. Прогностическое значение соотношения sFlt-1:PlGF у женщин с подозрением на преэклампсию. N Английский J Med . 2016 7 января. 374 (1): 13-22. [Ссылка QxMD MEDLINE].
374 (1): 13-22. [Ссылка QxMD MEDLINE].
Кейн СК, Деннис АТ. Допплеровская оценка маточного кровотока при преэклампсии: обзор. Гипертония Беременность . 2015 34 ноября (4): 400-421. [Ссылка QxMD MEDLINE].
Вагнер Л.К. Диагностика и лечение преэклампсии. Семейный врач . 2004 15 декабря. 70(12):2317-24. [Ссылка QxMD MEDLINE].
Бартон Дж.Р., Витлин А.Г., Сибай Б.М.Лечение легкой преэклампсии. Клин Акушерство Гинекол . 1999 сен. 42(3):455-69. [Ссылка QxMD MEDLINE].
Hauth JC, Ewell MG, Levine RJ, et al. Исходы беременности у здоровых нерожавших, у которых развилась артериальная гипертензия. Кальций для Исследовательской группы по профилактике преэклампсии. Акушерство Гинекол . 2000 янв. 95(1):24-8. [Ссылка QxMD MEDLINE].
Бухбиндер А., Сибай Б.М., Каритис С. и др. Неблагоприятные перинатальные исходы значительно выше при тяжелой гестационной гипертензии, чем при легкой преэклампсии. Am J Obstet Gynecol . 2002 г., янв. 186(1):66-71. [Ссылка QxMD MEDLINE].
Сибай Б.М., Бартон Дж.Р. Выжидательная тактика тяжелой преэклампсии в отдаленном периоде: отбор пациенток, лечение и показания к родоразрешению. Am J Obstet Gynecol . 2007 июнь 196(6):514.e1-9. [Ссылка QxMD MEDLINE].
Заключение Комитета № 652: применение сульфата магния в акушерстве. Акушерство Гинекол . 2016 янв. 127 (1): e52-3. [Ссылка QxMD MEDLINE].
Какое противосудорожное средство для женщин с эклампсией? Данные совместного исследования эклампсии. Ланцет . 1995, 10 июня. 345(8963):1455-63. [Ссылка QxMD MEDLINE].
345(8963):1455-63. [Ссылка QxMD MEDLINE].
Витлин А.Г., Сибай Б.М. Терапия сульфатом магния при преэклампсии и эклампсии. Акушерство Гинекол . 1998 ноябрь 92(5):883-9. [Ссылка QxMD MEDLINE].
Маги Л.А., Чам С., Уотерман Э.Дж. и др. Гидралазин для лечения тяжелой артериальной гипертензии у беременных: метаанализ. БМЖ . 2003 г., 25 октября. 327(7421):955-60. [Ссылка QxMD MEDLINE].
Клири К.Л., Сиддик З., Анант К.В., Райт Д.Д., Ту Г., Д’Алтон М.Е. и др. Применение антигипертензивных препаратов при госпитализации родов, осложненной преэклампсией. Акушерство Гинекол . 5 февраля 2018 г. [Ссылка QxMD MEDLINE].
Наден Р.П., Редман CW. Антигипертензивные препараты при беременности. Клин Перинатол . 1985 12 октября (3): 521-38. [Ссылка QxMD MEDLINE].
[Ссылка QxMD MEDLINE].
Creasy RK, Resnik R, Iams JD. Медицина матери и плода: принципы и практика . 5-е изд. 2004. 859-899.
Martin JN Jr, Perry KG Jr, Blake PG, et al. Лучшие материнские исходы достигаются при терапии дексаметазоном послеродового синдрома HELLP (гемолиз, повышенный уровень печеночных ферментов и тромбоцитопения). Am J Obstet Gynecol . 1997 ноябрь 177(5):1011-7. [Ссылка QxMD MEDLINE].
Martin JN Jr, Thigpen BD, Rose CH, et al.Польза для матери высоких доз внутривенной терапии кортикостероидами при синдроме HELLP. Am J Obstet Gynecol . 2003 г., сентябрь 189(3):830-4. [Ссылка QxMD MEDLINE].
Аль-Сафи З., Имудиа А.Н., Филетти Л.С. и др. Отсроченная послеродовая преэклампсия и эклампсия: демография, клиническое течение и осложнения. Акушерство Гинекол . 2011 ноябрь 118(5):1102-7. [Ссылка QxMD MEDLINE].
Акушерство Гинекол . 2011 ноябрь 118(5):1102-7. [Ссылка QxMD MEDLINE].
Янси Л.М., Уизерс Э., Бейкс К., Эбботт Дж. Послеродовая преэклампсия: представление и лечение в отделении неотложной помощи. J Emerg Med . 2008 Сентябрь 22. [Ссылка на MEDLINE QxMD].
Сибай БМ. Профилактика преэклампсии: большое разочарование. Am J Obstet Gynecol . 1998 ноябрь 179(5):1275-8. [Ссылка QxMD MEDLINE].
Кумарасами А., Честный Х., Папайоанну С. и др. Аспирин для профилактики преэклампсии у женщин с историческими факторами риска: систематический обзор. Акушерство Гинекол . 2003 июнь 101(6):1319-32. [Ссылка QxMD MEDLINE].
Сибай Б.М., Каритис С.Н., Том Э. и др.Профилактика преэклампсии с помощью низких доз аспирина у здоровых нерожавших беременных женщин.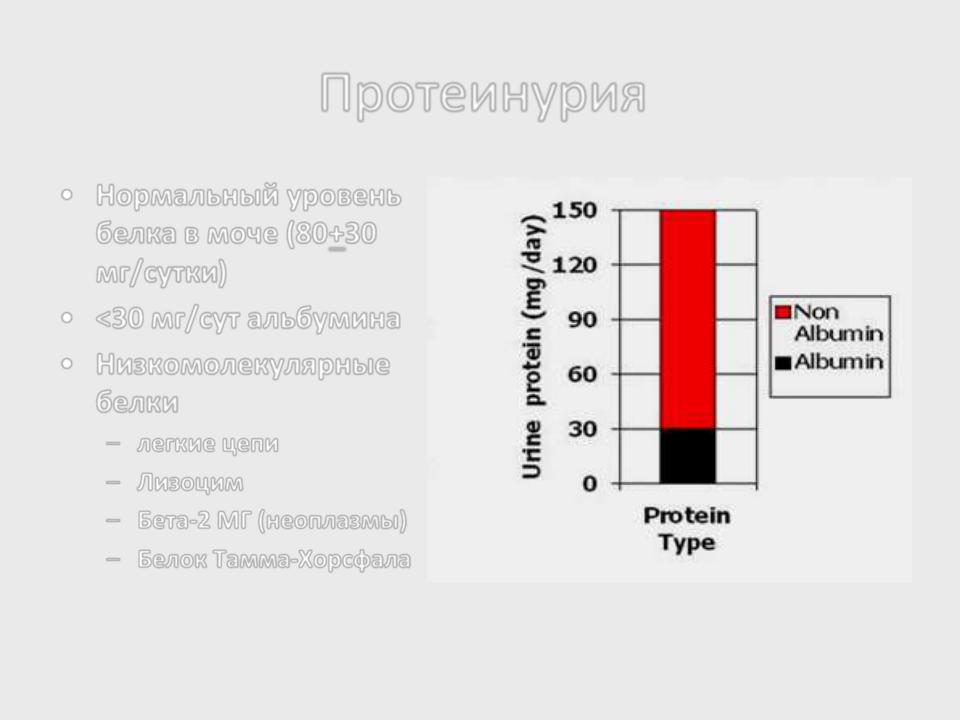 Сеть отделений медицины матери и плода Национального института детского здоровья и человеческого развития. N Английский J Med . 1993, 21 октября. 329(17):1213-8. [Ссылка QxMD MEDLINE].
Сеть отделений медицины матери и плода Национального института детского здоровья и человеческого развития. N Английский J Med . 1993, 21 октября. 329(17):1213-8. [Ссылка QxMD MEDLINE].
Козер Э., Костей А.М., Боскович Р. и др. Влияние потребления аспирина во время беременности на исходы беременности: метаанализ. Врожденные дефекты Res B Dev Reprod Toxicol . 2003 фев. 68(1):70-84.[Ссылка QxMD MEDLINE].
Roberge S, Demers S, Nicolaides KH, Bureau M, Cote S, Bujold E. Профилактика преэклампсии низкомолекулярным гепарином в дополнение к аспирину: метаанализ. Ультразвуковой акушер Gynecol . 20 октября 2015 г. [Ссылка QxMD MEDLINE].
Практическое руководство по низким дозам аспирина и профилактике преэклампсии: обновленные рекомендации. АКОГ. Доступно по адресу http://www.acog. org/About-ACOG/News-Room/Practice-Advisories/Practice-Advisory-Low-Dose-Aspirin-and-Prevention-of-Preeclampsia-Updated-Recommendations.11 июля 2016 г.; Доступ: 2 августа 2016 г.
org/About-ACOG/News-Room/Practice-Advisories/Practice-Advisory-Low-Dose-Aspirin-and-Prevention-of-Preeclampsia-Updated-Recommendations.11 июля 2016 г.; Доступ: 2 августа 2016 г.
Вильяр Дж., Абдель-Алим Х., Мериальди М. и др. Рандомизированное исследование Всемирной организации здравоохранения по применению добавок кальция среди беременных женщин с низким потреблением кальция. Am J Obstet Gynecol . 2006 март 194(3):639-49. [Ссылка QxMD MEDLINE].
Рольник Д.Л., Райт Д., Пун Л.С., О’Горман Н., Сингелаки А., де Пако Маталлана С. и др. Аспирин по сравнению с плацебо при беременности с высоким риском преждевременной преэклампсии. N Английский J Med . 2017 17 августа. 377 (7): 613-622. [Ссылка QxMD MEDLINE].
Постон Л., Брайли А.Л., Сид П.Т. и др. Витамин С и витамин Е у беременных женщин с риском преэклампсии (испытание VIP): рандомизированное плацебо-контролируемое исследование. Ланцет . 8 апреля 2006 г. 367 (9517): 1145-54. [Ссылка QxMD MEDLINE].
Ланцет . 8 апреля 2006 г. 367 (9517): 1145-54. [Ссылка QxMD MEDLINE].
Rumbold AR, Crowther CA, Haslam RR, et al. Витамины С и Е и риски преэклампсии и перинатальных осложнений. N Английский J Med .2006 г., 27 апреля. 354(17):1796-806. [Ссылка QxMD MEDLINE].
Вильяр Дж., Пурвар М., Мериальди М., Завалета Н., Тхи Нху Нгок Н., Энтони Дж. и др. Многоцентровое рандомизированное исследование Всемирной организации здравоохранения по добавкам витаминов С и Е среди беременных женщин с высоким риском преэклампсии среди населения с низким статусом питания из развивающихся стран. БЖОГ . 2009 май. 116(6):780-8. [Ссылка QxMD MEDLINE].
Вадильо-Ортега Ф., Перичарт-Перера О., Эспино С. и др.Влияние добавок во время беременности с L-аргинином и витаминами-антиоксидантами в лечебной пище на преэклампсию в группе высокого риска: рандомизированное контролируемое исследование. БМЖ . 2011 19 мая. 342:d2901. [Ссылка QxMD MEDLINE]. [Полный текст].
БМЖ . 2011 19 мая. 342:d2901. [Ссылка QxMD MEDLINE]. [Полный текст].
Brantæter AL, Myhre R, Haugen M, et al. Потребление пробиотической пищи и риск преэклампсии у первородящих женщин: норвежское когортное исследование матери и ребенка. Am J Эпидемиол . 2011 1 октября. 174(7):807-15. [Ссылка QxMD MEDLINE].
Фридман С.А., Любарский С.Л., Лим К.Х. Легкая гестационная гипертензия и преэклампсия. При гипертонических расстройствах у женщин. Сибай Б.М., изд. Гипертензивные расстройства у женщин . Филадельфия: WB Сондерс; 2001. 9-23.
Millar JGB, Campbell SK, Albano JDM и др. Раннее прогнозирование преэклампсии путем измерения калликреина и креатинина в случайном образце мочи. Br J Obstet Gynaecol . 1996. 103:421-426.
Брукс М. Преэклампсия связана с аутизмом, задержкой развития. Медицинские новости Medscape . 12 декабря 2014 г. [Полный текст].
Целевая группа профилактических служб США, Bibbins-Domingo K, Grossman DC, Curry SJ, Barry MJ, Davidson KW, et al.Скрининг на преэклампсию: Заявление о рекомендациях Целевой группы профилактических служб США. ЯМА . 2017 25 апреля. 317 (16): 1661-1667. [Ссылка QxMD MEDLINE].
Уокер К.К., Краковяк П., Бейкер А., Хансен Р.Л., Озонофф С., Герц-Пиччиотто И. Преэклампсия, плацентарная недостаточность и расстройство аутистического спектра или задержка развития. JAMA Pediatr . 2015 фев. 169(2):154-62. [Ссылка QxMD MEDLINE].
JAMA Pediatr . 2015 фев. 169(2):154-62. [Ссылка QxMD MEDLINE].
Sullivan CA, Magann EF, Perry KG Jr, et al.Риск рецидива синдрома гемолиза, повышенных ферментов печени и низких тромбоцитов (HELLP) при последующих гестациях. Am J Obstet Gynecol . 1994 г., октябрь 171 (4): 940-3. [Ссылка QxMD MEDLINE].
Сибай Б.М., Рамадан М.К., Чари Р.С. и др. Беременности, осложненные HELLP-синдромом (гемолиз, повышение активности печеночных ферментов и низкий уровень тромбоцитов): последующий исход беременности и отдаленный прогноз. Am J Obstet Gynecol . 1995 г., янв. 172 (1 часть 1): 125-9. [Ссылка QxMD MEDLINE].
Chames MC, Haddad B, Barton JR, et al. Последующий исход беременности у женщин с HELLP-синдромом в анамнезе на сроке < или = 28 недель беременности. Am J Obstet Gynecol .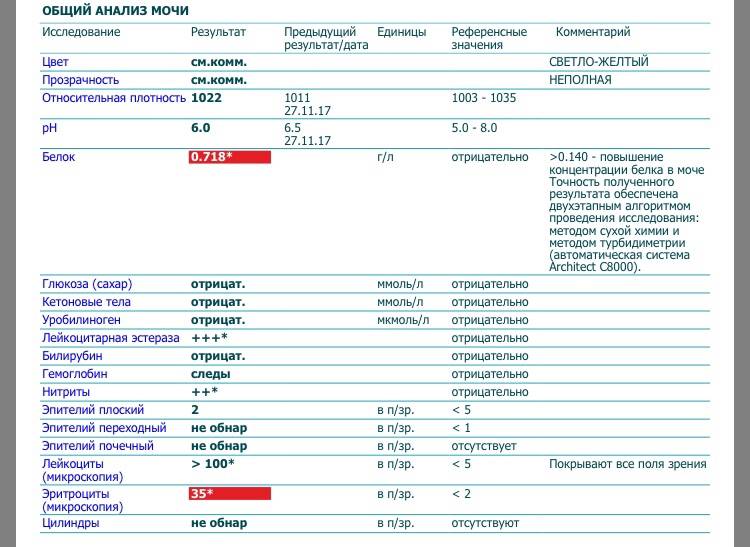 2003 г., июнь 188(6):1504-7; обсуждение 1507-8. [Ссылка QxMD MEDLINE].
2003 г., июнь 188(6):1504-7; обсуждение 1507-8. [Ссылка QxMD MEDLINE].
Сибай Б.М., Сариноглу С., Мерсер Б.М. Эклампсия. VII. Исход беременности после эклампсии и отдаленный прогноз. Am J Obstet Gynecol . 1992 июнь 166 (6 часть 1): 1757-61; обсуждение 1761-3.[Ссылка QxMD MEDLINE].
Лопес-Ллера М., Эрнандес Орта Х.Л. Беременность после эклампсии. Am J Obstet Gynecol . 1974 г., 15 мая. 119(2):193-8. [Ссылка QxMD MEDLINE].
Аделуси Б., Одженгбеде О.А. Репродуктивная функция после эклампсии. Int J Gynaecol Obstet . 1986 июнь 24 (3): 183-9. [Ссылка QxMD MEDLINE].
Сибай Б.М., Мерсер Б., Сариноглу С. Тяжелая преэклампсия во втором триместре: риск рецидива и долгосрочный прогноз. Am J Obstet Gynecol . 1991 ноябрь 165 (5 часть 1): 1408-12.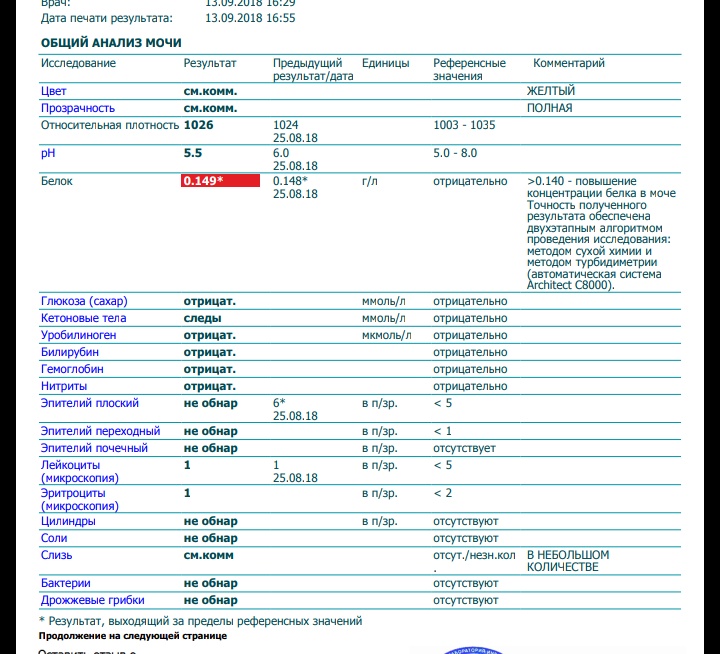 [Ссылка QxMD MEDLINE].
[Ссылка QxMD MEDLINE].
von Dadelszen P, Payne B, Li J, Ansermino JM, Broughton Pipkin F, Côté AM, et al. Прогнозирование неблагоприятных материнских исходов при преэклампсии: разработка и проверка модели fullPIERS. Ланцет . 2011 15 января. 377(9761):219-27. [Ссылка QxMD MEDLINE].
Block-Abraham DM, Turan OM, Doyle LE, et al. Факторы риска развития преэклампсии в первом триместре у женщин, начавших прием аспирина до 16 недель беременности. Акушерство Гинекол . 7 февраля 2014 г. [Ссылка на MEDLINE QxMD].
Сибай БМ. Диагностика, профилактика и лечение эклампсии. Акушерство Гинекол . 2005 фев. 105(2):402-10. [Ссылка QxMD MEDLINE].
Garcia J. Более высокое АД в первом триместре может увеличить риск преэклампсии. Медицинские новости Medscape . 10 февраля 2014 г. [Полный текст].
10 февраля 2014 г. [Полный текст].
Мостелло Д., Джен Чанг Дж., Аллен Дж., Люэр Л., Шайкен Дж., Лит Т.Рецидивирующая преэклампсия: влияние изменения веса между беременностями. Акушерство Гинекол . 2010 сен. 116(3):667-72. [Ссылка QxMD MEDLINE].
Сибай БМ. Профилактика сульфатом магния при преэклампсии: уроки, извлеченные из недавних испытаний. Am J Obstet Gynecol . 2004 г., июнь 190(6):1520-6. [Ссылка QxMD MEDLINE].
[Рекомендации] Tuffnell DJ, Shennan AH, Waugh JJ, Walker JJ. Королевский колледж акушеров и гинекологов.Лечение тяжелой преэклампсии/эклампсии. 2006. [Полный текст].
Окусанья Б.О., Оладапо О.Т., Лонг К. и др. Клинические фармакокинетические свойства сульфата магния у женщин с преэклампсией и эклампсией: систематический обзор. БЖОГ . 2015 24 ноября. [Ссылка на MEDLINE QxMD].
БЖОГ . 2015 24 ноября. [Ссылка на MEDLINE QxMD].
Нанди П., Сиддики М.Ф., Лала П.К. Сдерживание инвазии трофобласта в матку декорином: роль в развитии преэклампсии. Am J Reprod Immunol .2015 11 ноября. [Ссылка QxMD MEDLINE].
Kandasamy Y, Watson D, Rudd D. Биомаркер раннего гломерулярного повреждения при преэклампсии. Гипертония Беременность . 2015 34 ноября (4): 391-9. [Ссылка QxMD MEDLINE].
Vaught AJ, Kovell LC, Szymanski LM, Mayer SA, Seifert SM, Vaidya D, et al. Острые кардиальные эффекты тяжелой преэклампсии. J Am Coll Cardiol . 2018 3 июля. 72 (1): 1-11. [Ссылка QxMD MEDLINE].
Райт Д., Рольник Д.Л., Сингелаки А., де Пако Маталлана С., Мачука М., де Альварадо М. и др.Испытание аспирина для доказательной профилактики преэклампсии: влияние аспирина на продолжительность пребывания в отделении интенсивной терапии новорожденных. Am J Obstet Gynecol . 2018 июнь 218 (6):612.e1-612.e6. [Ссылка QxMD MEDLINE].
Am J Obstet Gynecol . 2018 июнь 218 (6):612.e1-612.e6. [Ссылка QxMD MEDLINE].
Сотириадис А., Эрнандес-Андраде Э., да Силва Коста Ф., Ги Т., Гланк П., Халил А. и др. Практические рекомендации ISUOG: роль УЗИ в скрининге и последующем наблюдении за преэклампсией. Ультразвуковой акушер Gynecol . 2018 октября 15. [Ссылка QxMD MEDLINE].
Патофизиология клинических проявлений преэклампсии
От 5 до 7% всех беременностей осложняются преэклампсией. В клинической картине преобладают протеинурия и артериальная гипертензия, поскольку основным органом-мишенью являются почки (гломерулярный эндотелиоз). Патогенез преэклампсии сложен; взаимодействуют многочисленные генетические, иммунологические факторы и факторы окружающей среды. Было высказано предположение, что преэклампсия является двухстадийным заболеванием (1). Первая стадия протекает бессимптомно и характеризуется аномальным развитием плаценты в течение первого триместра, что приводит к плацентарной недостаточности и выбросу избыточного количества плацентарного материала в кровоток матери.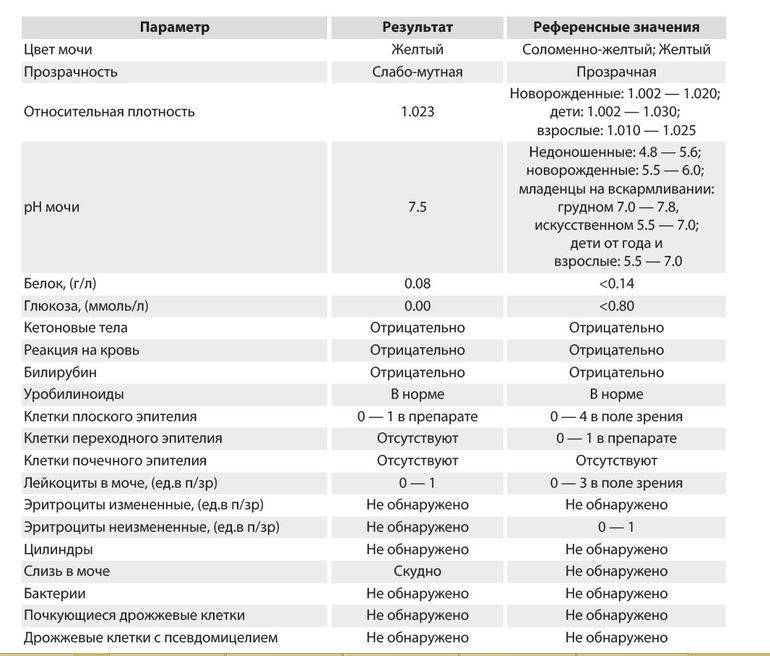 Это, в свою очередь, приводит ко второй, симптоматической стадии, когда у беременной женщины развиваются характерная гипертензия, почечная недостаточность и протеинурия, а также существует риск развития HELLP-синдрома (гемолиз, повышение активности ферментов печени и низкий уровень тромбоцитов), эклампсии и других побочных эффектов. поражение органов. В этом обзоре основное внимание уделяется патофизиологии стадий 1 и 2, а затем рассматривается возможность того, что изменения в растворимых ангиогенных факторах могут лежать в основе большей части патологического процесса.
Это, в свою очередь, приводит ко второй, симптоматической стадии, когда у беременной женщины развиваются характерная гипертензия, почечная недостаточность и протеинурия, а также существует риск развития HELLP-синдрома (гемолиз, повышение активности ферментов печени и низкий уровень тромбоцитов), эклампсии и других побочных эффектов. поражение органов. В этом обзоре основное внимание уделяется патофизиологии стадий 1 и 2, а затем рассматривается возможность того, что изменения в растворимых ангиогенных факторах могут лежать в основе большей части патологического процесса.
Аномалии плацентации (стадия I)
На основании наблюдения, что единственным окончательным лекарством от преэклампсии является рождение плаценты, и что у женщин с пузырным заносом, при котором плацента развивается без плода, часто развивается тяжелая преэклампсия , разумно предположить, что плацента играет центральную роль в патогенезе заболевания.Патологическое исследование плацент при преэклампсии обычно выявляет плацентарные инфаркты и склеротические сужения артерий и артериол с характерной сниженной эндоваскулярной инвазией цитотрофобластами и неадекватным ремоделированием спиральных артериол матки (2). Хотя грубые патологические изменения не всегда наблюдаются в плацентах женщин с преэклампсией, плацентарные профили, включая аномальную допплерографию маточных артерий и морфологию плаценты, использовались для выявления подмножества из когорты женщин с высоким риском, у которых развивается синдром (3). ).Допплеровское исследование маточных артерий с оценкой индекса пульсации (PI) выявляет повышенное сосудистое сопротивление матки задолго до появления клинических признаков и симптомов (4,5). Кроме того, механическое сужение маточных артерий вызывает гипертензию, протеинурию и, у некоторых видов, гломерулярный эндотелиоз, подтверждая причинную роль плацентарной ишемии в патогенезе преэклампсии (6).
Хотя грубые патологические изменения не всегда наблюдаются в плацентах женщин с преэклампсией, плацентарные профили, включая аномальную допплерографию маточных артерий и морфологию плаценты, использовались для выявления подмножества из когорты женщин с высоким риском, у которых развивается синдром (3). ).Допплеровское исследование маточных артерий с оценкой индекса пульсации (PI) выявляет повышенное сосудистое сопротивление матки задолго до появления клинических признаков и симптомов (4,5). Кроме того, механическое сужение маточных артерий вызывает гипертензию, протеинурию и, у некоторых видов, гломерулярный эндотелиоз, подтверждая причинную роль плацентарной ишемии в патогенезе преэклампсии (6).
Плацентация млекопитающих требует интенсивного ангиогенеза для создания подходящей сети для снабжения плода кислородом и питательными веществами.Различные про- и антиангиогенные факторы вырабатываются развивающейся плацентой. Считается, что плацентарный ангиогенез нарушен при преэклампсии, о чем свидетельствует неспособность цитотрофобластов преобразоваться из более эпителиального в эндотелиальный фенотип, основываясь на исследованиях маркеров клеточной поверхности (6,7).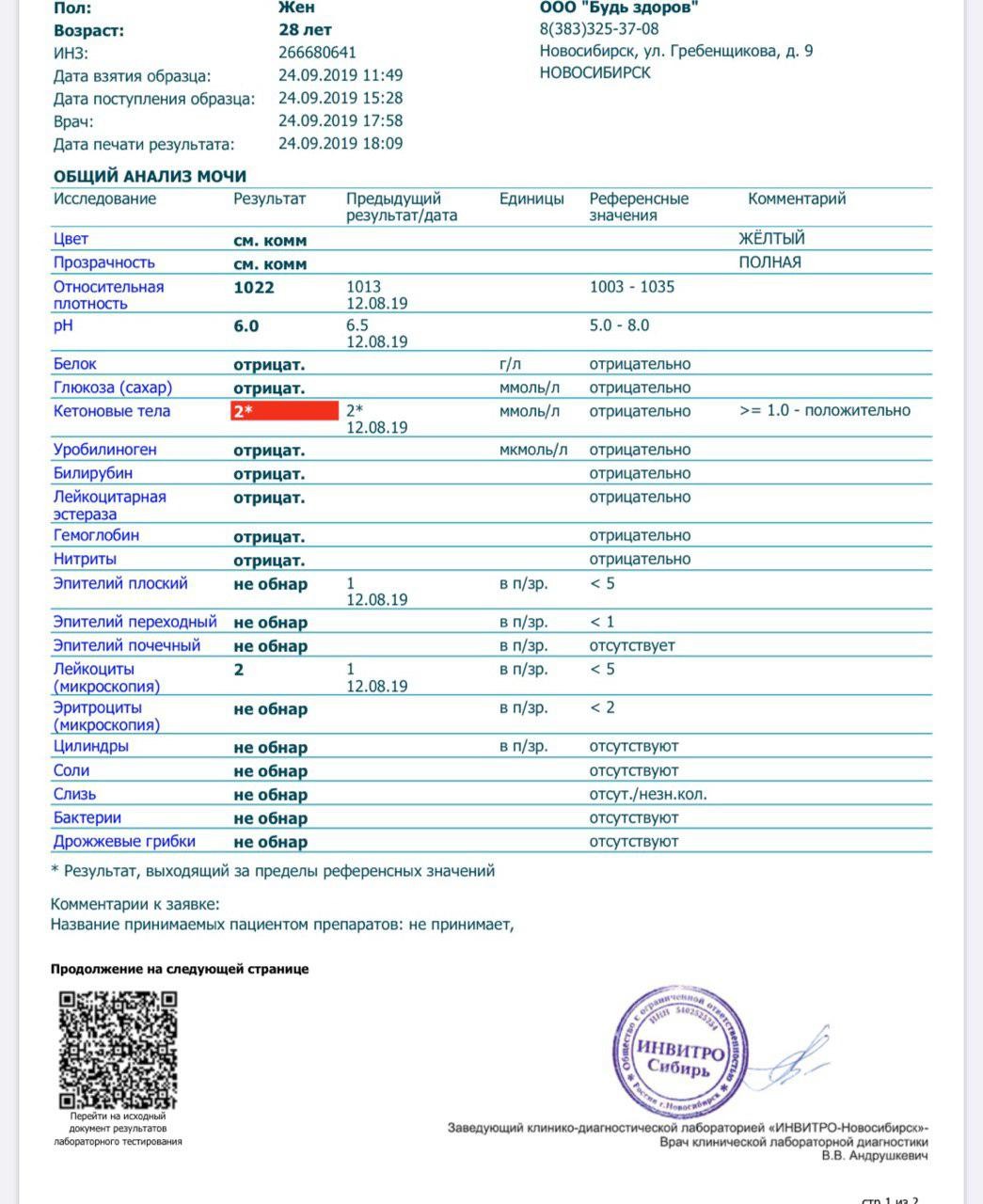 В норме инвазивные цитотрофобласты подавляют экспрессию молекул адгезии, характерную для их эпителиального происхождения, и приобретают фенотип клеточно-поверхностной адгезии, типичный для эндотелиальных клеток, процесс, называемый псевдоваскулогенезом (7,8).При преэклампсии клетки цитотрофобласта не подвергаются этому переключению интегринов клеточной поверхности и молекул адгезии (5). Эта аномальная дифференцировка цитотрофобласта является ранним дефектом, который в конечном итоге может привести к ишемии плаценты. Другие продемонстрировали, что индуцируемый гипоксией фактор-1 активируется при преэклампсии, и предполагают, что он и его гены-мишени могут играть центральную роль в аномальном дифференцировочном фенотипе преэклампсии (9,10). Остается неясным, является ли это отсутствие конверсии цитотрофобластов в эндотелиальный фенотип у женщин с преэклампсией первичным или вторичным событием (11).
В норме инвазивные цитотрофобласты подавляют экспрессию молекул адгезии, характерную для их эпителиального происхождения, и приобретают фенотип клеточно-поверхностной адгезии, типичный для эндотелиальных клеток, процесс, называемый псевдоваскулогенезом (7,8).При преэклампсии клетки цитотрофобласта не подвергаются этому переключению интегринов клеточной поверхности и молекул адгезии (5). Эта аномальная дифференцировка цитотрофобласта является ранним дефектом, который в конечном итоге может привести к ишемии плаценты. Другие продемонстрировали, что индуцируемый гипоксией фактор-1 активируется при преэклампсии, и предполагают, что он и его гены-мишени могут играть центральную роль в аномальном дифференцировочном фенотипе преэклампсии (9,10). Остается неясным, является ли это отсутствие конверсии цитотрофобластов в эндотелиальный фенотип у женщин с преэклампсией первичным или вторичным событием (11).
Материнский синдром (Стадия II)
Считается, что аномальная плацентация в результате недостаточности ремоделирования спиральных артериол матки трофобластом приводит к высвобождению секретируемых факторов, которые попадают в кровоток матери, что приводит к клиническим признакам и симптомам преэклампсии . Все клинические проявления преэклампсии могут быть связаны с гломерулярным эндотелиозом, повышенной проницаемостью сосудов и системной воспалительной реакцией, которая приводит к повреждению органов-мишеней и/или гипоперфузии.Эти клинические проявления обычно возникают после 20-й недели беременности.
Все клинические проявления преэклампсии могут быть связаны с гломерулярным эндотелиозом, повышенной проницаемостью сосудов и системной воспалительной реакцией, которая приводит к повреждению органов-мишеней и/или гипоперфузии.Эти клинические проявления обычно возникают после 20-й недели беременности.
Артериальная гипертензия
Аккомодация к нормально протекающей беременности включает снижение как систолического, так и диастолического АД в результате снижения системного сосудистого сопротивления, главным образом вторичного по отношению к вазодилатации. Релаксин, высвобождаемый яичниками под влиянием хорионического гонадотропина человека, активирует синтазу оксида азота (NOS) (12), фермент, генерирующий NO из аргинина, через эндотелиальный рецептор эндотелина B (13).Считается, что при преэклампсии нарушение эндотелиальных вазоактивных факторов приводит к преобладанию вазоконстрикторов (эндотелин, тромбоксан A 2 ) над сосудорасширяющими (NO, простациклин).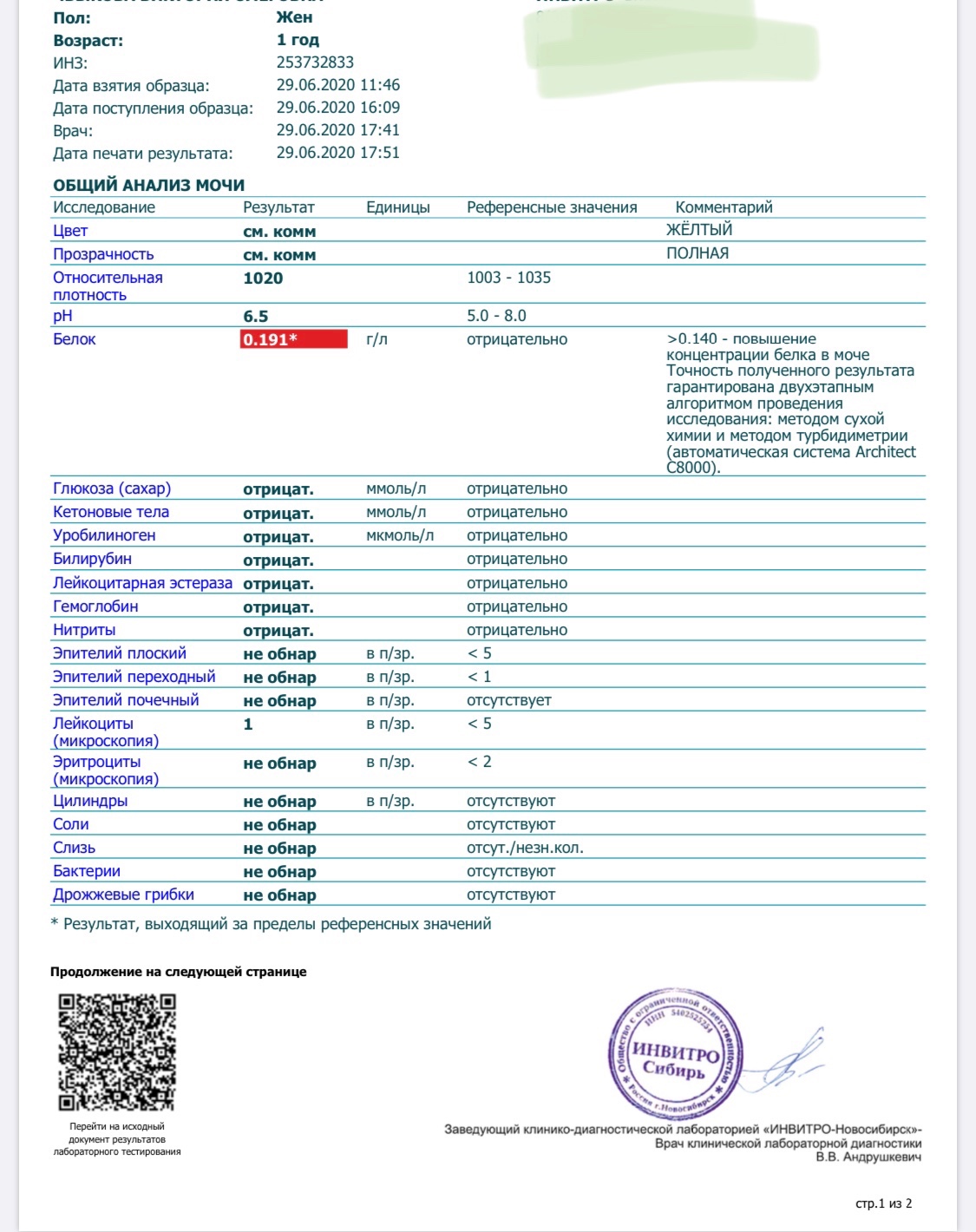 Артериальная гипертензия, определяемая как повторное измерение АД ≥140/90 мм рт.ст., возникает в результате аномальной вазоконстрикции.
Артериальная гипертензия, определяемая как повторное измерение АД ≥140/90 мм рт.ст., возникает в результате аномальной вазоконстрикции.
Нормальная беременность у крыс сопровождается повышенной продукцией NO и его вторичного мессенджера, циклического гуанозин-3’5′-монофосфата (14) с параллельным увеличением почечной экспрессии конститутивной NOS (12,15).Было показано, что у беременных крыс инфузия метилового эфира NG-нитро-1-аргинина (L-NAME), экзогенного ингибитора NOS, воспроизводит некоторые гемодинамические особенности преэклампсии (16). Добавка l-аргинина обращала вспять эти неблагоприятные эффекты L-NAME на беременность, ослабляя гипертензию, значительно уменьшая протеинурию и уменьшая долю поврежденных клубочков (17). Однако у людей данные, подтверждающие роль дефицита NO в патогенезе гипертонии при преэклампсии, противоречивы.Хотя повышенные уровни циркулирующего асимметричного диметиларгинина, эндогенного ингибитора NOS, постоянно обнаруживаются при беременностях, осложненных преэклампсией, концентрации в плазме, как правило, очень низкие с узким распределением среди здоровых взрослых, что делает количественную оценку чрезвычайно сложной, а клиническую значимость неуверенности в выводах (18–20).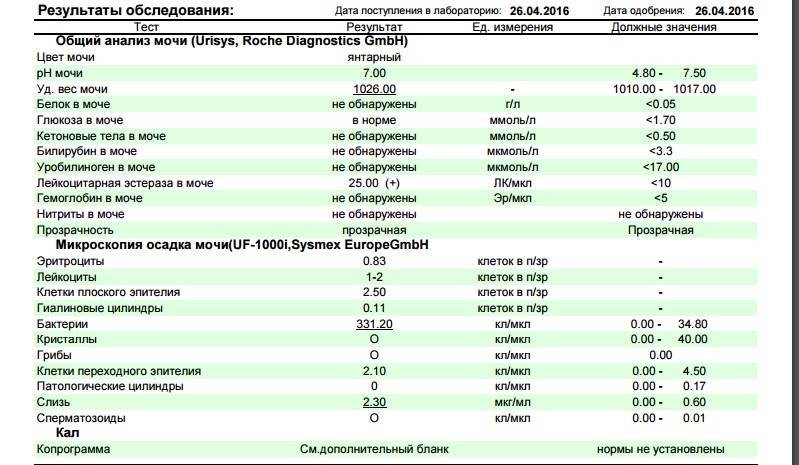 Кроме того, добавки L-аргинина не принесли значительной пользы женщинам с беременностью, осложненной преэклампсией (21, 22).
Кроме того, добавки L-аргинина не принесли значительной пользы женщинам с беременностью, осложненной преэклампсией (21, 22).
Другая гипотеза рассматривала возможность того, что раннее гестационное преувеличение нормальной аккомодации к беременности может быть использовано для выявления и может быть патогенным при преэклампсии (23). Продольное исследование, в котором использовалась допплер-эхокардиография у 400 первородящих на протяжении всей беременности, выявило значительное увеличение сердечного выброса без каких-либо различий в периферическом сосудистом сопротивлении у 24 женщин, у которых в конечном итоге развилась преэклампсия, по сравнению со здоровыми женщинами из контрольной группы (24).Это увеличение сердечного выброса сопровождалось заметным снижением сердечного выброса и повышением периферического сосудистого сопротивления с началом клинического синдрома. Это представление о пересечении гемодинамического профиля у женщин, у которых развилась преэклампсия, привело к нескольким исследованиям, в которых β-блокаторы применялись в профилактических целях (25–27).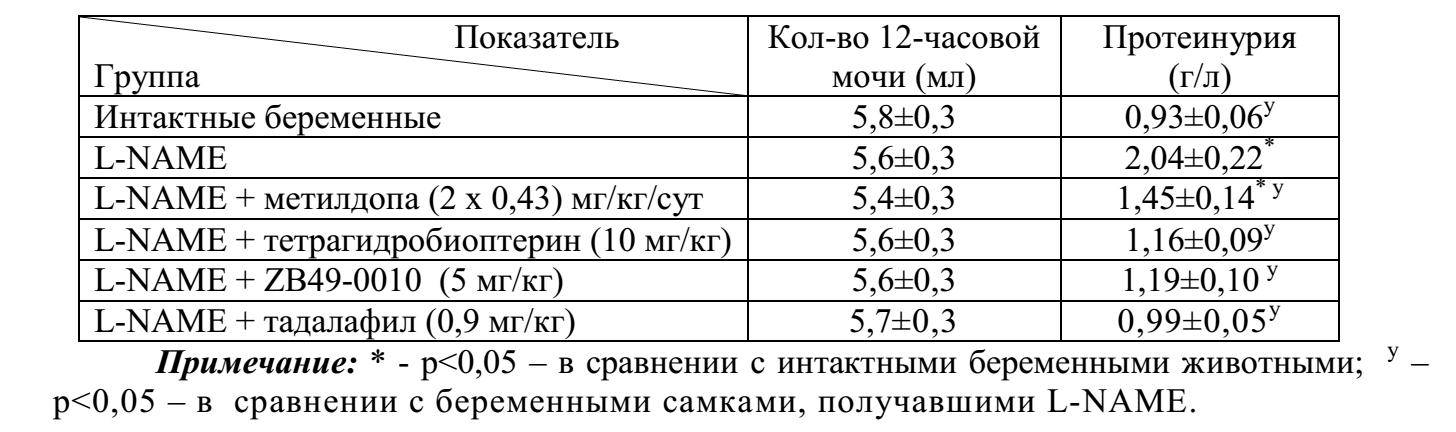 Эти исследования, как правило, были небольшими и/или неконтролируемыми. Кроме того, у женщин, получавших β-адреноблокаторы, было отмечено замедление роста плода, возможно, из-за чрезмерно агрессивного снижения сердечного выброса (26, 27).
Эти исследования, как правило, были небольшими и/или неконтролируемыми. Кроме того, у женщин, получавших β-адреноблокаторы, было отмечено замедление роста плода, возможно, из-за чрезмерно агрессивного снижения сердечного выброса (26, 27).
Совсем недавно внимание снова было обращено на ренин-ангиотензиновую систему (РАС) для обеспечения патофизиологического понимания гипертонии преэклампсии. При нормальной беременности все компоненты РАС активируются, но устойчивость к вазопрессорным эффектам ангиотензина II (AngII) позволяет поддерживать нормальное или низкое АД (18,19). Точно так же сниженная чувствительность почечного кровообращения была продемонстрирована у беременных крыс, поскольку инфузия AngII не снижала СКФ, почечный плазмоток (RPF) и поток мочи (28).Одним из объяснений может быть повышенный уровень в плазме и скорость экскреции с мочой Ang(1-7), мощного контррегулятора AngII, зарегистрированные при беременности человека (29,30). Было показано, что Ang(1-7) значительно снижен у женщин с преэклампсией по сравнению с нормальными беременными контрольными субъектами (29).
Интересно, что данные подтверждают снижение уровней ренина, AngI и AngII у женщин с преэклампсией по сравнению с нормальной беременностью (31). Несмотря на это, у женщин с преэклампсией наблюдается повышенная чувствительность сосудов к компонентам РАС.Повышенная чувствительность сосудов к инфузии ангиотензина может выявить женщин с повышенным риском развития преэклампсии (32,33).
Недавние исследования выявили аутоантитела подкласса IgG в плазме женщин с преэклампсией, способные стимулировать рецептор AT1 (34). Когда сыворотку женщин с преэклампсией добавляли к культивируемым сердечным миоцитам новорожденных крыс, лозартан мог блокировать хронотропный эффект, подтверждая, что эффект был опосредован через АТ1-рецептор (35).Более того, аутоантитела могут стимулировать гетеродимеризацию между АТ1-рецептором и В2-рецептором брадикинина (36). Это может играть важную роль в повышенной чувствительности сосудов к ангиотензину. Он также может индуцировать выработку активных форм кислорода, которые блокируют инвазию цитотрофобласта in vitro и могут быть связаны с неглубокой имплантацией трофобласта, что объясняет некоторые клинические признаки преэклампсии (37).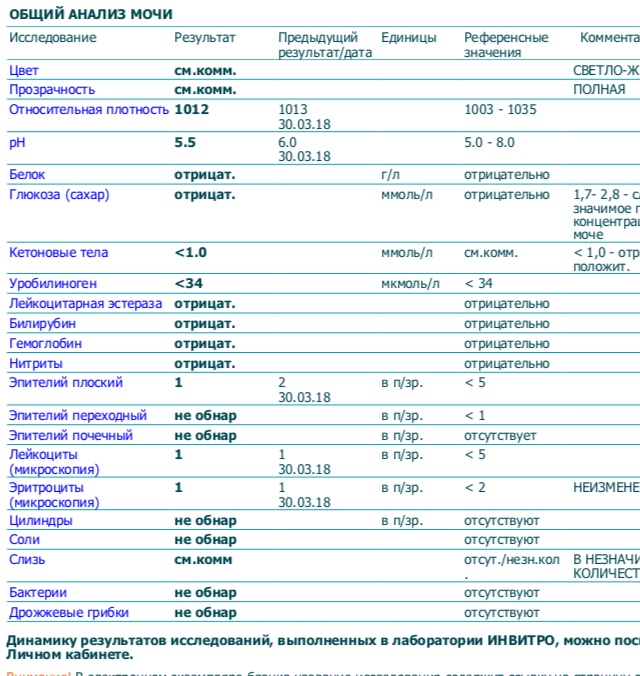 Эта аутоиммунная активность ослабевает после родов (34).Совсем недавно эти антитела также были обнаружены у пациентов с острым отторжением сосудов (38), что позволяет предположить, что они могут играть роль и в других формах повреждения эндотелия.
Эта аутоиммунная активность ослабевает после родов (34).Совсем недавно эти антитела также были обнаружены у пациентов с острым отторжением сосудов (38), что позволяет предположить, что они могут играть роль и в других формах повреждения эндотелия.
Снижение СКФ
У здоровых беременных женщин наблюдается выраженная гломерулярная гиперфильтрация, пики которой превышают нормальные уровни вне беременности на 40–60% (39,40). Эта гиперфильтрация, по-видимому, возникает в первую очередь из-за снижения онкотического давления плазмы (π GC ) в гломерулярных капиллярах. Снижение π GC во время беременности связано с двумя явлениями.Во-первых, это вызванная гиперволемией гемодилюция, которая снижает концентрацию белков плазмы, поступающих в гломерулярную микроциркуляцию. Второй – повышенный показатель РПФ. Гиперперфузия клубочков снижает степень увеличения онкотического давления вдоль капилляров клубочков во время образования фильтрата. При преэклампсии почечная недостаточность различной степени сочетается с характерным гломерулярным поражением, «гломерулярным эндотелиозом».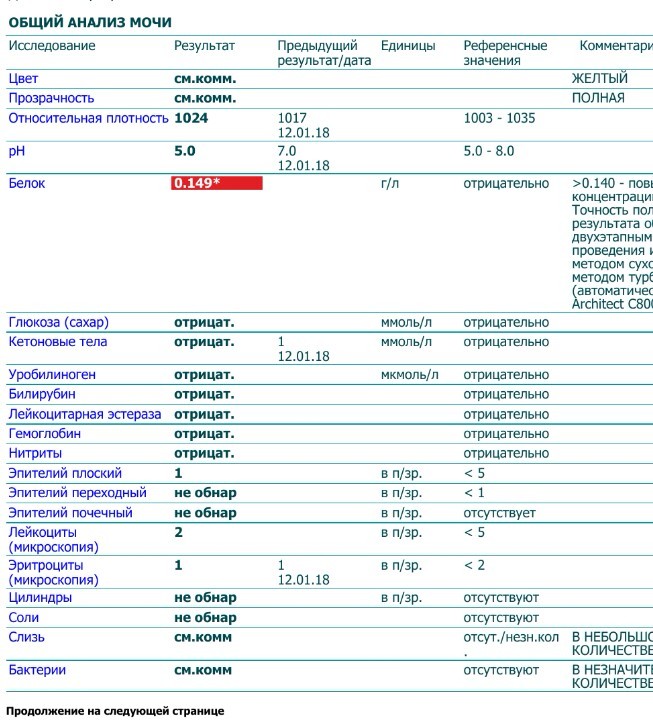
Точные физиологические измерения в сочетании с биопсией сразу после родов использовались для изучения детерминант СКФ у женщин с преэклампсией по сравнению со здоровыми беременными женщинами из контрольной группы (41).СКФ была значительно снижена до 91 мл/мин на 1,73 м 2 у женщин с преэклампсией по сравнению со значением 149 мл/мин на 1,73 м 2 у контрольных субъектов. Интересно, что не было обнаружено существенных различий ни в RPF, ни в π GC . Морфометрический анализ выявил значительные ультраструктурные различия, включая набухание эндотелиальных клеток, субэндотелиальное отложение фибриноидов и интерпозицию мезангиальных клеток (рис. 1). Сканирующая электронная микроскопия использовалась для характеристики размеров эндотелиальных окон, что позволило авторам сделать вывод о том, что уменьшение плотности и размеров эндотелиальных окон и субэндотелиальное накопление фибриноидных отложений резко снижает гидравлическую проницаемость клубочков у пациенток с преэклампсией.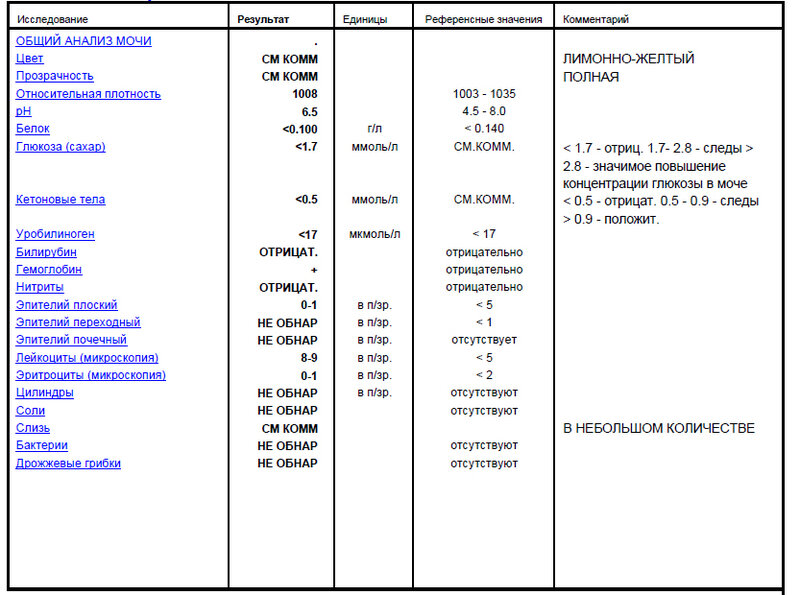 Интерпозиция мезангиальных клеток также уменьшала доступную площадь поверхности для фильтрации, что приводило к кумулятивной депрессии K f , которая была точно пропорциональна СКФ. Более спорным выводом было то, что гипофильтрация при преэклампсии не имеет гемодинамической основы.
Интерпозиция мезангиальных клеток также уменьшала доступную площадь поверхности для фильтрации, что приводило к кумулятивной депрессии K f , которая была точно пропорциональна СКФ. Более спорным выводом было то, что гипофильтрация при преэклампсии не имеет гемодинамической основы.
Трансмиссионная электронная микроскопия типичного капилляра клубочка с перечислением патологических изменений, связанных с преэклампсией: 1 — тело эндотелиальной клетки; 2 — набухший, нефенестрированный эндотелий; 3 — субэндотелиальные отложения фибриноидов; 4, интерпозиция мезангиальных клеток.
В недавнем исследовании использовалась полуколичественная шкала для оценки эндотелиоза, который присутствовал в образцах биопсии, взятых у женщин с преэклампсией примерно за 1 неделю до родов (42,43). Они отметили эндотелиоз от умеренной до тяжелой степени у всех женщин со значительной артериальной гипертензией и протеинурией до родов. Интересно, что женщины с непротеинурической гестационной гипертензией и нормальные беременные женщины также обнаруживали эндотелиоз, но в меньшей степени, что позволяет предположить, что гипертензия, вызванная беременностью, может в некоторых случаях отражать более раннюю или более легкую форму той же патологии (44).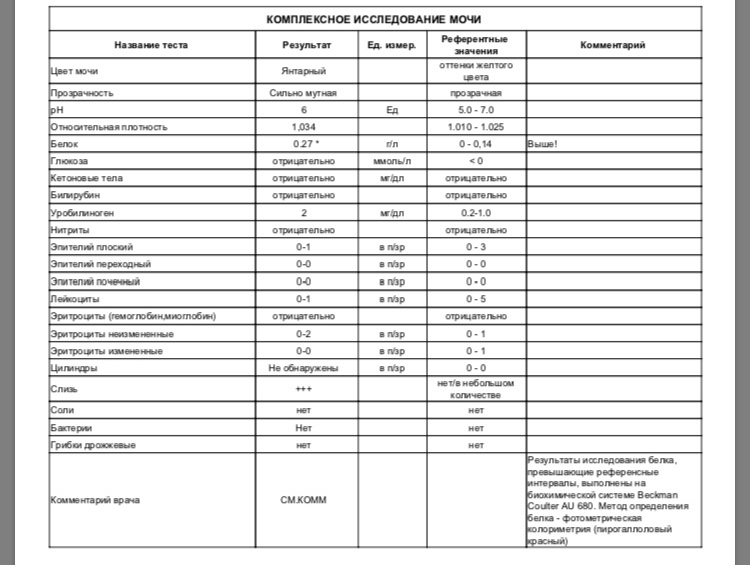 Субэндотелиальные отложения фибриноидов и интерпозиция мезангиальных клеток были обнаружены только у женщин с преэклампсией. К сожалению, авторы никогда не публиковали никаких изображений и не получали подтверждения от второго ослепленного патологоанатома, чтобы обеспечить надежность между наблюдателями. Во второй статье, в которой изучалась та же популяция пациентов, авторы обнаружили линейную тенденцию между объемом клубочков, отражающим степень эндотелиоза, и цистатином С (42), предполагая, что в основе гипофильтрации при преэклампсии лежат в значительной степени вторичные структурные изменения в клубочках. в отличие от почечной вазоконстрикции и депрессии при РПФ.Однако полезность цистатина С в качестве маркера СКФ у этой популяции пациентов неясна. Недавнее исследование показало, что цистатин С плохо коррелирует с клиренсом креатинина в третьем триместре ( r = 0,27) (45), а другое исследование, в котором для сравнения использовался клиренс инулина, показало, что измерение не является независимым от состава тела, как предполагалось ранее (46).
Субэндотелиальные отложения фибриноидов и интерпозиция мезангиальных клеток были обнаружены только у женщин с преэклампсией. К сожалению, авторы никогда не публиковали никаких изображений и не получали подтверждения от второго ослепленного патологоанатома, чтобы обеспечить надежность между наблюдателями. Во второй статье, в которой изучалась та же популяция пациентов, авторы обнаружили линейную тенденцию между объемом клубочков, отражающим степень эндотелиоза, и цистатином С (42), предполагая, что в основе гипофильтрации при преэклампсии лежат в значительной степени вторичные структурные изменения в клубочках. в отличие от почечной вазоконстрикции и депрессии при РПФ.Однако полезность цистатина С в качестве маркера СКФ у этой популяции пациентов неясна. Недавнее исследование показало, что цистатин С плохо коррелирует с клиренсом креатинина в третьем триместре ( r = 0,27) (45), а другое исследование, в котором для сравнения использовался клиренс инулина, показало, что измерение не является независимым от состава тела, как предполагалось ранее (46).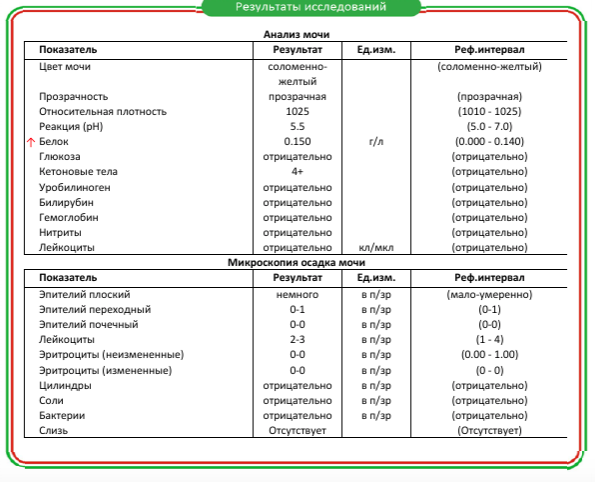 ). На сегодняшний день цистатин С не был подтвержден как маркер СКФ при беременности, при этом несколько исследований предполагают, что он может быть неточным.
). На сегодняшний день цистатин С не был подтвержден как маркер СКФ при беременности, при этом несколько исследований предполагают, что он может быть неточным.
Протеинурия
В 1843 году Джон Левер из больницы Гая в Лондоне обнаружил присутствие альбумина, кипячая мочу беременных женщин с послеродовыми судорогами. Преэклампсия отличается от гестационной гипертензии наличием протеинурии и является наиболее частой причиной нефротического синдрома у беременных. Количество белка, выделяемого с мочой, варьирует в широких пределах. Значительная экскреция белка определяется как ≥300 мг в моче, собранной за 24 часа, или 1+ или более при тестировании с полосками мочи двух случайных образцов мочи, собранных с интервалом не менее 4 часов (47).
В многочисленных исследованиях использовались различные методы для изучения биохимического состава мочи при преэклампсии, включая индексы белковой селективности, с переменными результатами. Как правило, моча при преэклампсии продемонстрировала низкую селективность и существенно не отличалась от мочи при других формах первичной почечной недостаточности (48).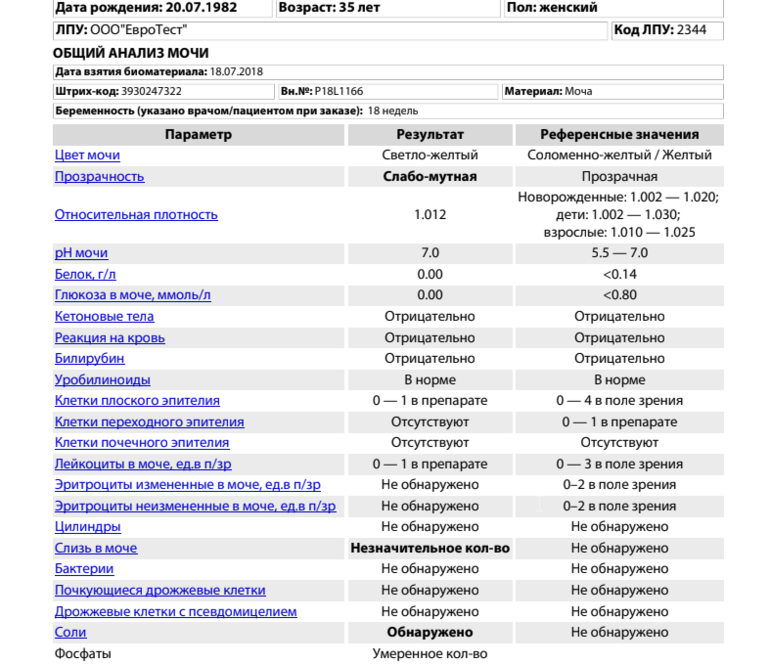 Гломерулярные белки промежуточного размера, такие как альбумин, были идентифицированы отдельно или в сочетании с различной степенью тубулярных белков, таких как B 2 -микроглобулин, что отражает повреждение канальцев, которое может произойти при тяжелой преэклампсии (49, 50).
Гломерулярные белки промежуточного размера, такие как альбумин, были идентифицированы отдельно или в сочетании с различной степенью тубулярных белков, таких как B 2 -микроглобулин, что отражает повреждение канальцев, которое может произойти при тяжелой преэклампсии (49, 50).
К сожалению, точная роль слоя эндотелиальных клеток в регуляции селективности клубочковой проницаемости остается наименее четко определенной. Эндотелиальные клетки трудно получить для исследований in vitro , и, в отличие от подоцитов, для этой клеточной линии нет специфических маркеров. Слой эндотелиальных клеток, перфорированный крупными фенестрами, не способствует селективности по размеру, позволяя проходить нейтральным молекулам с радиусом примерно до 375 Å. Таким образом, механизм протеинурии при преэклампсии изучен недостаточно.Базальная мембрана клубочков и подоциты обычно выглядят нормально (33,36). Немногие исследователи использовали методы просеивания декстрана для выяснения свойств барьера клубочковой фильтрации у женщин с преэклампсией. В 1970-х годах Маклин и др. (51) подтвердил гломерулярное происхождение протеинурии при преэклампсии, демонстрируя коэффициенты просеивания декстрана в промежуточном диапазоне. Этот вывод был подтвержден более поздним исследованием, которое продемонстрировало значительную потерю селективности по размеру для полос от 31 до 39 Å ( P < 0.0001), а также от 41 до 49 Å ( P < 0,01) (52). Без более конкретных исследований авторы сослались на тот факт, что потеря селективности в отношении заряда, вероятно, была первичным дефектом барьера клубочковой фильтрации у женщин с преэклампсией. Новое понимание роли ангиогенных факторов в поддержании интактного барьера клубочковой фильтрации может объяснить наличие протеинурии нефротического диапазона при эндотелиально-клеточном заболевании (см. Циркулирующие ангиогенные факторы при преэклампсии).
В 1970-х годах Маклин и др. (51) подтвердил гломерулярное происхождение протеинурии при преэклампсии, демонстрируя коэффициенты просеивания декстрана в промежуточном диапазоне. Этот вывод был подтвержден более поздним исследованием, которое продемонстрировало значительную потерю селективности по размеру для полос от 31 до 39 Å ( P < 0.0001), а также от 41 до 49 Å ( P < 0,01) (52). Без более конкретных исследований авторы сослались на тот факт, что потеря селективности в отношении заряда, вероятно, была первичным дефектом барьера клубочковой фильтрации у женщин с преэклампсией. Новое понимание роли ангиогенных факторов в поддержании интактного барьера клубочковой фильтрации может объяснить наличие протеинурии нефротического диапазона при эндотелиально-клеточном заболевании (см. Циркулирующие ангиогенные факторы при преэклампсии).
Коагулопатия и HELLP-синдром
При преэклампсии повреждение эндотелия также может проявляться в виде слабовыраженной коагулопатии с повышением уровня фибронектина, повышенной агрегацией тромбоцитов, сокращением выживаемости тромбоцитов и снижением уровня антитромбина III (53). Синдром HELLP развивается у 10% беременных с тяжелой преэклампсией, и существуют данные, свидетельствующие о том, что это не просто эпифеномен гипертензии. Было показано, что концентрация клеточного фибронектина в плазме постоянно выше на протяжении всей беременности у женщин, у которых развилась преэклампсия, по сравнению со здоровыми субъектами из контрольной группы.Кроме того, было показано, что маркеры активации тромбоцитов, включая β-тромбоглобулин, а также анализы агрегации тромбоцитов предшествуют клиническим проявлениям заболевания (54,55).
Синдром HELLP развивается у 10% беременных с тяжелой преэклампсией, и существуют данные, свидетельствующие о том, что это не просто эпифеномен гипертензии. Было показано, что концентрация клеточного фибронектина в плазме постоянно выше на протяжении всей беременности у женщин, у которых развилась преэклампсия, по сравнению со здоровыми субъектами из контрольной группы.Кроме того, было показано, что маркеры активации тромбоцитов, включая β-тромбоглобулин, а также анализы агрегации тромбоцитов предшествуют клиническим проявлениям заболевания (54,55).
Эклампсия
Судороги с другими неврологическими симптомами, включая головную боль и нарушения зрения, осложняют примерно 5 из каждых 10 000 живорождений, при этом частота их снижается в результате улучшения дородового ухода с ускоренными родами и, возможно, широкого применения сульфата магния (56).Точный механизм, ответственный за развитие судорог, не ясен, но предлагаемые теории включают спазм сосудов головного мозга, отек и возможность того, что тяжелая гипертензия может нарушить церебральную ауторегуляцию и нарушить гематоэнцефалический барьер. Отек головного мозга при эклампсии преимущественно поражает заднюю, теменно-затылочную доли и подобен изображениям, описанным при синдроме обратимой задней лейкоэнцефалопатии (57). Было отмечено, что этот результат магнитно-резонансной томографии лучше коррелирует с маркерами эндотелиальной дисфункции, включая лактатдегидрогеназу, морфологию эритроцитов и креатинин, чем с уровнем артериальной гипертензии (58,59).Интересно, что синдром обратимой задней лейкоэнцефалопатии у пациентов с тромботической тромбоцитопенической пурпурой в некоторых случаях не зависит от уровня артериальной гипертензии (60).
Отек головного мозга при эклампсии преимущественно поражает заднюю, теменно-затылочную доли и подобен изображениям, описанным при синдроме обратимой задней лейкоэнцефалопатии (57). Было отмечено, что этот результат магнитно-резонансной томографии лучше коррелирует с маркерами эндотелиальной дисфункции, включая лактатдегидрогеназу, морфологию эритроцитов и креатинин, чем с уровнем артериальной гипертензии (58,59).Интересно, что синдром обратимой задней лейкоэнцефалопатии у пациентов с тромботической тромбоцитопенической пурпурой в некоторых случаях не зависит от уровня артериальной гипертензии (60).
Циркулирующие ангиогенные факторы при преэклампсии
Недавно было высказано предположение, что два эндогенных антиангиогенных белка плацентарного происхождения — циркулирующая растворимая fms-подобная тирозинкиназа 1 (sFlt1) и растворимый эндоглин (61) — играют роль причинную роль в патогенезе преэклампсии (62,63).sFlt1 представляет собой секретируемый белок, вариант сплайсинга рецептора фактора роста эндотелия сосудов (VEGF) Flt1, в котором отсутствуют трансмембранный и цитоплазматический домен мембраносвязанного рецептора. Циркулируя в крови, он действует как мощный антагонист VEGF и плацентарного фактора роста (PlGF). Как VEGF, так и PlGF вырабатываются плацентой и циркулируют в высокой концентрации во время беременности. Уровень циркулирующего sFlt1 значительно повышается у женщин с преэклампсией еще до появления клинических симптомов (64).В соответствии с действием циркулирующего белка, связывающего PlGF, уровни свободного PlGF также снижаются у женщин с преэклампсией до появления клинических симптомов (64). При введении беременным и небеременным крысам sFlt1 вызывает синдром гипертонии, протеинурии и гломерулярного эндотелиоза, напоминающий преэклампсию (62). Также было показано, что VEGF индуцирует эндотелиальные фенестры in vitro , а потеря 50% продукции VEGF в клубочках мышей приводит не только к гломерулярному эндотелиозу, но также и к потере гломерулярных эндотелиальных фенестр, подобно тому, что отмечается при преэклампсии у человека. (65).Антагонисты VEGF, используемые в антиангиогенных онкологических исследованиях, иногда вызывают гипертензию и протеинурию у людей (66, 67).
Циркулируя в крови, он действует как мощный антагонист VEGF и плацентарного фактора роста (PlGF). Как VEGF, так и PlGF вырабатываются плацентой и циркулируют в высокой концентрации во время беременности. Уровень циркулирующего sFlt1 значительно повышается у женщин с преэклампсией еще до появления клинических симптомов (64).В соответствии с действием циркулирующего белка, связывающего PlGF, уровни свободного PlGF также снижаются у женщин с преэклампсией до появления клинических симптомов (64). При введении беременным и небеременным крысам sFlt1 вызывает синдром гипертонии, протеинурии и гломерулярного эндотелиоза, напоминающий преэклампсию (62). Также было показано, что VEGF индуцирует эндотелиальные фенестры in vitro , а потеря 50% продукции VEGF в клубочках мышей приводит не только к гломерулярному эндотелиозу, но также и к потере гломерулярных эндотелиальных фенестр, подобно тому, что отмечается при преэклампсии у человека. (65).Антагонисты VEGF, используемые в антиангиогенных онкологических исследованиях, иногда вызывают гипертензию и протеинурию у людей (66, 67). Наконец, более высокие уровни циркулирующего продукта гена sFlt1, кодируемого хромосомой 13, при беременности с трисомией 13 могут объяснить повышенный риск преэклампсии у женщин, вынашивающих плод с трисомией 13 (68).
Наконец, более высокие уровни циркулирующего продукта гена sFlt1, кодируемого хромосомой 13, при беременности с трисомией 13 могут объяснить повышенный риск преэклампсии у женщин, вынашивающих плод с трисомией 13 (68).
Помимо своей роли в патогенезе преэклампсии, циркулирующая концентрация sFlt1 и PlGF может иметь важное прогностическое и диагностическое значение.Концентрация sFlt1 начинает повышаться ближе к концу второго триместра у женщин, которым предопределено развитие преэклампсии, за 4–5 недель до первых клинических проявлений (64). К тому времени, когда проявления преэклампсии становятся выраженными, концентрации sFlt1 в плазме значительно повышаются, в два-четыре раза превышая уровни, обнаруживаемые при нормальной беременности, и являются максимальными у пациенток с тяжелой преэклампсией. У женщин, у которых развивается преэклампсия, наблюдается умеренное, но значительное снижение уровня PlGF, начиная уже с первого триместра.Начиная с середины беременности концентрация несвязанного PlGF в плазме падает значительно ниже в то время, когда уровни sFlt1 повышаются. Несвязанный PlGF также свободно фильтруется с мочой и, таким образом, также может служить для прогнозирования последующего развития преэклампсии (69).
Несвязанный PlGF также свободно фильтруется с мочой и, таким образом, также может служить для прогнозирования последующего развития преэклампсии (69).
Эндоглин (англ.) — ангиогенный рецептор, который экспрессируется на поверхности эндотелиальных клеток и синцитиотрофобластов плаценты. Eng действует как корецептор для TGF-β, мощной проангиогенной молекулы. Eng мРНК активируется в преэклампсии плаценты (63).Более того, внеклеточная область Eng протеолитически расщепляется, и растворимый Eng (sEng) высвобождается в избыточных количествах в кровоток у пациенток с преэклампсией. У беременных крыс sEng усугубляет повреждение сосудов, опосредованное sFlt1, что приводит к тяжелым заболеваниям, подобным преэклампсии, включая развитие HELLP-подобного синдрома и задержку роста плода (63). В культурах эксплантатов трофобластов от 5 до 8 недель беременности mAb к Eng и антисмысловые олигонуклеотиды Eng стимулировали рост и миграцию трофобластов (70).TGFβ1 и/или TGF-β3 ингибируют миграцию и инвазию трофобласта, и, по-видимому, Eng опосредует этот эффект. Поэтому было высказано предположение, что продукция sEng плацентой может быть компенсаторным механизмом, ограничивающим эффекты поверхностного Eng. В недавних клинических исследованиях уровень sEng был повышен не только во время болезни, но и до появления симптомов (71). Повышение sEng было особенно выраженным — и, следовательно, потенциально наиболее полезным для прогнозирования — у женщин, у которых развилась преждевременная преэклампсия или преэклампсия с младенцем, который был мал для гестационного возраста.Хотя гестационный паттерн концентрации sEng, как правило, соответствует траектории соотношения sFlt1/PlGF, многофакторный анализ показал, что каждый из них был в значительной степени связан с преэклампсией. Действительно, комбинированный показатель, который включал все три ангиогенные молекулы (sFlt1, sEng и PlGF), был более сильным предиктором преэклампсии, чем отдельные биомаркеры (71) (рис. 2).
Поэтому было высказано предположение, что продукция sEng плацентой может быть компенсаторным механизмом, ограничивающим эффекты поверхностного Eng. В недавних клинических исследованиях уровень sEng был повышен не только во время болезни, но и до появления симптомов (71). Повышение sEng было особенно выраженным — и, следовательно, потенциально наиболее полезным для прогнозирования — у женщин, у которых развилась преждевременная преэклампсия или преэклампсия с младенцем, который был мал для гестационного возраста.Хотя гестационный паттерн концентрации sEng, как правило, соответствует траектории соотношения sFlt1/PlGF, многофакторный анализ показал, что каждый из них был в значительной степени связан с преэклампсией. Действительно, комбинированный показатель, который включал все три ангиогенные молекулы (sFlt1, sEng и PlGF), был более сильным предиктором преэклампсии, чем отдельные биомаркеры (71) (рис. 2).
Скорректированные отношения шансов для преждевременной (A) или доношенной (B) преэклампсии в соответствии с соотношением растворимой fms-подобной тирозинкиназы 1: плацентарного фактора роста (sFlt1:PlGF) и уровнями растворимого эндоглина.
Границы | Исходы беременности для матери и плода при нефротическом синдроме вследствие первичного гломерулонефрита
Введение
В прошлом страх перед прогрессированием хронической болезни почек (ХБП) мог помешать нефрологам поддерживать идею своих пациенток о зачатии или продолжении беременности, даже если доказательства неблагоприятных исходов были разбросаны. В настоящее время легкой формой ХБП страдают почти 3% женщин детородного возраста, тогда как ХБП 3-5 стадии выявляют у 0,7% женщин того же возраста (1).Однако реальная распространенность среди беременных не может быть оценена, учитывая, что рекомендации по скринингу беременности обычно включают только анализ мочи для выявления инфекций мочевыводящих путей (ИМП) или протеинурии. С другой стороны, число сообщений о легкой ХБП при расширенных лабораторных исследованиях, проводимых во время беременности, увеличивается, вероятно, из-за увеличения возраста матери и более высокой частоты гипертонии, ожирения, сахарного диабета 2 типа (DMT2) или курения.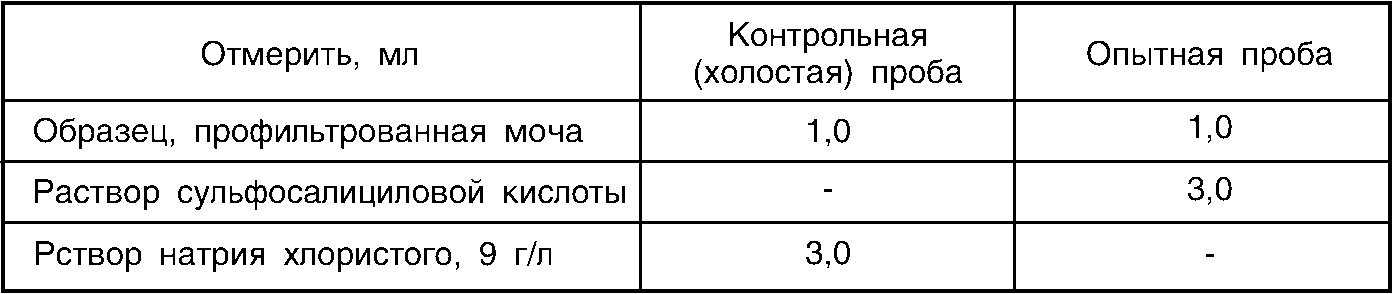 Таким образом, первая беременность часто является реальным пробным камнем для выявления метаболических нарушений, нарушений функции почек или ИМП.Среди первичных заболеваний почек гломерулопатии, особенно нефротический синдром, являются редкими состояниями, лечение которых во время беременности должно включать специфическое последующее наблюдение и оценку факторов риска неблагоприятных событий со стороны матери и плода и/или прогрессирования почечной недостаточности у матери. Все исследования, основанные на различных случаях ХБП, демонстрируют, что стадия почечной недостаточности, но прежде всего исходная протеинурия и артериальная гипертензия, являются значительными факторами риска неблагоприятных исходов. Цель нашего обзора — изучить исходы у женщин с нефротическим синдромом вследствие первичных гломерулопатий, включая фокальный и сегментарный гломерулосклероз (ФСГС), болезнь минимальных изменений (БМИ), мембранозную нефропатию (МН) и мембранопролиферативный гломерулонефрит (МПГН).
Таким образом, первая беременность часто является реальным пробным камнем для выявления метаболических нарушений, нарушений функции почек или ИМП.Среди первичных заболеваний почек гломерулопатии, особенно нефротический синдром, являются редкими состояниями, лечение которых во время беременности должно включать специфическое последующее наблюдение и оценку факторов риска неблагоприятных событий со стороны матери и плода и/или прогрессирования почечной недостаточности у матери. Все исследования, основанные на различных случаях ХБП, демонстрируют, что стадия почечной недостаточности, но прежде всего исходная протеинурия и артериальная гипертензия, являются значительными факторами риска неблагоприятных исходов. Цель нашего обзора — изучить исходы у женщин с нефротическим синдромом вследствие первичных гломерулопатий, включая фокальный и сегментарный гломерулосклероз (ФСГС), болезнь минимальных изменений (БМИ), мембранозную нефропатию (МН) и мембранопролиферативный гломерулонефрит (МПГН).
Нефротический синдром и беременность, сложный анализ данных
Этические опасения по поводу беременности не позволяют начать интервенционные рандомизированные контролируемые исследования, поэтому литература в этой области в основном основана на ретроспективных или, в меньшей степени, проспективных обсервационных исследованиях. Кроме того, статистический анализ материнско-плодовых или почечных исходов в этих исследованиях часто основывается на стадии ХБП, а не на конкретных основных причинах, которые варьируются от гипертонии и/или протеинурии, диабетической нефропатии (ДН) и гломерулонефрита до аутосомно-доминантного поликистозного заболевания почек. (АДПБП), пороки развития почек, нефролитиаз или хронические ИМП.Стоит учитывать, что некоторые из них могут подвергать пациенток специфическим рискам, таким как повышенная частота деформаций плода при ДН или наследственная передача АДПБП, в дополнение к другим неблагоприятным исходам, таким как прогрессирование ХБП у матери или смерть матери и плода, недоношенность, малая детей с гестационным возрастом (SGA) или госпитализацию в отделение интенсивной терапии новорожденных (NICU), которые являются общими для всех причин ХБП. Наконец, следует учитывать долгосрочные последствия ХБП средней и тяжелой степени, которые приводят к более высокой частоте гипертензии и ишемической болезни сердца у женщин с осложнениями со стороны матери и плода.
Кроме того, статистический анализ материнско-плодовых или почечных исходов в этих исследованиях часто основывается на стадии ХБП, а не на конкретных основных причинах, которые варьируются от гипертонии и/или протеинурии, диабетической нефропатии (ДН) и гломерулонефрита до аутосомно-доминантного поликистозного заболевания почек. (АДПБП), пороки развития почек, нефролитиаз или хронические ИМП.Стоит учитывать, что некоторые из них могут подвергать пациенток специфическим рискам, таким как повышенная частота деформаций плода при ДН или наследственная передача АДПБП, в дополнение к другим неблагоприятным исходам, таким как прогрессирование ХБП у матери или смерть матери и плода, недоношенность, малая детей с гестационным возрастом (SGA) или госпитализацию в отделение интенсивной терапии новорожденных (NICU), которые являются общими для всех причин ХБП. Наконец, следует учитывать долгосрочные последствия ХБП средней и тяжелой степени, которые приводят к более высокой частоте гипертензии и ишемической болезни сердца у женщин с осложнениями со стороны матери и плода.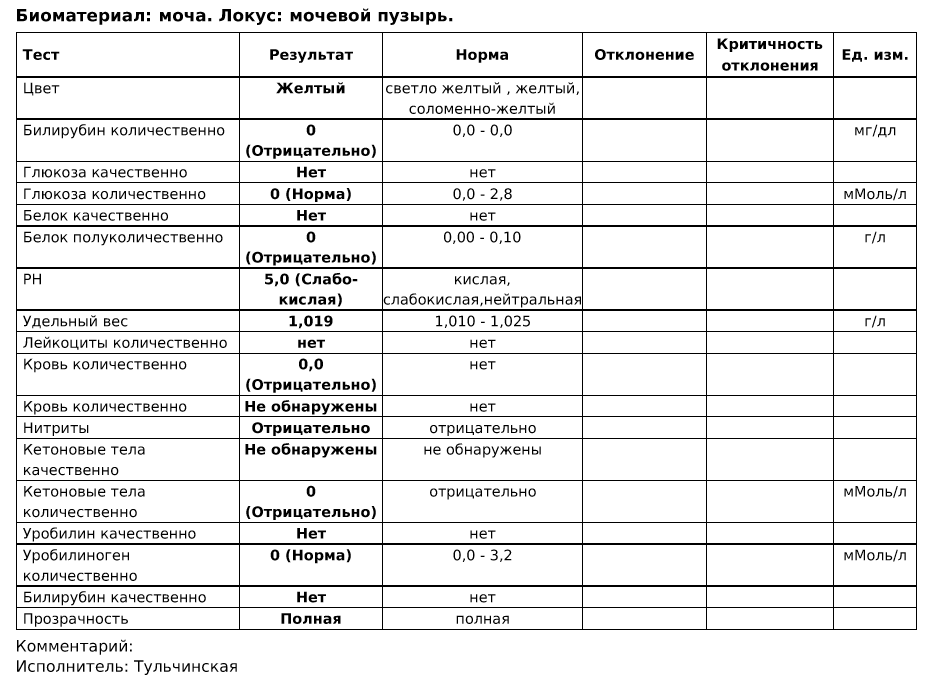 За исключением IgA-нефропатии (IgAN) и системной красной волчанки, которые приводят к наиболее частым гломерулярным заболеваниям у женщин детородного возраста, исследование специфических исходов других гломерулопатий представляется довольно сложным, поскольку трудно найти группу беременных, достаточно большую для достижения статистической значимости. после стратификации индивидуальных факторов риска.
За исключением IgA-нефропатии (IgAN) и системной красной волчанки, которые приводят к наиболее частым гломерулярным заболеваниям у женщин детородного возраста, исследование специфических исходов других гломерулопатий представляется довольно сложным, поскольку трудно найти группу беременных, достаточно большую для достижения статистической значимости. после стратификации индивидуальных факторов риска.
Наложенная преэклампсия или прогрессирование заболевания почек?
По оценкам, нефротический синдром возникает у 0.028% беременностей (2), но повышенную или вновь возникшую протеинурию следует отличать от преэклампсии. Обычно время и клиническая картина являются диагностическими критериями, когда протеинурия повышается вдвое по сравнению с исходным значением, если она > 2 г/сут, или в 5 раз, если она ниже, после 20-й недели беременности, что связано с появлением гипертензии и сильных головных или эпигастральных болей. а также при лабораторных отклонениях, таких как тромбоцитопения и титр сывороточной аспартатаминотрансферазы >70 ЕД/л (3).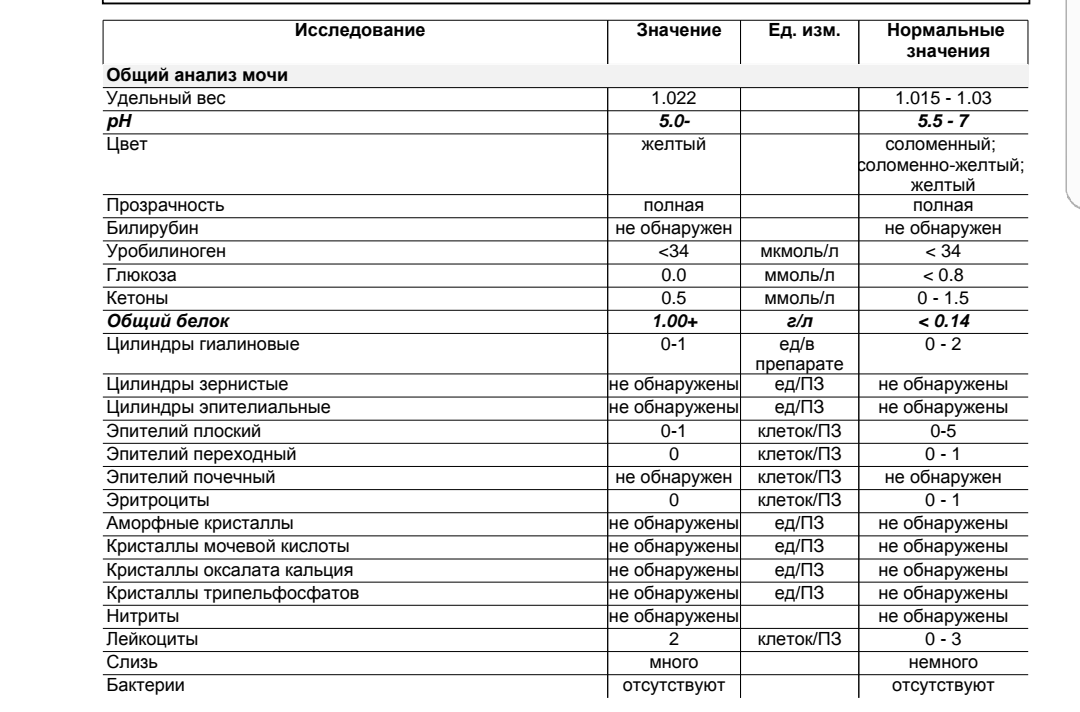
В настоящее время подоцитурия и нефринурия считаются прямыми мочевыми маркерами повреждения подоцитов. Подоцитурия имеет более высокую чувствительность (88%) и специфичность (79%) при использовании методов иммунофлуоресценции, нацеленных на подокаликсин, а не на синаптоподин или подоцин. Нефринурия определяется как повышение уровня нефрина в моче, предшествующее началу клинических проявлений преэклампсии примерно за 9 дней, с наилучшей чувствительностью (100%) и специфичностью (97%) в 3-м триместре беременности.Однако их преимущество в качестве предикторов преэклампсии может быть не очень важным для дифференциальной диагностики между этим состоянием и новым началом или прогрессированием нефротического синдрома. Плацентарный фактор роста (PlGF) представляет собой ангиогенный фактор, продукция которого увеличивается до 26–30 недель беременности у здоровых женщин. Напротив, при преэклампсии сниженный титр PlGF может быть выражением плацентарной дисфункции. Растворимый FMS-подобный тирозинкиназный рецептор 1 (sFlt-1) противодействует PlGF, а также продемонстрировал снижение экспрессии компонентов щелевой диафрагмы, ответственных за протеинурию.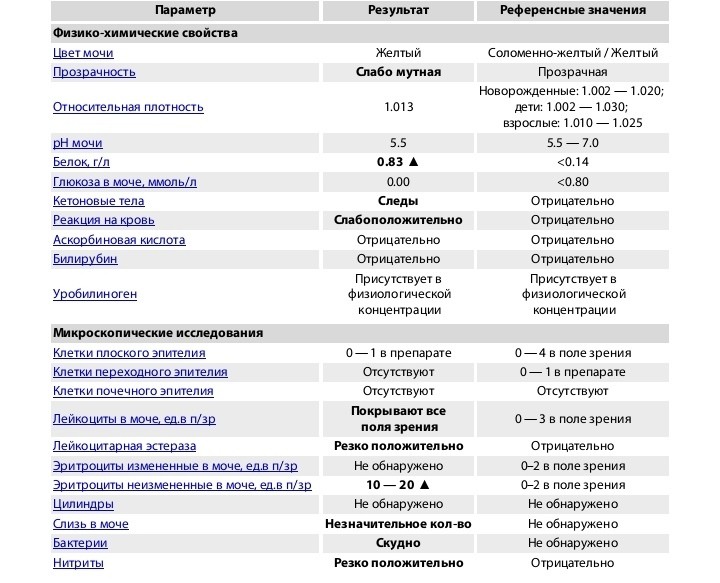 Соотношение sFlt-1/PlGF, по-видимому, является многообещающим плацентарно-специфическим маркером преэклампсии с точки зрения как специфичности, так и чувствительности (4), и коррелирует с тяжестью заболевания, опережая его начало примерно на 5 недель.
Соотношение sFlt-1/PlGF, по-видимому, является многообещающим плацентарно-специфическим маркером преэклампсии с точки зрения как специфичности, так и чувствительности (4), и коррелирует с тяжестью заболевания, опережая его начало примерно на 5 недель.
Конкретные исходы при первичном нефротическом синдроме
Материнские и фетальные исходы у пациенток с ФСГС изучались с 1980 по 2017 г. в нескольких сериях случаев беременных с подтвержденными биопсией первичными гломерулярными заболеваниями. За исключением проспективного испытания и двух ретроспективных исследований, каждое из которых включало только случай ФСГС и сообщало, соответственно, о случае прогрессирования заболевания почек, мертворождения и преждевременных родов (5–7), другие исследования включали ряд беременностей в диапазоне от 10 до 84 лет, со сроком родов в 16–78 лет.5% случаев (8–14). Анализ неблагоприятных материнско-плодовых исходов показал высокую частоту самопроизвольных абортов (5,9–28,6%), преждевременных родов (5,9–58,8%) и перинатальной смерти (11,7–45,2%) (8–14). Что касается материнских почечных исходов, артериальная гипертензия возникает у 20–71% беременных, но сохраняется через 6 месяцев после родов у 4–66% женщин (8–14). Самый высокий уровень послеродовой гипертензии был достигнут в саудовской когорте из 84 беременностей у 18 женщин, страдающих ФСГС, у которых до развития нефротического синдрома было 38 беременностей.Малик и др. сравнили материнско-фетальные исходы их беременностей, не продемонстрировав статистической значимости повышения частоты абортов, зарегистрированных после постановки диагноза ФСГС. И наоборот, более высокая частота преждевременных родов (5,9%, p = 0,0006) и детей с SGA (16,6%, p = 0,0001) в когорте ФСГС, чем в контрольной группе гестаций, оказалась значимой (13). Интересно, что протеинурия увеличилась с 3,8 ± 3,4 г/сут при первой беременности до 4,8 ± 2,0 г/сут при последней, но разница была недостоверной ( p = 0.275). При последнем наблюдении, в среднем через 10,5 ± 3,3 года после постановки диагноза ФСГС, у половины их когорты было прогрессирование ХБП, а у четырех женщин (22,2%) развилась терминальная стадия почечной недостаточности (ТХПН), требующая заместительной почечной терапии (13).
Что касается материнских почечных исходов, артериальная гипертензия возникает у 20–71% беременных, но сохраняется через 6 месяцев после родов у 4–66% женщин (8–14). Самый высокий уровень послеродовой гипертензии был достигнут в саудовской когорте из 84 беременностей у 18 женщин, страдающих ФСГС, у которых до развития нефротического синдрома было 38 беременностей.Малик и др. сравнили материнско-фетальные исходы их беременностей, не продемонстрировав статистической значимости повышения частоты абортов, зарегистрированных после постановки диагноза ФСГС. И наоборот, более высокая частота преждевременных родов (5,9%, p = 0,0006) и детей с SGA (16,6%, p = 0,0001) в когорте ФСГС, чем в контрольной группе гестаций, оказалась значимой (13). Интересно, что протеинурия увеличилась с 3,8 ± 3,4 г/сут при первой беременности до 4,8 ± 2,0 г/сут при последней, но разница была недостоверной ( p = 0.275). При последнем наблюдении, в среднем через 10,5 ± 3,3 года после постановки диагноза ФСГС, у половины их когорты было прогрессирование ХБП, а у четырех женщин (22,2%) развилась терминальная стадия почечной недостаточности (ТХПН), требующая заместительной почечной терапии (13). ). Эти результаты согласуются с предыдущим опытом Packham et al., который сообщил о транзиторном нарушении функции почек в 49% беременностей, сохраняющемся у четырех пациенток и приводящем к терминальной стадии почечной недостаточности у трех из них (19%), соответственно, после 2 беременностей. , 7 и 18 лет, в отличие от более высокой почечной выживаемости (93% через 10 лет после постановки диагноза) в контрольной группе из 58 небеременных женщин, страдающих ФСГС (11).
). Эти результаты согласуются с предыдущим опытом Packham et al., который сообщил о транзиторном нарушении функции почек в 49% беременностей, сохраняющемся у четырех пациенток и приводящем к терминальной стадии почечной недостаточности у трех из них (19%), соответственно, после 2 беременностей. , 7 и 18 лет, в отличие от более высокой почечной выживаемости (93% через 10 лет после постановки диагноза) в контрольной группе из 58 небеременных женщин, страдающих ФСГС (11).
Шесть исследований оценивали исходы беременности и БМИ (2, 5, 6, 8, 14). Два ретроспективных исследования, включившие в свой отчет только семь пациентов с БМИ, показали 50–66% новорожденных с SGA. Что касается почечных исходов, то они, по-видимому, ограничивались периодом гестации, при этом повышенный уровень протеинурии и начало артериальной гипертензии регистрировались только во время беременности в каждом испытании, оба разрешились после родов (2, 5). В соответствии с этими результатами Surian (8) не зафиксировала осложнений при двух беременностях.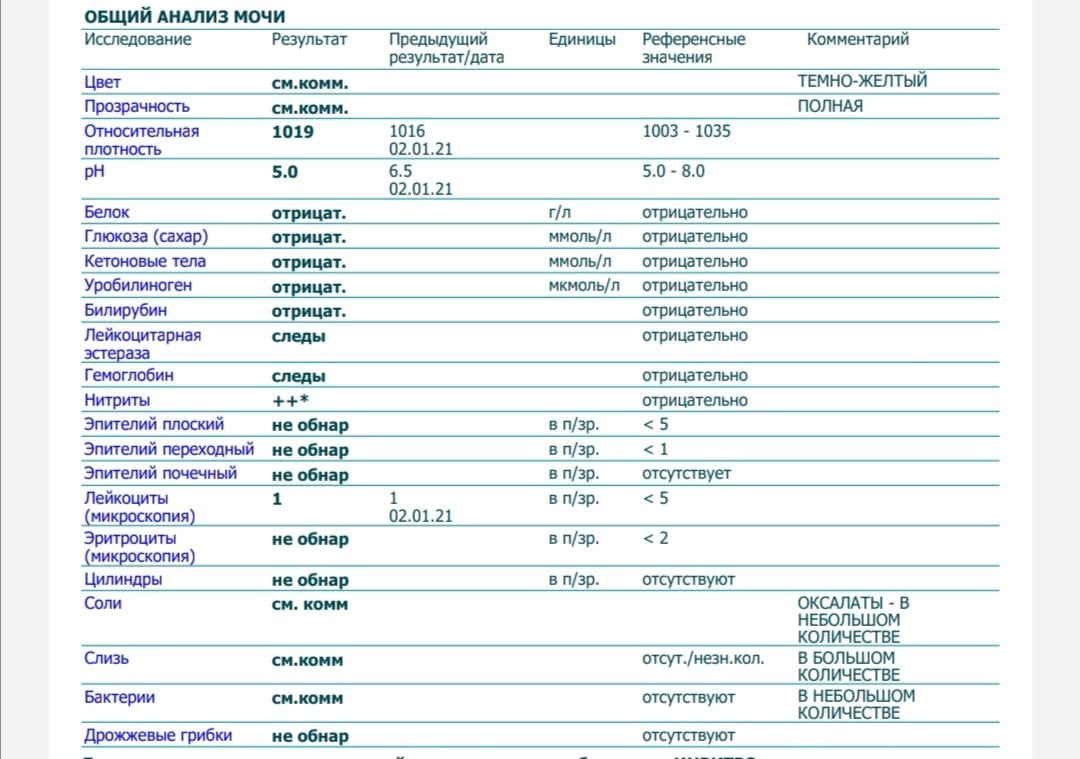 В 1985 г. Абэ и соавт.изучили 17 беременностей у 10 пациенток с БМИ, выделив материнско-фетальные осложнения (младенцы с SGA, преждевременные роды, многоводие, преждевременная отслойка плаценты и сильное кровотечение после родов) в 12% гестаций и потерю плода и аборт в 12 и 17% случаев, соответственно. Основными выявленными факторами риска были артериальная гипертензия и скорость клубочковой фильтрации <70 мл/мин (6). Совсем недавно ретроспективное исследование включало семь беременностей, из которых 71,4% колебались в отношении преждевременных родов и 14.3% случаев потери плода после 20-й недели гестации. Только у одной пациентки наблюдалось стабильное увеличение протеинурии в послеродовом периоде (14).
В 1985 г. Абэ и соавт.изучили 17 беременностей у 10 пациенток с БМИ, выделив материнско-фетальные осложнения (младенцы с SGA, преждевременные роды, многоводие, преждевременная отслойка плаценты и сильное кровотечение после родов) в 12% гестаций и потерю плода и аборт в 12 и 17% случаев, соответственно. Основными выявленными факторами риска были артериальная гипертензия и скорость клубочковой фильтрации <70 мл/мин (6). Совсем недавно ретроспективное исследование включало семь беременностей, из которых 71,4% колебались в отношении преждевременных родов и 14.3% случаев потери плода после 20-й недели гестации. Только у одной пациентки наблюдалось стабильное увеличение протеинурии в послеродовом периоде (14).
Исследования, изучающие ЗН и беременность, выявили меньшее влияние этой гломерулопатии на частоту абортов и мертворождений при отсутствии факторов риска, таких как протеинурия нефротического диапазона во время беременности (2, 5, 6, 8, 9, 12, 14–20). ). Транзиторное развитие артериальной гипертензии регистрировалось в 7,7–45,4% беременных, а усиление протеинурии до 60% случаев подтверждало ассоциацию ЗН с худшими исходами для плода и матери. Пакхэм и др. сообщили о самой высокой частоте материнско-плодовых осложнений с гибелью плода в 24% случаев, преждевременными родами в 43% беременностей, прогрессированием ХБП в 9%, но появлением артериальной гипертензии у 46% беременных и более высокой протеинурией в 54,5% случаев. (17). Когортное исследование в Саудовской Аравии, в котором сравнивались материнские исходы девяти женщин, беременевших до ( n = 21) и после ( n = 30) постановки диагноза ЗН, показало, что частота абортов различна (4,7 против 3,3%, p = 30). 0.843), преждевременные роды (0 против 6,6%, p = 0,152) и перинатальная смертность (0 против 3,3%, p = 0,317) между двумя группами не были статистически значимыми (18). Кроме того, повышение среднего уровня креатинина в сыворотке от первой беременности после постановки диагноза ЗН до последней в той же когорте также не было значительным (средний SCr 68 ± 17 против 80 ± 48 мкмоль/л, соответственно, p = 0,489) (18).
Пакхэм и др. сообщили о самой высокой частоте материнско-плодовых осложнений с гибелью плода в 24% случаев, преждевременными родами в 43% беременностей, прогрессированием ХБП в 9%, но появлением артериальной гипертензии у 46% беременных и более высокой протеинурией в 54,5% случаев. (17). Когортное исследование в Саудовской Аравии, в котором сравнивались материнские исходы девяти женщин, беременевших до ( n = 21) и после ( n = 30) постановки диагноза ЗН, показало, что частота абортов различна (4,7 против 3,3%, p = 30). 0.843), преждевременные роды (0 против 6,6%, p = 0,152) и перинатальная смертность (0 против 3,3%, p = 0,317) между двумя группами не были статистически значимыми (18). Кроме того, повышение среднего уровня креатинина в сыворотке от первой беременности после постановки диагноза ЗН до последней в той же когорте также не было значительным (средний SCr 68 ± 17 против 80 ± 48 мкмоль/л, соответственно, p = 0,489) (18).
МПГН определяет патологический паттерн, характеризующийся субэндотелиальными, субэпителиальными и мезангиальными отложениями иммунных комплексов (из-за инфекций, аутоиммунных или моноклональных нарушений) или комплемента (из-за нарушения регуляции альтернативного пути). Случаи идиопатического МПГН изучались в пяти исследованиях с общим числом пациентов 36 (5–9). Два исследования включали только одного пациента и получили противоположные результаты: неонатальную смерть (6) и физиологическую беременность (7). Другие ретроспективные исследования показали доношенные роды у 50% пациенток, тогда как у 16,7–23,8% были преждевременные роды. Гибель плода чаще встречалась у пациенток с ФСГС и МН, оцененных в тех же исследованиях, с частотой абортов и перинатальной смертностью в 0–11,1% гестаций (5–9).Более того, Barcelò et al. стратифицировали исходы пациентов с MPGN, FSGS и MN на основе протеинурии и обнаружили значительную связь только уровней протеинурии > 2,5 г/сут с преждевременными родами и низкой массой тела при рождении (1930 ± 301 г) (9). .
Случаи идиопатического МПГН изучались в пяти исследованиях с общим числом пациентов 36 (5–9). Два исследования включали только одного пациента и получили противоположные результаты: неонатальную смерть (6) и физиологическую беременность (7). Другие ретроспективные исследования показали доношенные роды у 50% пациенток, тогда как у 16,7–23,8% были преждевременные роды. Гибель плода чаще встречалась у пациенток с ФСГС и МН, оцененных в тех же исследованиях, с частотой абортов и перинатальной смертностью в 0–11,1% гестаций (5–9).Более того, Barcelò et al. стратифицировали исходы пациентов с MPGN, FSGS и MN на основе протеинурии и обнаружили значительную связь только уровней протеинурии > 2,5 г/сут с преждевременными родами и низкой массой тела при рождении (1930 ± 301 г) (9). .
Новые данные получены в ретроспективном исследовании De Castro et al. по 26 беременностям у 19 пациенток с подтвержденным биопсией первичным нефротическим синдромом со средней протеинурией 8,33 ± 6,7 г/день (19).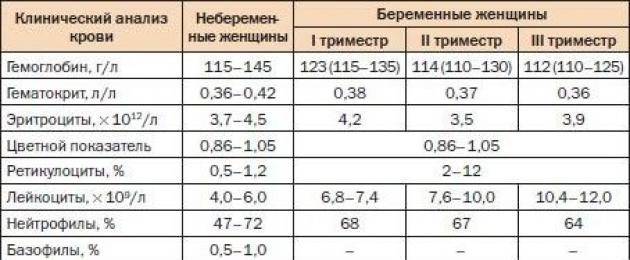 В 26 описанных беременностях наиболее распространенными гломерулопатиями были FSGS (42%), MN (16%) и IgAN (16%), за которыми следовали MCD, MPGN, C3 гломерулонефрит (C3GN) и фибриллярный гломерулонефрит, каждый из которых составляет 5%.Новый диагноз был поставлен у 12 женщин во время беременности при среднем сроке гестации 18,6 ± 9,1 недели, а биопсия почки была выполнена у восьми пациенток при среднем сроке гестации 21 неделя. В этой группе женщин было зарегистрировано только два незначительных осложнения биопсии (гематома и гематурия) по сравнению с одним нежелательным явлением, зарегистрированным у 11 пациенток с патологическим диагнозом до или после беременности (1 небольшая артериовенозная фистула), но процедура оказалась оправданной. риск, поскольку это позволило изменить лечение нефротического синдрома у шести пациентов, начавших преднизолон в дозе от 60 до 120 мг/сут.Одному пациенту с известным C3GN был назначен экулизумаб. Основными описанными неблагоприятными материнскими исходами были преэклампсия (27%), острая почечная недостаточность (ОПП, 23%) и флегмона (12%), которые не были связаны со стероидной терапией.
В 26 описанных беременностях наиболее распространенными гломерулопатиями были FSGS (42%), MN (16%) и IgAN (16%), за которыми следовали MCD, MPGN, C3 гломерулонефрит (C3GN) и фибриллярный гломерулонефрит, каждый из которых составляет 5%.Новый диагноз был поставлен у 12 женщин во время беременности при среднем сроке гестации 18,6 ± 9,1 недели, а биопсия почки была выполнена у восьми пациенток при среднем сроке гестации 21 неделя. В этой группе женщин было зарегистрировано только два незначительных осложнения биопсии (гематома и гематурия) по сравнению с одним нежелательным явлением, зарегистрированным у 11 пациенток с патологическим диагнозом до или после беременности (1 небольшая артериовенозная фистула), но процедура оказалась оправданной. риск, поскольку это позволило изменить лечение нефротического синдрома у шести пациентов, начавших преднизолон в дозе от 60 до 120 мг/сут.Одному пациенту с известным C3GN был назначен экулизумаб. Основными описанными неблагоприятными материнскими исходами были преэклампсия (27%), острая почечная недостаточность (ОПП, 23%) и флегмона (12%), которые не были связаны со стероидной терапией.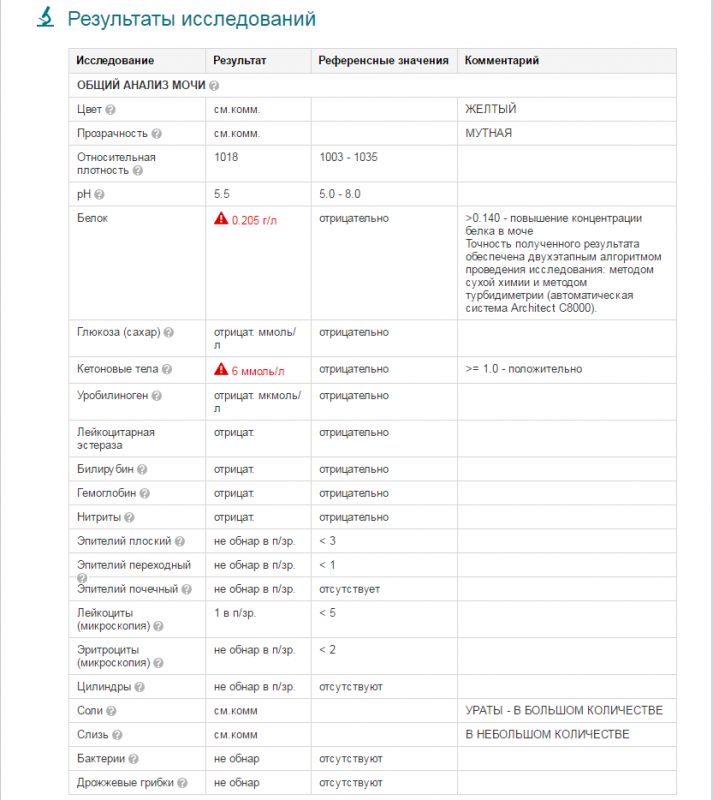 На ФСГС приходилось половина эпизодов ОПП, один из которых прогрессировал до ТХПН, тогда как остальные произошли у пациентов с ИГАН и Х3ГН. Исходы плода включали преждевременные роды и низкую массу тела при рождении (менее 2500 г) в 54% беременностей, задержку внутриутробного развития плода (ЗВУР) в 11% и госпитализацию в ОИТН в 31%.Два случая преждевременного разрыва плодных оболочек были выявлены у пациентов, получавших высокие дозы глюкокортикоидов. В этой когорте MN подтвердила лучшие результаты выживаемости матери и плода и почек, у трех пациенток был стабильный уровень креатинина в сыворотке во время беременности и временное увеличение протеинурии, которая вернулась к нефротическим уровням через год после родов. Статистический анализ факторов риска всей когорты подтвердил сильную связь протеинурии с неблагоприятными исходами, такими как преэклампсия ( p = 0.002), низкий вес при рождении ( p = 0,002) и преждевременные роды ( p = 0,02) (19).
На ФСГС приходилось половина эпизодов ОПП, один из которых прогрессировал до ТХПН, тогда как остальные произошли у пациентов с ИГАН и Х3ГН. Исходы плода включали преждевременные роды и низкую массу тела при рождении (менее 2500 г) в 54% беременностей, задержку внутриутробного развития плода (ЗВУР) в 11% и госпитализацию в ОИТН в 31%.Два случая преждевременного разрыва плодных оболочек были выявлены у пациентов, получавших высокие дозы глюкокортикоидов. В этой когорте MN подтвердила лучшие результаты выживаемости матери и плода и почек, у трех пациенток был стабильный уровень креатинина в сыворотке во время беременности и временное увеличение протеинурии, которая вернулась к нефротическим уровням через год после родов. Статистический анализ факторов риска всей когорты подтвердил сильную связь протеинурии с неблагоприятными исходами, такими как преэклампсия ( p = 0.002), низкий вес при рождении ( p = 0,002) и преждевременные роды ( p = 0,02) (19).
Самое последнее ретроспективное исследование, проведенное Liu et al.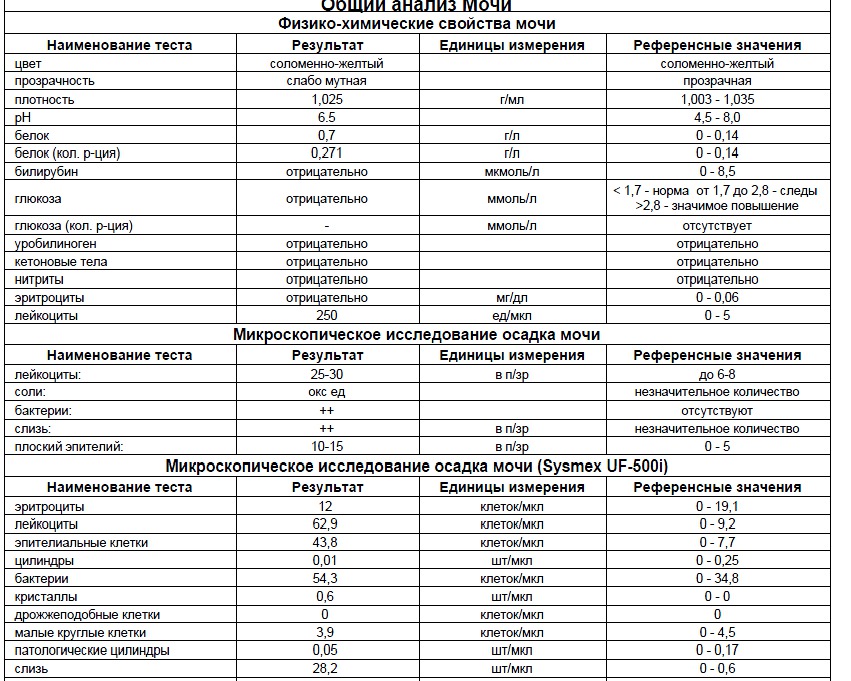 сообщили о сохраненной функции почек, но о возникновении неблагоприятных осложнений со стороны матери и плода, включая потерю плода (11%), преждевременные роды (26%) и тяжелую преэклампсию (15%) при 27 беременностях с 2008 по 2018 год в когорте женщин, страдающих ЗН. (20). В соответствии с наблюдениями Де Кастро (19), Лю также продемонстрировал корреляцию протеинурии до 20-й недели (предполагалось, что как усредненный по времени белок мочи, ОШ 67.5, р < 0,001; максимальная протеинурия >3,5 г/сут, ОШ 29,3, p = 0,001), гипоальбуминемия (усредненный по времени альбумин, ОШ 67,5, p < 0,001; минимум сывороточного альбумина <25 г/л, ОШ 10,9, p = 0,01) и отсутствие ремиссии при беременности (ОШ 21,6, p = 0,004) с неблагоприятными исходами для матери и плода. В частности, усредненная по времени протеинурия и сывороточный альбумин были связаны с процентилем массы тела при рождении новорожденных. Кроме того, положительная реакция на антитело против PLA2R ( p = 0.
сообщили о сохраненной функции почек, но о возникновении неблагоприятных осложнений со стороны матери и плода, включая потерю плода (11%), преждевременные роды (26%) и тяжелую преэклампсию (15%) при 27 беременностях с 2008 по 2018 год в когорте женщин, страдающих ЗН. (20). В соответствии с наблюдениями Де Кастро (19), Лю также продемонстрировал корреляцию протеинурии до 20-й недели (предполагалось, что как усредненный по времени белок мочи, ОШ 67.5, р < 0,001; максимальная протеинурия >3,5 г/сут, ОШ 29,3, p = 0,001), гипоальбуминемия (усредненный по времени альбумин, ОШ 67,5, p < 0,001; минимум сывороточного альбумина <25 г/л, ОШ 10,9, p = 0,01) и отсутствие ремиссии при беременности (ОШ 21,6, p = 0,004) с неблагоприятными исходами для матери и плода. В частности, усредненная по времени протеинурия и сывороточный альбумин были связаны с процентилем массы тела при рождении новорожденных. Кроме того, положительная реакция на антитело против PLA2R ( p = 0.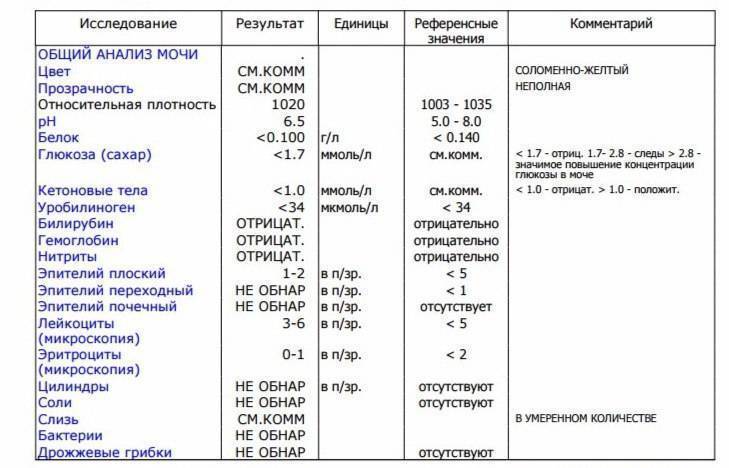 03) оказался специфическим фактором риска для беременных пациенток с ЗН (20). Интересно, что отчет о пациентке с PLA2R-положительной МН во время беременности продемонстрировал трансплацентарное прохождение этих аутоантител, которые были обнаружены в пуповинной крови плода (21). Сачдева и др. подтвердили это открытие в новом клиническом случае, а также показали передачу PLA2R новорожденному во время грудного вскармливания, что вызывает вопросы о возможности этой практики и проверки титра PLA2R, сывороточного альбумина и анализа мочи у детей матерей, пораженных первичной ЗН (22) .
03) оказался специфическим фактором риска для беременных пациенток с ЗН (20). Интересно, что отчет о пациентке с PLA2R-положительной МН во время беременности продемонстрировал трансплацентарное прохождение этих аутоантител, которые были обнаружены в пуповинной крови плода (21). Сачдева и др. подтвердили это открытие в новом клиническом случае, а также показали передачу PLA2R новорожденному во время грудного вскармливания, что вызывает вопросы о возможности этой практики и проверки титра PLA2R, сывороточного альбумина и анализа мочи у детей матерей, пораженных первичной ЗН (22) .
Симптоматическое лечение нефротического синдрома у беременных
При первичном гломерулонефрите может потребоваться назначение иммунодепрессантов, таких как микофеноловая кислота и циклофосфамид, тератогенный риск которых известен, и поэтому их следует заменить до беременности (23). Следует избегать применения моноклональных антител, таких как анти-CD20 ритуксимаб, из-за их трансплацентарного транспорта в последних триместрах беременности, что может вызвать временное истощение В-клеток у плода (24).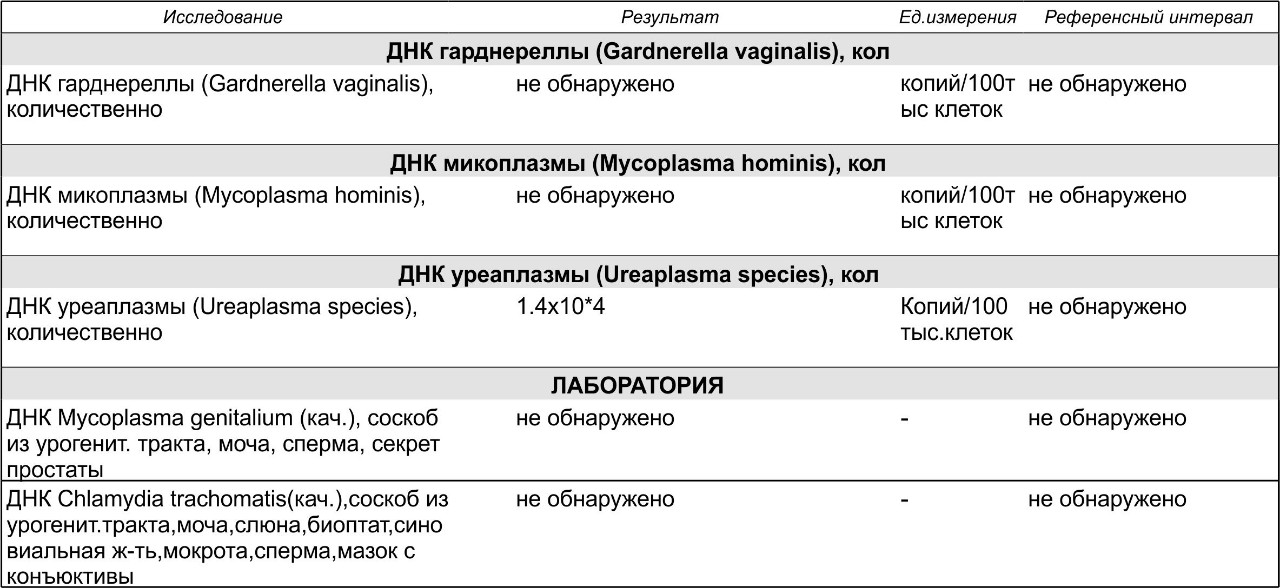 И наоборот, кортикостероиды с коротким периодом полувыведения, такие как преднизолон и метилпреднизолон, считаются приемлемой альтернативой из-за их инактивации плацентарной 11β-гидроксистероиддегидрогеназой типа 2, которая предотвращает неблагоприятное воздействие стероидов на плод (23). Ингибиторы кальциневрина (CNI), такие как циклоспорин (CsA) или такролимус (TAC), кажутся безопасными, без доказательств повышенного риска тератогенного действия (25), а экспериментальные модели на крысах показывают, как трансплацентарное прохождение CsA нарушается P-гликопротеином. (26).
И наоборот, кортикостероиды с коротким периодом полувыведения, такие как преднизолон и метилпреднизолон, считаются приемлемой альтернативой из-за их инактивации плацентарной 11β-гидроксистероиддегидрогеназой типа 2, которая предотвращает неблагоприятное воздействие стероидов на плод (23). Ингибиторы кальциневрина (CNI), такие как циклоспорин (CsA) или такролимус (TAC), кажутся безопасными, без доказательств повышенного риска тератогенного действия (25), а экспериментальные модели на крысах показывают, как трансплацентарное прохождение CsA нарушается P-гликопротеином. (26).
Ингибиторы ангиотензинпревращающего фермента (ИАПФ) и/или блокаторы рецепторов ангиотензина II (БРА) широко рекомендуются в руководствах KDIGO в качестве терапии первой линии нефротического синдрома из-за их нефрозащитного действия (27). Их тератогенное действие на сердечно-сосудистую, мочевыделительную, скелетную и центральную нервную системы делает их противопоказанными при беременности, особенно во втором триместре беременности, поэтому рекомендуется немедленно прекратить их прием в начале беременности (28–30).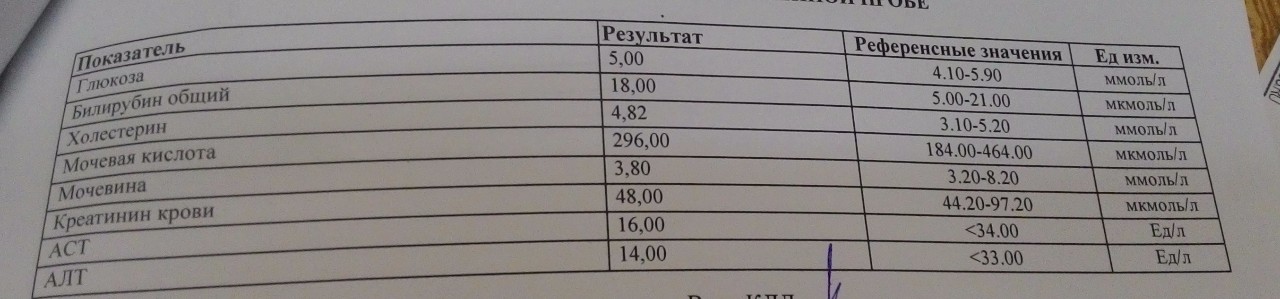 Hoeltzenbein и др. провели проспективное обсервационное исследование, в котором сравнивали 329 женщин, случайно подвергшихся воздействию иАПФ в течение первого триместра беременности и не дольше 20-й недели, и 654 контрольных беременных женщин без артериальной гипертензии в анамнезе (31). Значительно возросшая частота серьезных врожденных дефектов в когорте иАПФ подтвердила результаты предыдущих исследований этих препаратов при беременности (32, 33), но они также исследовали влияние материнской гипертонии на пороки развития, уже продемонстрированное в других исследованиях (34, 35).Сравнивая пациентов с хронической гипертензией, подвергавшихся воздействию иАПФ, и пациентов, получавших метилдопу, они пришли к выводу, что частота пороков развития существенно не отличалась, что также указывает на потенциальную роль тяжелой гипертензии как таковой как фактора риска неблагоприятных исходов для плода (31).
Hoeltzenbein и др. провели проспективное обсервационное исследование, в котором сравнивали 329 женщин, случайно подвергшихся воздействию иАПФ в течение первого триместра беременности и не дольше 20-й недели, и 654 контрольных беременных женщин без артериальной гипертензии в анамнезе (31). Значительно возросшая частота серьезных врожденных дефектов в когорте иАПФ подтвердила результаты предыдущих исследований этих препаратов при беременности (32, 33), но они также исследовали влияние материнской гипертонии на пороки развития, уже продемонстрированное в других исследованиях (34, 35).Сравнивая пациентов с хронической гипертензией, подвергавшихся воздействию иАПФ, и пациентов, получавших метилдопу, они пришли к выводу, что частота пороков развития существенно не отличалась, что также указывает на потенциальную роль тяжелой гипертензии как таковой как фактора риска неблагоприятных исходов для плода (31).
Безопасный вариант поддержания артериального давления у беременных с ХБП в пределах значений 135/85 мм рт. ст. представлен блокаторами α2-адренорецепторов, такими как метилдопа, тогда как клонидин может влиять на рост плода, и его обычно избегают при высоком риске гипертонической болезни. отскок при прекращении.Другие антигипертензивные средства представлены блокаторами кальция, такими как нифедипин длительного действия или лабеталол, комбинированный α- и β-блокатор, с эффективностью и безопасностью, сравнимыми с метилдопой. Другие β-адреноблокаторы представляют собой препараты второго выбора из-за риска нежелательных явлений у новорожденных (обычно транзиторной брадикардии, артериальной гипотензии и гипогликемии). Диуретики обычно избегают во время беременности и могут быть назначены при нефротическом синдроме, рефрактерном к иммуносупрессивной терапии, под строгим контролем, чтобы избежать снижения объема жидкости и риска ОПП.
ст. представлен блокаторами α2-адренорецепторов, такими как метилдопа, тогда как клонидин может влиять на рост плода, и его обычно избегают при высоком риске гипертонической болезни. отскок при прекращении.Другие антигипертензивные средства представлены блокаторами кальция, такими как нифедипин длительного действия или лабеталол, комбинированный α- и β-блокатор, с эффективностью и безопасностью, сравнимыми с метилдопой. Другие β-адреноблокаторы представляют собой препараты второго выбора из-за риска нежелательных явлений у новорожденных (обычно транзиторной брадикардии, артериальной гипотензии и гипогликемии). Диуретики обычно избегают во время беременности и могут быть назначены при нефротическом синдроме, рефрактерном к иммуносупрессивной терапии, под строгим контролем, чтобы избежать снижения объема жидкости и риска ОПП.
Что касается инфузии альбумина при нефротическом синдроме у беременных, ни одно исследование не дает окончательных выводов о его потенциальной пользе. Напротив, следует учитывать риск гиперфильтрации с парадоксальным увеличением протеинурии, что препятствует систематическому использованию альбумина в этих условиях (36, 37).
Нефротический синдром также характеризуется состоянием гиперкоагуляции, которое необходимо лечить, когда уровень альбумина ниже 2 г/дл. Низкомолекулярный гепарин является обоснованным выбором как для профилактики, так и для лечения тромбоэмболических осложнений во время беременности и после родов, поскольку он не проникает через плаценту.Гепарин следует прекратить перед индукцией родов или плановым кесаревым сечением, но его можно возобновить после родов (38). Во время беременности низкие дозы ацетилсалицилата также являются полезным вариантом профилактики преэклампсии у пациенток с высоким риском, таких как ХБП и протеинурия. Несмотря на рекомендации, предлагающие начинать терапию после первого триместра, чтобы избежать риска геморрагии в случае самопроизвольных абортов, защитный эффект на плаценту выше при раннем начале приема ацетилсалицилата (39, 40).
Положительный эффект низкобелковой диеты с добавками аминокислот и кетокислот у беременных с ХБП следует рассматривать как терапевтический вариант при отсутствии специфической антипротеинурической терапии (41, 42).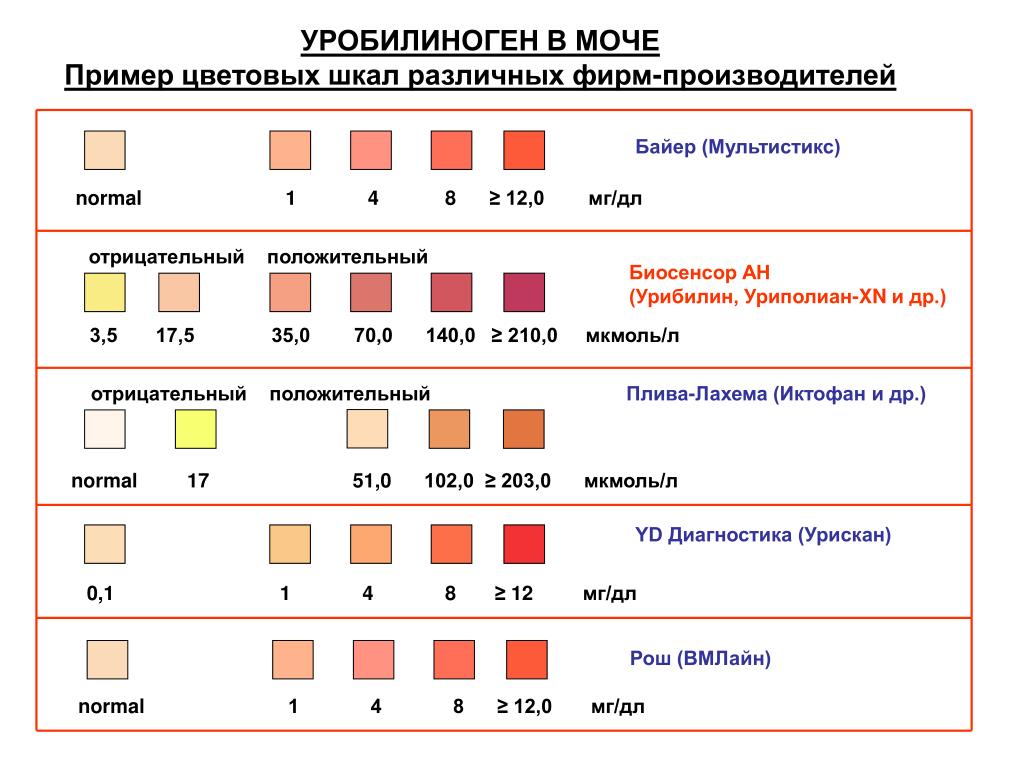
Выводы
Наш обзор был сосредоточен на результатах выживаемости матери и плода и почек у беременных с нефротическим синдромом (таблица 1). Исходные уровни протеинурии, а также артериальная гипертензия и стадия ХБП являются наиболее важными факторами риска неблагоприятных исходов, что подтверждено в других исследованиях с участием беременных женщин с ХБП.Частота кесарева сечения и преждевременных родов выше, чем в контрольной группе здоровых женщин, о чем свидетельствуют данные Piccoli et al. в проспективном исследовании у пациенток с ХБП (54,8 и 33,4% соответственно) (43). Среди нефротических синдромов МН оказался наиболее благоприятным с точки зрения исходов, тогда как МПГН и ФСГС подвергают пациентов более высокой степени как материнско-плодовых, так и почечных нежелательных явлений. Адекватное консультирование представляется необходимым для повышения осведомленности женщин о пользе планирования беременности для управления потенциальной тератогенной терапией и для сведения к минимуму рисков гестационных осложнений и прогрессирования заболевания, особенно если полная и стабильная ремиссия не достигается до зачатия. Необходимы дополнительные проспективные исследования, чтобы лучше оценить конкретные предикторы тяжелых неблагоприятных исходов и достичь статистической значимости после стратификации отдельных факторов риска.
Необходимы дополнительные проспективные исследования, чтобы лучше оценить конкретные предикторы тяжелых неблагоприятных исходов и достичь статистической значимости после стратификации отдельных факторов риска.
Таблица 1 . Ретроспективные исследования первичного нефротического синдрома и материнско-плодовых и почечных исходов.
Вклад авторов
RS, GG и DS: концептуализация и написание — подготовка первоначального проекта. RS, VC, GG и DS: методология. РС и ДС: расследование. РГ и ДС: ресурсы.RS, RG и VC: курирование данных. RS, RG, AS, FT, VC и DS: написание — обзор и редактирование. RS, RG, AS, FT и DS: визуализация. RG, DS и GG: супервизия. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Каталожные номера
3. Американский колледж акушеров и гинекологов, Целевая группа по гипертензии во время беременности.Гипертония при беременности. Отчет Целевой группы Американского колледжа акушеров и гинекологов по гипертонии у беременных. Акушерство Гинекол . (2013) 122:1122–31. doi: 10.1097/01.AOG.0000437382.03963.88
Полнотекстовая перекрестная ссылка | Академия Google
6. Абэ С., Амагасаки Ю., Кониши К., Като Э., Сакагучи Х., Иёри С. Влияние предшествующего заболевания почек на беременность. Am J Акушер-гинеколог. (1985) 153:508–14. дои: 10.1016/0002-9378(85)
-6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
7.Алексопулос Э., Били Х., Тампакудис П., Экономиду Д., Сакеллариу Г., Манталенакис С. и др. Исходы беременности у женщин с гломерулярными заболеваниями. Почечная недостаточность. (1996) 19:121–9. дои: 10.3109/088602296082
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
8. Surian M, Imbasciati E, Cosci P, Banfi G, Barbiano di Belgiojoso G, Brancaccio D, et al. Гломерулярная болезнь и беременность. Изучение 123 беременностей у пациенток с первичными и вторичными гломерулярными заболеваниями. Нефрон. (1984) 36:101–5. дои: 10.1159/000183126
Surian M, Imbasciati E, Cosci P, Banfi G, Barbiano di Belgiojoso G, Brancaccio D, et al. Гломерулярная болезнь и беременность. Изучение 123 беременностей у пациенток с первичными и вторичными гломерулярными заболеваниями. Нефрон. (1984) 36:101–5. дои: 10.1159/000183126
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10. Кинкейд-Смит П., Фэрли К.Ф. Заболевания почек при беременности. Три спорные области: мезангиальная IgA-нефропатия, очаговый гломерулярный склероз (очаговый и сегментарный гиалиноз и склероз) и рефлюкс-нефропатия. Am J Kidney Dis. (1987) 9:328–33. doi: 10.1016/S0272-6386(87)80131-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
11.Packham DK, North RA, Fairley KF, Ihle BU, Whitworth JA, Kincaid-Smith P. Беременность у женщин с первичным очаговым и сегментарным гиалинозом и склерозом. Клин Нефрол. (1988) 29:185–92.
Реферат PubMed | Академия Google
12. Jungers P, Houillier P, Forget D, Henry-Amar M. Особые разногласия относительно естественного течения болезни почек во время беременности. Am J Kidney Dis. (1991) 17:116–22. doi: 10.1016/S0272-6386(12)81114-0
Jungers P, Houillier P, Forget D, Henry-Amar M. Особые разногласия относительно естественного течения болезни почек во время беременности. Am J Kidney Dis. (1991) 17:116–22. doi: 10.1016/S0272-6386(12)81114-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
13.Малик Г.Х., Аль-Мохая С., Аль-Вакиль Дж., Шейх Дж.Ф., Аль-Хозайм В., Аль-Духаими Х. и др. Повторные беременности у пациенток с первично-очаговым сегментарным гломерулосклерозом. Индийский J Нефрол. (2002) 12:33–9.
14. О’Шонесси М.М., Джобсон М.А., Симс К., Либерти А.Л., Нахман П.Х., Пендерграфт В.Ф. Исходы беременности у пациентов с гломерулярной болезнью, посещающих один академический центр в Северной Каролине. Am J Нефрол. (2017) 45:442–51. дои: 10.1159/000471894
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
17.Packham DK, North RA, Fairley KF, Whitworth JA, Kincaid-Smith P. Мембранозный гломерулонефрит и беременность.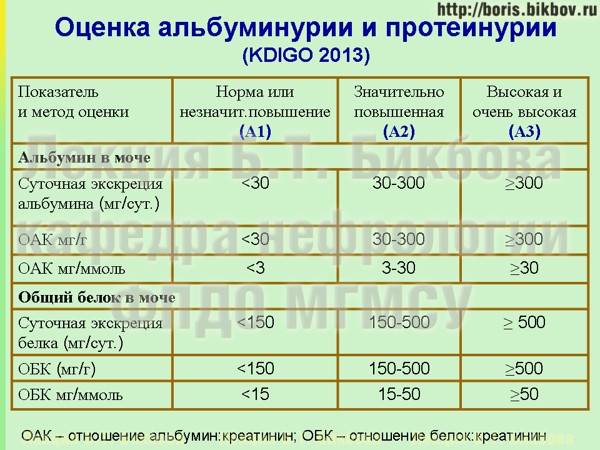 Клин Нефрол . (1987) 28:56–64.
Клин Нефрол . (1987) 28:56–64.
Реферат PubMed | Академия Google
18. Малик Г.Х., Аль-Харби А.С., Аль-Мохая С., Аль-Вакиль Дж., Аль-Хозаим В., Кехрид М. и др. Повторные беременности у больных первичным мембранозным гломерулонефритом. Нефрон. (2002) 91:21–4. дои: 10.1159/000057600
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
19.Де Кастро И., Истерлинг Т.Р., Бансал Н., Джефферсон Дж.А. Нефротический синдром во время беременности представляет риск осложнений как для матери, так и для плода. Почки, внутр. (2017) 91:1464–72. doi: 10.1016/j.kint.2016.12.019
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
21. Al-Rabadi L, Ayalon R, Bonegio RG, Ballard JE, Fujii AM, Henderson JM, et al. Беременность у пациентки с первичной мембранозной нефропатией и циркулирующими антителами против PLA2R: клинический случай. Am J Kidney Dis .(2016) 67:775–8. doi: 10.1053/j.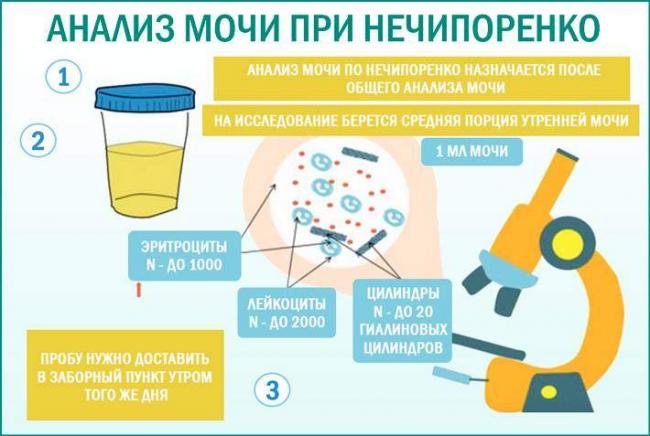 ajkd.2015.10.031
ajkd.2015.10.031
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
22. Sachdeva M, Beck LH, Jr, Miller I, Bijol V, Fishbane S. Фосфолипаза A 2 рецептор-положительная беременность: клинический случай. Am J Kidney Dis. (2020) 76: 586–9. doi: 10.1053/j.ajkd.2019.11.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
25. Shah S, Venkatesan RL, Gupta A, Sanghavi MK, Welge J, Johansen R, et al.Исходы беременности у женщин с трансплантацией почки: метаанализ и систематический обзор. BMC Нефрол. (2019) 20:24. doi: 10.1186/s12882-019-1213-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
26. Павек П., Фендрих З., Стауд Ф., Малакова Дж., Брозманова Х., Лазничек М. и соавт. Влияние Р-гликопротеина на трансплацентарное прохождение циклоспорина. J Фарм. наук. (2001) 90:1583–92. doi: 10.1002/jps.1108
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
27. Заболевание почек: улучшение глобальных результатов (KDIGO) Рабочая группа по гломерулонефриту. Клиническое практическое руководство KDIGO по гломерулонефриту. Почки Int Suppl . (2012) 2:139–274. doi: 10.1038/kisup.2012.9
Заболевание почек: улучшение глобальных результатов (KDIGO) Рабочая группа по гломерулонефриту. Клиническое практическое руководство KDIGO по гломерулонефриту. Почки Int Suppl . (2012) 2:139–274. doi: 10.1038/kisup.2012.9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29. Льюис Г., Максвелл А.П. Должны ли женщины с диабетической нефропатией, планирующие беременность, продолжать терапию ингибиторами АПФ или блокаторами рецепторов ангиотензина II до подтверждения беременности? Диабетология. (2014) 57:1082–3. doi: 10.1007/s00125-014-3188-x
Полнотекстовая перекрестная ссылка | Академия Google
30. Cooper WO, Hernandez-Diaz S, Arbogast PG, Dudley JA, Dyer S, Gideon PS, et al. Основные врожденные пороки развития после воздействия ингибиторов АПФ в первом триместре. N Engl J Med. (2006) 354:2443–51 doi: 10.1056/NEJMoa055202
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
31. Hoeltzenbein M, Tissen-Diabaté T, Fietz A.-K, Zinke S, Kayser A, et al.Увеличение частоты врожденных дефектов после применения ингибиторов ангиотензинпревращающего фермента в первом триместре – лечение или гипертония? Обсервационное когортное исследование. Беременность Гипертензия. (2018) 13:65–71. doi: 10.1016/j.preghy.2018.04.022
Hoeltzenbein M, Tissen-Diabaté T, Fietz A.-K, Zinke S, Kayser A, et al.Увеличение частоты врожденных дефектов после применения ингибиторов ангиотензинпревращающего фермента в первом триместре – лечение или гипертония? Обсервационное когортное исследование. Беременность Гипертензия. (2018) 13:65–71. doi: 10.1016/j.preghy.2018.04.022
Полнотекстовая перекрестная ссылка | Академия Google
32. Бейтман Б.Т., Паторно Э., Десаи Р.Дж., Сили Э.В., Могун Х., Дежене С.З. и др. Ингибиторы ангиотензинпревращающего фермента и риск врожденных пороков развития. Акушер-гинеколог. (2017) 129: 174–84.doi: 10.1097/AOG.0000000000001775
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
33. Ли Д.К., Ян С., Андраде С., Таварес В., Фербер Дж.Р. Воздействие на мать ингибиторов ангиотензинпревращающего фермента в первом триместре и риск пороков развития у потомства: ретроспективное когортное исследование. БМЖ. (2011) 343:d5931. дои: 10.1136/bmj.d5931
дои: 10.1136/bmj.d5931
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
34. Бейтман Б.Т., Хайбрехтс К.Ф., Фишер М.А., Сили Э.В., Экер Дж.Л., Оберг А.С. и соавт.Хроническая артериальная гипертензия во время беременности и риск врожденных пороков развития: когортное исследование. Am J Акушер-гинеколог. (2015) 212:337 e1–14. doi: 10.1016/j.ajog.2014.09.031
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
35. Рамакришнан А., Ли Л.Дж., Митчелл Л.Е., Агопиан А.Дж. Материнская гипертония во время беременности и риск врожденных пороков сердца у потомства: систематический обзор и метаанализ. Педиатр Кардиол. (2015) 36:1442–51.doi: 10.1007/s00246-015-1182-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
37. Cabiddu G, Castellino S, Gernone G, Santoro D, Moroni G, Giannattasio M, et al. Заявление о передовой практике в отношении беременности при хроническом заболевании почек: Итальянская исследовательская группа по почкам и беременности.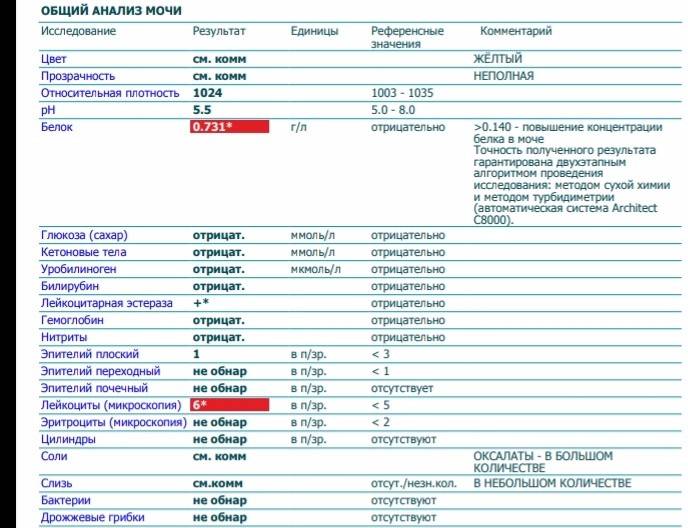 Дж Нефрол. (2016) 29: 277–303. doi: 10.1007/s40620-016-0285-6
Дж Нефрол. (2016) 29: 277–303. doi: 10.1007/s40620-016-0285-6
Полнотекстовая перекрестная ссылка | Академия Google
39. Хендерсон Дж.Т., Уитлок Э.П., О’Коннер Э., Сенгер К.А., Томпсон Дж.Х., Роуленд М.Г. Низкие дозы аспирина для профилактики заболеваемости и смертности от преэклампсии: систематический обзор данных для Целевой группы профилактических служб США . Роквилл, Мэриленд: Агентство медицинских исследований и качества (США). Отчет №: 14-05207-ЭФ-1 (2014).
Академия Google
40. Роберж С., Вилла П., Николаидес К., Жигер Ю., Вайнио М., Бакти А. и др. Раннее назначение низких доз аспирина для профилактики преждевременной и доношенной преэклампсии: систематический обзор и метаанализ. Диагностика плода Ther. (2012) 31:141–6. дои: 10.1159/000336662
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
41. Аттини Р., Леоне Ф., Монтерсино Б., Фассио Ф., Минелли Ф., Колла Л. и соавт. Беременность, протеинурия, растительные добавки и фокально-сегментарный гломерулосклероз: отчет о трех случаях и критическая оценка литературы. Питательные вещества. (2017) 9:E770. дои: 10.3390/nu
Питательные вещества. (2017) 9:E770. дои: 10.3390/nu
70
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
42.Аттини Р., Монтерсино Б., Леоне Ф., Минелли Ф., Фассио Ф., Россетти М.М. и др. Диализ или растительная диета при прогрессирующей ХБП во время беременности? Описание случая и критическая оценка литературы. J Clin Med. (2019) 8:123. doi: 10.3390/jcm8010123
Полнотекстовая перекрестная ссылка | Академия Google
43. Piccoli GB, Cabiddu G, Attini R, Vigotti FN, Maxia S, Lepori N, et al. Риск неблагоприятных исходов беременности у женщин с ХБП. J Am Soc Нефрол. (2015) 26:2011–22.doi: 10.1681/ASN.2014050459
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Потребность в белках и аминокислотах во время беременности | Достижения в области питания
Аннотация
Белок является важным компонентом здоровой диеты человека, поддерживая как рост, так и поддержание жизнедеятельности. Во время беременности, исключительного этапа жизни, характеризующегося быстрым ростом и развитием, достаточное количество белка в рационе имеет решающее значение для обеспечения здорового исхода.Отложение белка в тканях матери и плода увеличивается на протяжении всей беременности, чаще всего в третьем триместре. Рекомендации по потреблению пищевого белка основаны на факторных оценках, поскольку традиционный метод определения потребности в белке, баланс азота, является инвазивным и нежелательным во время беременности. Текущие расчетные средние потребности и рекомендации RDA, равные 0,88 и 1,1 г · кг -1 · d -1 , соответственно, предназначены для всех стадий беременности.Единая рекомендация не учитывает меняющиеся потребности на разных стадиях беременности. Недавно, с использованием минимально инвазивного метода окисления индикаторных аминокислот, мы определили потребность в среднем в 1,2 и 1,52 г · кг -1 · d -1 в ранние (∼16 недель) и поздние (~36 недель) стадии беременности соответственно.
Во время беременности, исключительного этапа жизни, характеризующегося быстрым ростом и развитием, достаточное количество белка в рационе имеет решающее значение для обеспечения здорового исхода.Отложение белка в тканях матери и плода увеличивается на протяжении всей беременности, чаще всего в третьем триместре. Рекомендации по потреблению пищевого белка основаны на факторных оценках, поскольку традиционный метод определения потребности в белке, баланс азота, является инвазивным и нежелательным во время беременности. Текущие расчетные средние потребности и рекомендации RDA, равные 0,88 и 1,1 г · кг -1 · d -1 , соответственно, предназначены для всех стадий беременности.Единая рекомендация не учитывает меняющиеся потребности на разных стадиях беременности. Недавно, с использованием минимально инвазивного метода окисления индикаторных аминокислот, мы определили потребность в среднем в 1,2 и 1,52 г · кг -1 · d -1 в ранние (∼16 недель) и поздние (~36 недель) стадии беременности соответственно. Хотя требования значительно выше текущих рекомендаций, наши значения составляют ∼14–18% от общей энергии и соответствуют допустимому диапазону распределения макронутриентов.Используя свиней в качестве модели животных, мы показали, что потребность в нескольких незаменимых аминокислотах резко возрастает на поздних сроках беременности по сравнению с ранними сроками беременности. Дополнительные исследования следует проводить во время беременности, чтобы подтвердить вновь установленные потребности в белке и определить потребность в незаменимых аминокислотах во время беременности у человека.
Хотя требования значительно выше текущих рекомендаций, наши значения составляют ∼14–18% от общей энергии и соответствуют допустимому диапазону распределения макронутриентов.Используя свиней в качестве модели животных, мы показали, что потребность в нескольких незаменимых аминокислотах резко возрастает на поздних сроках беременности по сравнению с ранними сроками беременности. Дополнительные исследования следует проводить во время беременности, чтобы подтвердить вновь установленные потребности в белке и определить потребность в незаменимых аминокислотах во время беременности у человека.
Введение
Белок является важным компонентом здоровой диеты человека, поддерживая как рост, так и поддержание жизнедеятельности.Белок в организме играет структурную (кератин, коллаген) и функциональную (ферменты, транспортные белки, гормоны) роли (1, 2). В конечном счете, большая часть белка млекопитающих состоит из 20 различных аминокислот, и поэтому нашему организму необходимо как достаточное количество аминокислот, так и общий белок (азот). Текущее определение потребности в белке выглядит следующим образом: «наименьший уровень потребления пищевого белка, который уравновешивает потери азота из организма и, таким образом, поддерживает белковую массу тела у лиц с энергетическим балансом при умеренном уровне физической активности, плюс , у детей или у беременных или кормящих женщин потребности, связанные с отложением тканей или секрецией молока со скоростью, соответствующей хорошему здоровью» (2).Таким образом, во время беременности, исключительного этапа жизни, характеризующегося быстрым ростом и развитием и огромными физиологическими изменениями матери с момента зачатия до рождения, достаточное количество пищевого белка имеет решающее значение для обеспечения здорового исхода.
Текущее определение потребности в белке выглядит следующим образом: «наименьший уровень потребления пищевого белка, который уравновешивает потери азота из организма и, таким образом, поддерживает белковую массу тела у лиц с энергетическим балансом при умеренном уровне физической активности, плюс , у детей или у беременных или кормящих женщин потребности, связанные с отложением тканей или секрецией молока со скоростью, соответствующей хорошему здоровью» (2).Таким образом, во время беременности, исключительного этапа жизни, характеризующегося быстрым ростом и развитием и огромными физиологическими изменениями матери с момента зачатия до рождения, достаточное количество пищевого белка имеет решающее значение для обеспечения здорового исхода.
В течение нескольких недель после зачатия происходит перестройка белкового обмена для поддержки роста и развития плода при сохранении материнского гомеостаза и подготовке к лактации (3). Утилизация белков из пищи и их отложение в новых тканях зависят от энергии на стадиях абсорбции, транспорта аминокислот, синтеза белков и протеолиза. Таким образом, питание во время беременности должно содержать достаточно энергии и белка, чтобы обеспечить доношенное рождение здорового ребенка. Дополнительная энергия, необходимая в течение всего срока беременности, оценивается примерно в 77 000 ккал (4), хотя энергетические затраты во время беременности распределяются неравномерно на протяжении всего гестационного периода. Это связано с тем, что количество белка, депонируемого в тканях матери и плода, различается во время беременности, с незначительным отложением в первом триместре, постепенным увеличением во втором триместре и большей частью в третьем триместре (5).Таким образом, рекомендации по потреблению белков и аминокислот во время беременности должны быть привязаны к гестационному периоду, с достаточным количеством энергии для удовлетворения всех потребностей.
Таким образом, питание во время беременности должно содержать достаточно энергии и белка, чтобы обеспечить доношенное рождение здорового ребенка. Дополнительная энергия, необходимая в течение всего срока беременности, оценивается примерно в 77 000 ккал (4), хотя энергетические затраты во время беременности распределяются неравномерно на протяжении всего гестационного периода. Это связано с тем, что количество белка, депонируемого в тканях матери и плода, различается во время беременности, с незначительным отложением в первом триместре, постепенным увеличением во втором триместре и большей частью в третьем триместре (5).Таким образом, рекомендации по потреблению белков и аминокислот во время беременности должны быть привязаны к гестационному периоду, с достаточным количеством энергии для удовлетворения всех потребностей.
Метаболизм белков во время беременности
Было рассчитано общее количество дополнительного азота, накопленного во время беременности, при этом 40% материнского прироста белка представлено плодом, плацентой и амниотической жидкостью (6, 7).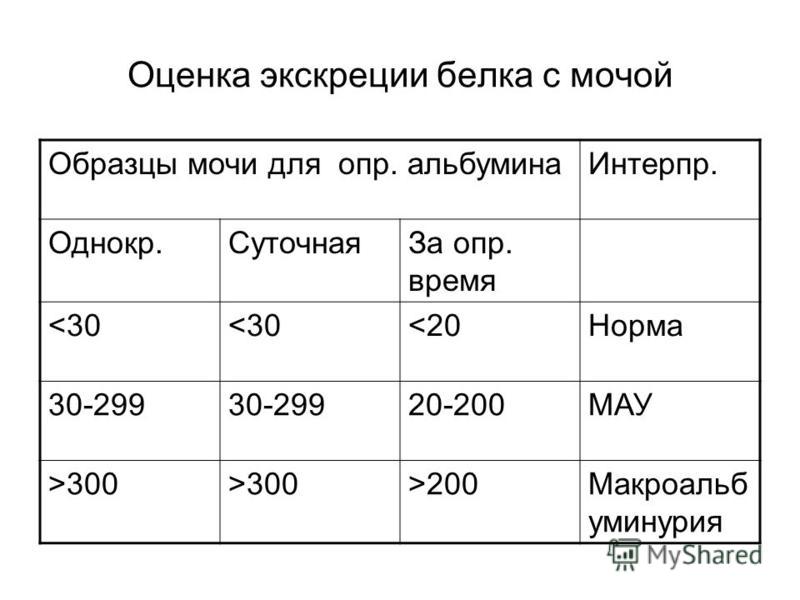 Материнские ткани составляют остальные 60%, включая ткань матки, ткань молочной железы, жировую ткань, увеличение объема крови и внеклеточную жидкость.На основании расчетов Hytten (6), для типичного увеличения массы тела на 12,5 кг во время беременности (включая доношенного ребенка весом 3,3 кг) прирост составляет 148 г азота, что эквивалентно 925 г белка (при с использованием коэффициента пересчета 6,25) (1, 5). Это дополнительное приращение белка матерью предполагает, что должна быть существенная адаптация в белковом обмене, которая имеет место, чтобы приспособиться к этому увеличению. Исследования обмена белка в организме, проведенные с использованием индикаторов стабильных изотопов, показали увеличение обмена белка на ранних сроках беременности у беременных женщин по сравнению с небеременными женщинами (8–13), а также абсолютное увеличение синтеза белка на 15% во второй половине беременности. триместре и 25% в течение третьего триместра (14).Концентрации некоторых аминокислот в материнской плазме (включая незаменимые и незаменимые аминокислоты) снижаются на ранних сроках беременности и сохраняются в низких концентрациях на протяжении всей беременности.
Материнские ткани составляют остальные 60%, включая ткань матки, ткань молочной железы, жировую ткань, увеличение объема крови и внеклеточную жидкость.На основании расчетов Hytten (6), для типичного увеличения массы тела на 12,5 кг во время беременности (включая доношенного ребенка весом 3,3 кг) прирост составляет 148 г азота, что эквивалентно 925 г белка (при с использованием коэффициента пересчета 6,25) (1, 5). Это дополнительное приращение белка матерью предполагает, что должна быть существенная адаптация в белковом обмене, которая имеет место, чтобы приспособиться к этому увеличению. Исследования обмена белка в организме, проведенные с использованием индикаторов стабильных изотопов, показали увеличение обмена белка на ранних сроках беременности у беременных женщин по сравнению с небеременными женщинами (8–13), а также абсолютное увеличение синтеза белка на 15% во второй половине беременности. триместре и 25% в течение третьего триместра (14).Концентрации некоторых аминокислот в материнской плазме (включая незаменимые и незаменимые аминокислоты) снижаются на ранних сроках беременности и сохраняются в низких концентрациях на протяжении всей беременности. Наибольшее снижение наблюдается для глюкогенных аминокислот (аланин, серин, треонин, глутамин и глутамат) и аминокислот в цикле мочевины (аргинин, орнитин, цитруллин) (15). Сопутствующее снижение синтеза мочевины у матери и экскреции мочевины с мочой происходит на ранних сроках беременности, и показатели остаются низкими на протяжении всей беременности (7).Таким образом, предполагается, что усиление синтеза белка в сочетании со снижением катаболизма аминокислот и, следовательно, синтеза мочевины, а также циркулирующие аминокислоты в плазме являются механизмом сохранения общего удержания белка в период экстремальной потребности (т. е. во время беременности) (14). ).
Наибольшее снижение наблюдается для глюкогенных аминокислот (аланин, серин, треонин, глутамин и глутамат) и аминокислот в цикле мочевины (аргинин, орнитин, цитруллин) (15). Сопутствующее снижение синтеза мочевины у матери и экскреции мочевины с мочой происходит на ранних сроках беременности, и показатели остаются низкими на протяжении всей беременности (7).Таким образом, предполагается, что усиление синтеза белка в сочетании со снижением катаболизма аминокислот и, следовательно, синтеза мочевины, а также циркулирующие аминокислоты в плазме являются механизмом сохранения общего удержания белка в период экстремальной потребности (т. е. во время беременности) (14). ).
Метаболическая адаптация белкового обмена, описанная выше, позволяет предположить, что во время беременности у хорошо питающихся женщин общие физиологические изменения способствуют сохранению белка и азота, способствуют накоплению белка и, таким образом, обеспечивают адекватное снабжение плода питательными веществами. Только несколько исследований предоставили какую-либо информацию в условиях изменения диетического питания/наличия основных субстратов синтеза белка (баланс 20 аминокислот). Таким образом, как правильно указал Кинг (3), если потребление белка с пищей ниже некоторого порога, необходимого для метаболической адаптации, тогда у женщин повышен риск неблагоприятных исходов беременности, и может потребоваться соответствующее вмешательство в области питания с адекватным содержанием белка и аминокислот. Действительно, текущая работа Thame, Kurpad и их коллег показала, что кинетика аминокислот изменяется во время подростковой беременности и во время взрослой беременности с низким ИМТ, так что метаболические адаптации недостаточны для поддержания здорового исхода беременности (16–19).Таким образом, определение оптимальных потребностей в белке и аминокислотах на разных этапах беременности имеет решающее значение для создания адекватных рекомендаций по потреблению пищи на этом критическом жизненном этапе.
Только несколько исследований предоставили какую-либо информацию в условиях изменения диетического питания/наличия основных субстратов синтеза белка (баланс 20 аминокислот). Таким образом, как правильно указал Кинг (3), если потребление белка с пищей ниже некоторого порога, необходимого для метаболической адаптации, тогда у женщин повышен риск неблагоприятных исходов беременности, и может потребоваться соответствующее вмешательство в области питания с адекватным содержанием белка и аминокислот. Действительно, текущая работа Thame, Kurpad и их коллег показала, что кинетика аминокислот изменяется во время подростковой беременности и во время взрослой беременности с низким ИМТ, так что метаболические адаптации недостаточны для поддержания здорового исхода беременности (16–19).Таким образом, определение оптимальных потребностей в белке и аминокислотах на разных этапах беременности имеет решающее значение для создания адекватных рекомендаций по потреблению пищи на этом критическом жизненном этапе.
Рекомендации по потреблению белков и аминокислот во время беременности
Рекомендации по потреблению белка для человека представлены в виде оценочной средней потребности (EAR) и RDA (1). EAR — это среднее суточное потребление питательных веществ, которое, по оценкам, удовлетворяет потребность половины здоровых людей на определенном жизненном этапе и в определенной половой группе.RDA — это оценка минимального среднего дневного рациона питания, который удовлетворяет потребности в питательных веществах почти всех (97–98%) здоровых людей на определенном этапе жизни (1).
EAR во время беременности для общего белка основан на потребности взрослого человека в содержании белка в 0,66 г · кг -1 · d -1 , плюс дополнительные потребности в поддержке вновь отложенного белка. Отложение белка во время беременности рассчитывали на основе исследований прироста общего калия в организме у здоровых беременных женщин, которые набрали 13.Масса тела 8 кг к концу третьего триместра должна составлять 12,6 г/сутки (1, 2, 5). Затем повышенная потребность в белке на основе массы тела была оценена как 12,6 г белка/день ÷ 57 кг (контрольная женщина) = +0,22 г белка · кг -1 · день -1 . Это значение было добавлено к EAR для небеременных взрослых 0,66 г белка · кг -1 · d -1 и дало EAR 0,88 г · кг -1 · d -1 (1) во время беременность. RDA была установлена на уровне 1,1 г · кг -1 · d -1 на основе дополнительного потребления 25 г/день (Таблица 1).В отчете ФАО (2), основанном на том же наборе данных об отложении белка во время беременности, рекомендуется дополнительно потреблять 0,7, 9,6 и 31,2 г белка в день в течение первого, второго и третьего триместров соответственно.
ТАБЛИЦА 1Сравнение рекомендаций по белку во время беременности с потребностями, определенными с использованием метода IAAO 1
| . | . | ИААО . | ||
|---|---|---|---|---|
| . | DRI (1), г · кг −1 · d −1 . | г · кг −1 · d −1 . | % энергии . | |
| взрослых ( N = 8) | ||||
| 0.66 | 0.93 | ~ 10 | ||
| RDA | 0.80 | 1.2 | ~13 | |
| Беременные женщины | ||||
| ~ 1611 | ||||
| 916 | ||||
| ухо | 0.88 | 1.22 | ~13 | |
| RDA | 1.1 | 9123 ~ 1,66~18 | ||
| ~36 WK беремец ( N = 19) | ||||
| ухо | 0 .88 | 1.52 | ~17 | |
| RDA | 1.1 | 1.77 | ~20 | |
| . | . | ИААО . | |
|---|---|---|---|
| . | DRI (1), г · кг −1 · d −1 . | г · кг −1 · d −1 . | % энергии . | +
| Взрослые (п = 8) | |||
| + | 0,66 0,93 | + ~10 | |
| RDA 0,80 | 1.2 | ~ 13 | |
| Беременные женщины | |||
| ~ 16119 | |||
| ~ 16119) | |||
| ухо | 0.88 | 1.22 | ~13 |
| RDA | 1.1 | 1.66 | ~18 |
| ~36 WK Gestation ( N = 19) | |||
| ухо | 0,88 | 1.52 | ~ 52 |
| RDA | 1.1 | 1.77 | ~ 201220 |
Сравнение рекомендаций белка во время беременности с требованиями, определенными с помощью метода IAAO 1
| . | . | ИААО . | |||
|---|---|---|---|---|---|
| . | DRI (1), г · кг −1 · d −1 . | г · кг −1 · d −1 . | % энергии . | ||
| взрослых ( N = 8) | |||||
| ухо | 0.66 | 0.93 | ~10 | ||
| RDA | 0.80 | 1.2 | ~13 | ||
| 141220 | |||||
| ~ 16119 | |||||
| ~ 1616 RUS ( N = 17) | |||||
| EAUS | 0,88 | 1.22 | ~13 | ||
| RDA | 1.1 | 1.66 | ~18 | ||
| ~36 WK беремец ( N = 19) | |||||
| EAR | 0.88 | 1.52 | ~17 | ||
| RDA | 1.1 | 1.77 | ~20 | ||
| . | . | ИААО . | ||
|---|---|---|---|---|
| . | DRI (1), г · кг −1 · d −1 . | г · кг −1 · d −1 . | % энергии . | +|
| Взрослые (п = 8) | ||||
| + | 0,66 0,93 | + ~10 | ||
| RDA 0,80 | 1.2 | ~ 13 | ||
| Беременные женщины | ||||
| ~ 16119 | ||||
| ~ 16119) | ||||
| ухо | 0.88 | 1.22 | ~13 | |
| RDA | 1.1 | 1.66 | ~18 | |
| ~36 WK Gestation ( N = 19) | ||||
| ухо | 0.88 | 1.52 | ~17 | |
| RDA | 1.1 | 1.1 | 1.77 | ~ 201220 |
Для наших знаний не было опубликовано никаких опубликованных данных о аминокислотных требованиях во время беременности человека.Обычно считается, что потребность в аминокислотах увеличивается пропорционально увеличению потребности в белке во время беременности. Поскольку EAR беременности для общего белка составляет 0,88 г · кг -1 · d -1 , что в 1,33 раза превышает EAR для взрослых, составляющее 0,66 г · кг -1 · d -1 , каждая отдельная аминокислота значение потребности в кислоте для небеременных взрослых умножается на 1,33 и округляется до ближайшего целого числа (1) (таблица 2). Однако наши исследования на свиньях (22) и моделирование, проведенное другими исследователями (23), показывают, что потребность в одних аминокислотах возрастает больше, чем в других.Следовательно, это предположение о том, что потребность в аминокислотах у человека увеличивается пропорционально потребности в белке во время беременности, вероятно, неверно. Основная причина того, что прямые исследования потребности в аминокислотах во время беременности у людей не проводились, связана с утомительным и громоздким характером традиционных методов (например, азотистого баланса), доступных ранее для определения потребности в белке и аминокислотах.
ТАБЛИЦА 2Рекомендации по потреблению аминокислот во время беременности 1
| Аминокислота . | EAR, 2 мг · кг −1 · d −1 . | RDA, 3 мг · кг −1 · d −1 . |
|---|---|---|
| Гистидин | 15 | 18 |
| Изолейцин | 20 | 25 |
| Лейцин | 45 | 56 |
| Лизин | 41 | 51 |
| Метионин + цистеин | 20 | 25 |
| Фенилаланин + тирозин | 36 | 44 |
| Треонин | 21 | 26 |
| Триптофан | 5 | 7 |
| валин | 25 | 31 |
| Аминокислота . | EAR, 2 мг · кг −1 · d −1 . | RDA, 3 мг · кг −1 · d −1 . |
|---|---|---|
| Гистидин | 15 | 18 |
| Изолейцин | 20 | 25 |
| Лейцин | 45 | 56 |
| Лизин | 41 | 51 |
| Метионин + цистеин | 20 | 25 | +
| Фенилаланин + тирозин | 36 | 44 | +
| Треонин | 21 | 26 | +
| Триптофан | 5 | 7 | +
| валин | 25 | 31 |
| Аминокислота . | EAR, 2 мг · кг −1 · d −1 . | RDA, 3 мг · кг −1 · d −1 . 91 190 |
|---|---|---|
| Гистидин | 15 | 18 |
| Изолейцин | 20 | 25 |
| Лейцин | 45 | 56 |
| Лизин | 41 | 51 |
| Метионин + цистеин | 20 | 25 |
| Фенилаланин + тирозин | 36 | 44 |
| Треонин | 21 | 26 |
| Триптофан | 5 | 7 |
| валин | 25 | 31 |
Методы определения потребности в белке и аминокислотах
Метод баланса азота.
Метод азотистого баланса, который включает измерение потребления и выделения азота, считается золотым стандартом для определения потребности в азоте (белке) (1). Хотя концептуально это элегантная концепция, метод имеет тенденцию недооценивать потребности в белке/аминокислотах, поскольку он переоценивает потребление азота и недооценивает экскрецию азота (1). Кроме того, пул мочевины в организме довольно велик, и для уравновешивания с новым тестируемым потреблением белка требуется 5-7 дней адаптации (24).Длительность адаптации делает метод громоздким и трудоемким, а также он не подходит для изучения уязвимых групп населения, в том числе беременных. Кроме того, при тестировании диапазона потребления белка было показано, что эффективность использования белка снижается почти до нулевого баланса азота (25). По мере увеличения потребления азота кривая отклика азота становится нелинейной, и анализ данных баланса с помощью линейной регрессии может быть ошибочным. В большинстве ранних исследований баланса потребление белка было близко к нулю, и, таким образом, точка пересечения, обычно определяемая линейной интерполяцией, приводит к недооценке истинного баланса (26) и, следовательно, потребности.
Текущие рекомендации по потребности в белке для взрослых людей установлены на уровне EAR и RDA 0,66 и 0,80 г · кг −1 · d −1 соответственно как DRI (1), так и FAO (1) (Таблица 1). Эти рекомендации были разработаны путем подгонки модели линейного регрессионного анализа к более ранним данным баланса азота у мужчин, где в качестве критерия адекватности питания использовался нулевой баланс азота (26). Рэнд и др. (26), хотя и признавая, что у этого анализа могут быть некоторые ограничения, для окончательного анализа были выбраны исследования, в которых было получено тестовое потребление с нулевым балансом.Хумаюн и др. (20) включали дополнительные исследования баланса азота, в которых проверялось более высокое потребление исследуемого белка, и выполняли повторный анализ с использованием модели двухфазного линейного регрессионного анализа. В результате повторного анализа пограничная точка (EAR) была оценена в 0,91 г · кг -1 · d -1 и верхний 95% ДИ (безопасный для населения, эквивалентный RDA) в 0,99 г · кг — 1 · d −1 . Эти повторно проанализированные значения значительно выше текущих EAR и RDA, равных 0,66 и 0.80 г · кг -1 · d -1 соответственно (1). Известные ограничения метода баланса азота и тот факт, что он непрактичен для определения потребностей в популяциях, таких как беременность, потребовали разработки более новых современных методов.
Индикаторный метод окисления аминокислот.
Индикаторное окисление аминокислот (IAAO) представляет собой минимально инвазивный метод, в котором для определения потребности в аминокислотах используется незаменимая аминокислота, меченная стабильным изотопом (27, 28).Метод основан на фундаментальном физиологическом принципе, согласно которому избыточные аминокислоты не могут накапливаться в организме и должны распределяться между включением в белок и окислением. Таким образом, когда одной незаменимой аминокислоте не хватает для синтеза белка, то все другие аминокислоты, включая аминокислоту-индикатор (обычно другую незаменимую аминокислоту, такую как 1-1- 13 C-фенилаланин), находятся в избытке и, следовательно, будут окисляться. (28). С увеличением потребления лимитирующей аминокислоты окисление индикаторной аминокислоты будет уменьшаться, отражая увеличение включения в белок.Как только потребность в лимитирующей аминокислоте/белке будет удовлетворена, не будет дальнейших изменений в окислении индикаторной аминокислоты при увеличении потребления тестируемой аминокислоты. Точка перегиба, при которой окисление аминокислоты-индикатора перестает снижаться и выходит на плато, называется «точкой останова». Точка останова, которая определяется с помощью двухфазного линейного регрессионного анализа, указывает EAR лимитирующей (тестируемой) аминокислоты/белка (29). Метод IAAO требует перорального приема изотопов (30), сбора образцов дыхания и мочи (31) и адаптации к приему теста в течение одного дня исследования (32).Таким образом, метод хорошо подходит для изучения потребности в белке и аминокислотах в различных физиологических условиях на протяжении всего жизненного цикла. В частности, быстрая адаптация и неинвазивные методы устраняют риск длительного недостаточного поступления в уязвимые группы населения.
Метод IAAO, изначально разработанный для определения потребности в незаменимых аминокислотах, широко применяется у взрослых людей, детей школьного возраста и детей с заболеваниями (28, 29). Первое применение исследований IAAO у людей для определения потребности в белке у молодых мужчин было проведено Humayun et al.(20). Дизайн исследования был аналогичен исследованиям потребности в незаменимых аминокислотах, за исключением того, что все аминокислоты в структуре яичного белка (за исключением фенилаланина в качестве индикаторной аминокислоты и тирозина) были обеспечены от дефицита до избытка. Результаты показали, что потребность в белке у молодых мужчин составляет 0,93 и 1,2 г · кг -1 · d -1 (таблица 1) и значительно выше, чем текущие рекомендации 0,66 и 0,80 г · кг -1 · d −1 для EAR и RDA соответственно.С тех пор метод IAAO для определения потребности в белке применялся в нескольких группах населения (дети школьного возраста, пожилые женщины старше 65 лет и женщины восьмидесятилетнего возраста) (33–35). Во всех исследованиях было показано, что текущие рекомендации занижены и что средние потребности в белке, определенные методом IAAO, превышают потребности, определенные традиционными исследованиями баланса азота, примерно на 30–40%. Применение метода IAAO для определения потребности в белке подвергалось критике некоторыми (36, 37), потому что индикаторная аминокислота, потребление фенилаланина, остается постоянной при увеличении потребления белка в тесте, а IAAO может быть ограниченным и дефицитным при более высоком уровне белка в тесте. входы.Тем не менее, во всех вышеупомянутых исследованиях поток фенилаланина не изменился при увеличении потребления белка, что свидетельствует о том, что фенилаланин не является лимитирующим при приеме любых тестов. Когда поток является постоянным, метод IAAO отражает разделение между включением в синтез белка и окислением в ответ на тестируемое потребление белка и действительно определяет потребность в белке. Мы рассмотрели эту и другие проблемы в ответах на письма в редакцию и призываем читателей быть в курсе дебатов при переоценке текущих рекомендаций по потреблению белка (36, 37).Еще один ключевой вопрос для обсуждения заключается в том, связаны ли более высокие оценки потребностей, полученные с использованием краткосрочного метода IAAO, с долгосрочной пользой для здоровья (38). Для подтверждения выводов IAAO необходимо будет провести будущие долгосрочные исследования добавок с новыми требованиями к белку.
Текущие данные о потребностях в белке во время беременности
Недавно мы определили потребность в белке на ранних (~16 недель) и поздних (~36 недель) сроках гестации у здоровых одноплодных беременных с использованием метода IAAO (21).Потребности были определены как 1,2 г · кг -1 · d -1 (верхний 95% ДИ: 1,66 г · кг -1 · d -1 ) и 1,52 г · кг -1 · d -1 (верхний 95% ДИ: 1,77 г · кг -1 · d -1 ) на ранних и поздних сроках беременности соответственно. Из этого результата можно сделать два поразительных наблюдения. Во-первых, требования значительно превышают текущие EAR и RDA, составляющие 0,88 и 1,1 г · кг -1 · d -1 соответственно.Во-вторых, потребность в белке увеличивается уже на 16-й неделе беременности, хотя ранее считалось, что потребность в белке вначале будет низкой и существенно увеличится только к поздним срокам беременности (3). Хотя эти потребности, по-видимому, значительно выше, чем то, что можно было бы потреблять во время беременности, наши последние данные показывают, что это не так. Недавно мы завершили проспективный анализ 270 беременных женщин из Ванкувера, Британская Колумбия, Канада (39), которые были включены в отдельное исследование.FFQ вводили на ранних (~16 недель) и поздних (~36 недель) сроках беременности, и результаты показали, что диапазон среднего потребления белка матерью составлял 1,3-1,5 г · кг -1 · d -1 . Эти данные были получены от женщин, живущих в Ванкувере, Канада, где историческая частота детей с низкой массой тела при рождении, рожденных женщинами в возрасте 20–34 лет, невелика (∼5,45%) (40). Наши потребности в белке, определенные с использованием метода IAAO, сопоставимы с моделями потребления белка здоровыми беременными женщинами из той же популяции (39).Когда мы рассматриваем потребность в белке в процентах от общей энергии, наше исследование IAAO показало, что энергия составляет 1,7 × расход энергии в состоянии покоя для каждого участника и была индивидуальной. В среднем беременные женщины в нашем исследовании получали 2305 и 2483 ккал энергии в день на ранних и поздних сроках беременности соответственно, что соответствует текущим рекомендациям по потреблению энергии в соответствии с DRI и FAO (1, 4). Текущая рекомендация DRI по белку RDA 1,1 г · кг -1 · d -1 во время беременности, преобразованная в процент энергии, составляет ~ 9% энергии из белка как на ранних, так и на поздних сроках беременности.Наши расчетные потребности в белке на ранних и поздних сроках беременности составляют 14% и 17,5% энергии из белка соответственно. Потребности в белке на основе IAAO соответствуют рекомендуемому допустимому диапазону распределения макронутриентов 10–35% для получения энергии из белка.
Потребность в аминокислотах во время беременности
Насколько нам известно, нет опубликованных исследований потребности человека в аминокислотах; однако, используя свинью в качестве модели, мы определили потребности в треонине (41), лизине (42), изолейцине (43) и триптофане (44) в течение первого и третьего триместров беременности.Результаты выявили увеличение потребности во всех аминокислотах на более поздних стадиях беременности, хотя это увеличение варьировалось в зависимости от аминокислот. Потребность в треонине увеличилась на 55%, лизине на 45%, изолейцине на 63% и триптофане на 35% на поздних сроках беременности по сравнению с ранними сроками. Эти исследования показали, что применение одного и того же коэффициента ко всем аминокислотам для получения математической оценки потребности, как это делается в DRI, является ошибочным. К сожалению, аналогичные опубликованные исследования о беременности у человека отсутствуют.Недавно мы завершили первое, насколько нам известно, исследование потребности в аминокислотах при беременности человека. Потребность в лизине на поздних сроках беременности увеличилась на 27% по сравнению с ранними сроками беременности (R Elango et al., неопубликованные данные, 2015). Это больше, чем увеличение потребности в лизине, факторно рассчитанное DRI из увеличения потребности в белке на 41 мг · кг -1 · d -1 (таблица 1). В будущих исследованиях необходимо определить, в какой степени потребности в других незаменимых аминокислотах увеличиваются на прогрессивных стадиях беременности, и как они соотносятся с общим потреблением белка.Также недавно были проведены исследования на свиньях, которые предполагают, что в дополнение к незаменимым аминокислотам может быть повышенная потребность в незаменимых аминокислотах, таких как аргинин и глютамин, для развития матки и плода (45–47). Вопрос о том, существует ли аналогичная потребность в незаменимых аминокислотах во время беременности человека, требует дальнейшего изучения.
Исследования белковых добавок
Более высокое потребление белка во время беременности является предметом активных дискуссий в течение нескольких десятилетий (48, 49).Белковые добавки во время беременности также обсуждались, потому что между аминокислотами может возникать конкуренция, которая может отрицательно повлиять на рост плода, как показано на животных моделях (50). В рандомизированном контролируемом исследовании с участием беременных женщин с низким социально-экономическим статусом, проживающих в Нью-Йорке, сообщалось об отрицательных исходах беременности (повышенный риск рождения детей с малым весом для гестационного возраста) при приеме добавок с высоким содержанием белка (обеспечивающих > 34% энергии) ( 51). Но несколько других исследований, в которых белковые добавки давали в пищу и проводили при достаточном количестве энергии, показали значительное снижение риска рождения маловесных детей для гестационного возраста, предполагая профилактику задержки внутриутробного развития (52–54).Таким образом, как широко обсуждалось Imdad и Bhutta (55, 56), белковые добавки во время беременности должны быть сбалансированными белковыми добавками (<25% от общего содержания энергии), чтобы обеспечить снижение риска рождения детей с малым весом для гестационного возраста. Кроме того, более ранние исследования, проведенные Монреальским диетическим диспансером, показали, что беременные женщины из более низких социально-экономических групп, получавшие лечение в виде индивидуальной диетической реабилитации и потреблявшие ∼100 г белка в день, имели наилучшие исходы беременности, что измерялось снижением частоты случаев низкой массы тела при рождении (52). .Результаты исследования потребности в белке, полученные в нашем исследовании (таблица 1), выраженные как среднесуточное потребление для женщин, участвовавших в нашем исследовании, составили бы 79 г/сутки на ранних сроках беременности и 108 г/сутки на поздних сроках беременности (21) и обеспечит белковую энергию примерно на 15–17% калорий, что согласуется с данными о результатах родов Монреальского диетического диспансера. Кроме того, Блумфилд и соавт. (57) в элегантном анализе показали, что при потреблении белка на уровне от 18% до 20% от калорийности пищи основные потребности в микроэлементах, включая фолиевую кислоту, витамин Е, железо и цинк, удовлетворялись у здоровых, хорошо питавшихся беременных женщин. .Таким образом, белковые добавки во время беременности должны быть в виде пищевых добавок, сбалансированных (в пределах 25% от общей энергии) и, как было указано ранее Prentice et al. (58), с целью предотвращения задержки внутриутробного развития, а не с целью увеличения массы тела при рождении.
Выводы
В заключение, мы считаем, что текущие EAR и RDA для потребления белка во время беременности, равные 0,88 и 1,1 г · кг −1 · d −1 , являются заниженными.Используя метод IAAO, мы недавно определили среднюю потребность в белке, которая составляет 1,2 и 1,52 г · кг -1 · d -1 на ранних и поздних сроках беременности, соответственно. Среднее суточное потребление белка будет составлять ∼79 г/сутки (∼14% калорий) на ранних сроках беременности и 108 г/сутки (∼17% калорий) на поздних сроках беременности для нормально питающихся женщин, набирающих гестационный вес в пределах рекомендаций. Насколько нам известно, в настоящее время нет прямых опубликованных оценок потребности в аминокислотах во время беременности, но недавние исследования на животных показывают, что потребности в незаменимых аминокислотах треонине, лизине, изолейцине и триптофане увеличиваются на более поздних стадиях беременности, но не в те же сроки. пропорционально потребности в белке, как на ранних сроках беременности (59).Срочно необходимы будущие исследования, чтобы установить потребность человека в незаменимых аминокислотах во время беременности. Также необходимы дополнительные исследования, чтобы подтвердить положительное влияние пищевых белковых добавок во время беременности с акцентом на предотвращение задержки внутриутробного развития, чтобы гарантировать, что белковые добавки всегда являются сбалансированной белково-энергетической добавкой (<25% от общего содержания энергии). ). Эти исследования необходимы для разработки более точных диетических рекомендаций для многих групп женщин во всем мире, у которых во время беременности было нарушено питание из-за низкого потребления белка и/или калорий или несбалансированного потребления аминокислот.
Благодарности
Оба автора прочитали и одобрили окончательный вариант рукописи.
Каталожные номера
1Институт медицины, пищевых продуктов и питания.
Справочная диета Потребление энергии, углеводов, клетчатки, жира, жирных кислот, холестерина, белков и аминокислот
.Вашингтон (округ Колумбия)
:National Academy Press
;2005
.2ВОЗ/ФАО/УООН.
Потребность в белках и аминокислотах в питании человека.Отчет совместной консультации экспертов ВОЗ/ФАО/УООН
.Технический представитель World Health Organ Tech Rep Ser
2007
;935
:103
–33
.3Кинг
JC
.Физиология беременности и метаболизм питательных веществ
.Ам Дж Клин Нутр
2000
;71
(Дополнение
):1218S
–25S
.4ФАО.
Энергетические потребности человека. Отчет совместной консультации экспертов ФАО/ВОЗ/УООН
.Рим (Италия)
:ФАО
;2004
. Технический отчет ФАО о пищевых продуктах и питании, серия 1.5Butte
NF
,King
JC
.Потребность в энергии во время беременности и кормления грудью
.Нутр общественного здравоохранения
2005
;8
:1010
–27
.6Hytten
FE
.Увеличение массы тела при беременности
. В:Hytten
FE
,Чемберлен
G
.редакторы.Клиническая физиология в акушерстве
.Оксфорд (Великобритания)
:Blackwell Scientific
;1991
. п.173
–203
.7Калхан
SC
.Белковый обмен при беременности
.Ам Дж Клин Нутр
2000
;71
(71
):1249S
—55S
. 80004 55S .8de Benoist
B
,Jackson
AA
,Зал
,,
JS
,Persaud
C
.Обмен белка в организме у ямайских женщин во время нормальной беременности
.Хум Нутр Клин Нутр
1985
;39
:167
–79
.9Томпсон
GN
,Halliday
D
.Белковый обмен при беременности
.Евр Дж Клин Нутр
1992
;46
:411
—411
—7
.10Whittaker
PG
,Lee
CH
,COPER
BG
,Taylor
R
.Оценка метаболизма фенилаланина и тирозина на поздних сроках беременности человека
.Метаболизм
1999
; .Более высокий вес при рождении связан со снижением окисления материнских аминокислот во время беременности
.Am J Clin Nutr
2002
;76
:852
–7
.12Jolly
M
,,
J
,J
,,
R
,Bannister
P
,P
,, JohnstonD
,Robinson
S
.Повышенный оборот лейцина у женщин в третьем триместре неосложненной беременности
.Метаболизм
2004
;53
:545
–9
.13Калхан
SC
,Парими
PS
.Трансаминирование лейцина и накопление азота при беременности человека и у новорожденного
.Дж Нутр
2006
;136
:281S
–7S
.14Дагглби
SL
,Джексон
AA
.Белковый, аминокислотный и азотистый обмен во время беременности: как мать может удовлетворить потребности своего плода?
Curr Opin Clin Nutr Metab Care
2002
;5
:503
–9
.15Fitch
WL
,King
JC
.Реакция аминокислот, глюкозы и инсулина в плазме на пробные блюда с умеренным и высоким содержанием белка у беременных, небеременных и беременных женщин с диабетом
.Am J Clin Nutr
1987
;46
:243
—9
.16Thame
Thame
M
,Fletcher
H
,Baker
T
,Jahoor
F
.Сравнение потоков глицина in vivo у девочек-подростков и взрослых женщин на ранних и поздних сроках беременности
.Бр Ж Нутр
2010
;104
:498
—502
.17502
.17Kurpad
AV
,P
,Thomas
T
,MHASKAR
A
,THOMAS
A
,Мхаскар
R
,Джахур
Ф
.Сравнение кинетики лейцина и незаменимых аминокислот у индийских женщин с низким или нормальным индексом массы тела во время беременности
.Am J Clin Nutr
2010
;92
:320
—9000
—9
.18Thame
мм
,Флетчер
HM
,Baker
TM
,Marini
JC
,KAO
CC
,Джахур
Ф
.Поток аргинина, но не синтез оксида азота, снижается у девочек-подростков по сравнению со взрослыми женщинами во время беременности
.Дж Нутр
2011
;141
:71
—4
.19 —4
.19Kurpad
AV
,AV
,Anand
P
,Dwarkanath
P
,HSU
JW
,Thomas
T
,Деви
S
,Томас
A
,Мхаскар
R
,Джахур
F
.Кинетика метионина в организме, трансметилирование, транссульфурация и реметилирование во время беременности
.Клин Нутр
2014
;33
:122
—9
.20Humayun
MA
,ELANGO
R
,Ball
RO
,Pencharz
Pb
.Повторная оценка потребности в белке у молодых мужчин с помощью индикаторного метода окисления аминокислот
.Am J Clin Nutr
2007
;86
:995
—1002
—1002
.211002
.21Степис
TV
,Payne
M
,Ball
RO
,Pencharz
PB
,ELANGO
R
.Потребность в белке здоровых беременных женщин на ранних и поздних сроках беременности выше текущих рекомендаций
.Дж Нутр
2015
;145
:73
—73
—8
.22Moehn
S
,S
,Levesque
C
,Samuel
R
,Ball
RO
.Новые потребности в энергии и аминокислотах для супоросных свиноматок
.Adv Pork Prod
2011
;22
:157
–66
.23Национальный исследовательский совет.
Потребность свиней в питательных веществах
. 11-е исправленное изд.Вашингтон (округ Колумбия)
:National Academy Press
;2012
.24Рэнд
WM
,Янг
VR
,Скримшоу
NS
.Изменение экскреции азота с мочой в ответ на низкобелковую диету у взрослых
.Am J Clin Nutr
1976
;29
:639
–44
.25.Потребность человека в белке: эффективность использования яичного белка на поддерживающем и субподдерживающем уровнях у молодых мужчин
.Дж Нутр
1973
;103
:1164
—74
.2674
.26RAND
WM
,Pellett
PL
,молодых
VR
.Метаанализ исследований баланса азота для оценки потребности в белке у здоровых взрослых
.Am J Clin Nutr
2003
;77
:109
–27
.27Pencharz
PB
,Мяч
RO
.Различные подходы к определению индивидуальных потребностей в аминокислотах
.Годовой Рев Нутр
2003
;23
:101
—16
.2816
.28Elango
R
,Ball
RO
,Pencharz
PB
.Индикатор окисления аминокислот: концепция и применение
.Дж Нутр
2008
;138
:243
—6
.29Elango
R
,Ball
RO
,Pencharz
Pb
.Последние достижения в области определения потребности человека в белке и аминокислотах
.Бр Ж Нутр
2012
;108
:S22
—30
.3030
.30Kriengsinyos
W
,Wykes
LJ
,Ball
RO
,Pencharz
PB
.Пероральные и внутривенные протоколы индикаторного метода окисления аминокислот дают одинаковую оценку потребности в лизине у здоровых мужчин
.Дж Нутр
2002
;132
:2251
—2251
—7
.31Bross
R
,Ball
RO
,Pencharz
PB
.Разработка минимально инвазивного протокола для определения кинетики фенилаланина и лизина у людей во время приема пищи
.Дж Нутр
1998
;128
:128
:1913
—9
.32Elango
R
,R
,HUMAYUN
MA
,Ball
RO
,Pencharz
PB
.На показатель окисления аминокислот не влияет период адаптации к широкому диапазону потребления лизина у здоровых молодых мужчин
.Дж Нутр
2009
;139
:1082
–7
.33.Потребность в белке здоровых детей школьного возраста, определяемая индикаторным методом окисления аминокислот
.Am J Clin Nutr
2011
;94
:1545
:525
—52
.34Tang
Tang
M
,MCCabe
GP
,ELANGO
R
,Pencharz
PB
,Ball
RO
,Кэмпбелл
WW
.Оценка потребности в белке у восьмидесятилетних женщин с использованием индикаторного метода окисления аминокислот
.Am J Clin Nutr
2014
;99
:891
—891
—8
.35Rafii
M
,CHAPMAN
K
,OWENS
J
,ELANGO
R
,Campbell
WW
,Мяч
RO
,Pencharz
PB
,Кортни-Мартин
G
.Потребность в пищевом белке у взрослых женщин старше 65 лет, определенная с помощью индикаторного метода окисления аминокислот, выше текущих рекомендаций
.Дж Нутр
2015
;145
:18
–24
.36Хоффер
LJ
.Потребность детей школьного возраста в белке [ответ автора]
.Am J Clin Nutr
2012
; .Потребность в белке и индикаторный метод окисления аминокислот [ответ автора]
.Am J Clin Nutr
2012
;95
:1501
–2
.38Фукагава
НК
.Потребность в белке: методологические разногласия на фоне призывов к изменению
.Am J Clin Nutr
2014
;99
:761
—761
—2
.39SEDHESENS
TV
,WOO
H
,Innis
SM
,ELANGO
R
.Здоровые беременные женщины в Канаде потребляют больше пищевого белка на 16-й и 36-й неделе беременности, чем в настоящее время рекомендовано Справочным рационом питания, в основном из молочных продуктов
.Нутр Рез
2014
;34
:569
—569
—76
.4170004 levesque
CL
,Moehn
S
,Pencharz
PB
,Ball
RO
.Потребность свиноматок в треонине увеличивается на поздних сроках беременности
.J Anim Sci
2011
;89
:93
—93
—102
.42Samuel
RS
,Moehn
S
,Pencharz
PB
,Ball
RO
.Потребность свиноматок в лизине в рационе увеличивается на поздних сроках беременности
.J Anim Sci
2012
;90
:90
:4896
—904
.43 .43Franco
DJ
,JOSEPHSON
JK
,Moehn
S
,Pencharz
PB
,Ball
RO
.Потребность супоросных свиноматок в изолейцине
.J Anim Sci
2013
;91
:919
:3859
—66
.44Franco
Franco
DJ
,JOSEPHSON
JK
,Moehn
S
,Pencharz
PB
,Ball
RO
.Потребность супоросных свиноматок в триптофане
.J Anim Sci
2014
;92
:4457
–65
.45WU
G
,Bazer
FW
, RC BurghardtRC
,Johnson
GA
,KIM
SW
,LI
XL
,Satterfield
MC
,Спенсер
ТЕ
.Влияние аминокислотного питания на исход беременности у свиней: механизмы и последствия для свиноводства
.J Anim Sci
2010
;88
:E195
–204
.46WU
G
,Bazer
FW
,FW
,Satterfield
MC
,LI
,
LI
x
,Wang
,x
,
Johnson
GA
,RC
,Дай
Z
,Ван
J
,Ву
Z
.Влияние аргинина на эмбриональное и внутриутробное развитие млекопитающих
.Аминокислоты
2013
;45
:241
–56
.47Ву
Г
.Пищевые потребности животных в синтезируемых аминокислотах: изменение парадигмы белкового питания
.J Anim Sci Biotechnol
2014
;5
:34
.48Гарнер
P
,Kramer
MS
,Чалмерс
I4 I
5 . Могут ли усилия по увеличению веса при рождении недоедающих женщин принести больше вреда, чем пользы?
Ланцет
1992
; 340
: 1021
– 3
.49 Блюмфилд
ML
, Коллинз
CE
. Белковая диета во время беременности: полезная или вредная для потомства?
Am J Clin Nutr
2014
; 100
: 993
: 993
— 593
— 5
.50 Коричневый
LD
, Green
AS
, Limesand
SW
, Rozance
PJ
. Аминокислотная добавка для матери при задержке внутриутробного развития
. Front Biosci (School Ed)
2011
; 3
: 428
– 44
.51 Раш
D
, Штейн
Z
,4 М
,4 Суссер
Рандомизированное контролируемое исследование пищевых добавок для беременных в Нью-Йорке
. Педиатрия
1980
; 65
: 683
— 683
— 97
.52 974
.52 Higgins
AC
, Moxley
JE
, JE
, Pencharz
PB
, Mikolainis
D
, Dubois
S
. Влияние программы Higgins Nutrition Intervention Program на массу тела при рождении: анализ внутри матери
. J Am Diet Assoc
1989
; 89
: 1097
: 1097
— 1097
— 1097
.53 Godfrey
K
, K
, Robinson
S
, Barker
DJ
, Osmond
C
, COX
V
. Питание матери на ранних и поздних сроках беременности в зависимости от роста плаценты и плода
. БМЖ
1996
; 312
: 410
— 410
— 4
.54 CeeSay
SM
, Prentice
AM
, COLE
TJ
,,
TJ
,,
Weaver
,
Weaver
LT
, Poskitt
EM
, Whitehead
RG
. Влияние пищевых добавок для матерей на массу тела при рождении и перинатальную смертность в сельских районах Гамбии: 5-летнее рандомизированное контролируемое исследование
. БМЖ
1997
; 315
: 786
– 90
.55 Имдад
А
, Бхутта
ЗА
. Влияние пищевых добавок со сбалансированным белком во время беременности на исход родов
. BMC Public Health
2011
; 11
( Приложение
3): S17
.56 Имдад
А
, Бхутта
ZA
. Материнское питание и исходы родов: влияние сбалансированных белково-энергетических добавок
. Pediatr Perinat Epidemiol
2012
; 26
( 26
): 178
— 90
.57 — 9000
.57 Blumfield
M
, HURE
A
, MacDonald-fiks
L
, Smith
R
, Симпсон
S
, Раубенхаймер
D
, Коллинз
C
. Связь между содержанием макронутриентов в рационе матери и адекватностью микронутриентов во время беременности в исследовании «Здоровье женщин и их детей» (WATCH)
. Питательные вещества
2012
; 4
: 1958
— 1958
— 76
.58 Prentice
AM
, CEESAY
SM
, Whithead
RG
. Докорм матери и масса тела при рождении
. Ланцет
1993
; . Кормление супоросных свиноматок для оптимальной продуктивности: прошлое, настоящее и будущее
.В: Плюске
JM
, Плюске
JR
. редакторы. Манипулирование свиноводством XIV
. Корова (Австралия)
: Австралазийская свиноводческая ассоциация
; 2013
. п. 151
– 69
. Примечания автора
© Американское общество питания, 2016 г.
Протеинурия при беременности-обзор
Протеинурия является основным признаком поражения почек и фактором риска прогрессирования заболевания почек.Экскреция белка с мочой увеличивается при нормальной беременности. В последних рекомендациях протеинурия больше не является обязательным диагностическим признаком преэклампсии. Поскольку большинство опубликованных данных основано на том, что протеинурия является обязательным условием для диагностики преэклампсии, удаление протеинурии представляет собой значительный объем данных, нуждающихся в пересмотре. Мы провели тщательный поиск литературы, используя соответствующие термины Mesh. Большинство опубликованных данных указывает на благоприятный исход протеинурии во время беременности.Однако, за исключением некоторых отчетов ретроспективных исследований, не существует убедительных доказательств того, что это относится к отдаленным последствиям для почек. Поскольку известно, что артериальное давление падает в первом триместре беременности, повышение артериального давления от надира до текущего порогового значения 140/90 мм рт. ст. может рассматриваться как «нераспознанный продромальный период». Необходима дополнительная исследовательская работа, чтобы найти более чувствительные инструменты для скрининга групп риска в геномной, протеомной, клинической и эпидемиологической областях.
Протеинурия, беременность, преэклампсия, артериальная гипертензия
Протеинурия является признаком повреждения почек и указывает на риск ухудшения заболевания почек.Экскреция белка с мочой увеличивается при нормальной беременности от менее 150 мг/сут у небеременных до 300 мг/сут при беременности. Таким образом, порог аномальной экскреции белка для диагностики преэклампсии составляет более 300 мг/24 ч или более 2+ при тестировании с полосками в соответствии с рекомендациями Американского колледжа акушерства и гинекологии [1,2]. В предыдущих версиях рекомендаций для диагностики преэклампсии требовалось определение протеинурии. В соответствии с действующими рекомендациями преэклампсия может быть диагностирована при отсутствии протеинурии, если присутствует артериальная гипертензия в сочетании с другими тяжелыми симптомами.Это изменение было вызвано двумя важными наблюдениями. Во-первых, тяжесть протеинурии не сильно связана с неблагоприятными исходами для матери и новорожденного. Во-вторых, преэклампсия иногда может протекать при отсутствии протеинурии: до 10% женщин с преэклампсией и 20% женщин с эклампсией не имеют протеинурии при первичном обращении [3,4].
Целевая группа Американского колледжа акушерства и гинекологии (ACOG) по гипертензии при беременности определяет протеинурию при беременности как новое появление белка в моче в количествах, равных или превышающих 300 мг белка в 24-часовом сборе, соотношение белок/креатинин равно до или больше 0.3 мг/мг или +2 или более при анализе мочи полосками [1,2]
Протеинурия для диагностики преэклампсии
Традиционно для диагностики преэклампсии у женщины без ранее существовавшей гипертензии или протеинурии требовалось новое начало гипертензии и протеинурии после 20 недель беременности. В 2013 году Целевая группа Американского колледжа акушеров и гинекологов по артериальной гипертензии при беременности представила новые диагностические критерии преэклампсии [1], согласно которым преэклампсию можно диагностировать в отсутствие протеинурии, если присутствуют другие признаки преэклампсии (таблица 1).
Таблица 1. Критерии диагностики преэклампсии Американского колледжа акушерства и гинекологии.
Артериальное давление
- Систолическое артериальное давление САД ≥ 140 мм рт. ст. или диастолическое артериальное давление ДАД ≥ 90 в двух случаях с интервалом не менее 4 часов после 20 недель беременности у женщины с ранее нормальным АД.
- Если САД ≥ 160 мм рт. ст. или ДАД ≥ 110 мм рт. ст., артериальная гипертензия может быть подтверждена в течение короткого промежутка времени (минут), чтобы избежать задержек с лечением.
И:
Протеинурия
- ≥ 300 мг в суточной моче или
- UPCR ≥ 0,3 мг/мг или
- Показания тест-полоски для определения белка в моче ≥ 2+, если количественное тестирование недоступно*
Или при отсутствии протеинурии впервые возникшая гипертензия с одним из следующих признаков:
Тромбоцитопения
- Количество тромбоцитов < 100 000/мкл
Почечная недостаточность
- Концентрация креатинина в сыворотке > 1.1 мг/дл или
- Удвоение концентрации креатинина в сыворотке крови при отсутствии других заболеваний почек.
Нарушение функции печени
- Повышение концентрации ферментов печени в крови в два раза выше нормы
Отек легких
Церебральные или зрительные симптомы
*Пороговое значение было увеличено до +2 в последних рекомендациях 2019 г. [2].
Гестационная гиперфильтрация
При нормальной беременности почечный плазмоток увеличивается, что приводит к увеличению скорости клубочковой фильтрации (СКФ) более чем на 50% [5]. Это, в свою очередь, приводит к относительному снижению концентрации креатинина и мочевины в сыворотке крови при одновременном увеличении экскреции белка [5]. Несмотря на то, что большинство опубликованных данных указывают на благоприятный исход протеинурии во время беременности, нет никаких доказательств того, что это относится к отдаленным почечным исходам.Исключение протеинурии в качестве требования для диагностики преэклампсии в текущих рекомендациях в основном связано с повышением чувствительности скрининга преэклампсии с использованием только артериального давления. Артериальная гипертензия является поздним следствием продолжающегося процесса (процессов), который в конечном итоге приводит к повышению артериального давления. Отсутствуют данные о клинических проявлениях ранних изменений, предшествующих явной артериальной гипертензии. Поскольку известно, что артериальное давление падает в течение первого триместра беременности, повышение артериального давления от его надира до текущего порогового значения 140/90 мм рт. ст. может рассматриваться как «нераспознанный продромальный период».Необходима дополнительная исследовательская работа, чтобы найти более чувствительные инструменты для скрининга групп риска в геномной, протеомной, клинической и эпидемиологической областях.
В настоящее время для обнаружения протеинурии используется несколько тестов. Эти анализы различаются по точности, стоимости и простоте выполнения.
Уксусная кислота/ сульфосалициловая кислота
Во многих частях развивающегося мира для скрининга протеинурии во время беременности обычно используется тест на коагуляцию белков мочи (тест на уксусную кислоту или тест на сульфосалициловую кислоту) [6].Метод прост и включает в себя добавление нескольких капель разбавленной уксусной кислоты к 5 мл мочи в пробирке, а затем нагревание мочи до температуры ниже точки кипения. В зависимости от полученной мутности наличие белка в моче количественно оценивается от 1+ до 4+. Преимущество этого теста состоит в том, что он дешевле и может обнаруживать другие белки, например. Белок Бенс-Джонса и парапротеины, в то время как измерительная полоска обнаруживает только белок. Тест на сульфосалициловую кислоту требует центрифугирования мочи с последующим добавлением 2.5 мл супернатанта к 7,5 мл 3% сульфосалициловой кислоты. Степень помутнения определяют количественно, как в таблице 2 [7].
Таблица 2. Количественное определение сульфосалициловой кислоты
Белок (мг/дл)
Степень мутности
0
Прозрачный
1–10
Опаловый
15–30
Печать через трубку
40–100
Может читать только черные линии
150–400
Без видимых черных линий
> 500
Флокулянт
Мазок для мочи
Тест-полоска для мочи — широко используемый полуколичественный тест на протеинурию в месте оказания медицинской помощи.Как мы сообщали в нашей предыдущей работе, точность анализа мочи с полосками для прогнозирования значительной протеинурии во время беременности низкая при пороге 1+ с плохими положительными и отрицательными прогностическими значениями для значительной протеинурии [8]. Мы пришли к выводу, что точность теста с полосками может улучшиться при более высоких порогах (протеинурия выше 1+) [8]. В текущих рекомендациях 2019 г. порог значимой протеинурии повышен до 2+ [2].
Круглосуточный сбор мочи
Золотым стандартом количественного определения протеинурии является сбор белка в моче за 24 часа.В дополнение к количественной оценке экскреции общего белка этот метод также позволяет рассчитать клиренс креатинина как оценку СКФ. Однако 24-часовой сбор мочи утомителен для пациента и часто неточен из-за избыточного или недостаточного сбора [9]. Таким образом, при интерпретации результатов 24-часового сбора мочи важно оценить полноту сбора: 24-часовая экскреция креатинина с мочой должна составлять 15-20 мг креатинина/кг массы тела с учетом массы тела до беременности.
Отношение белка к креатинину в моче (UPCR)
Соотношение белка и креатинина в разовой моче является относительно надежным, точным и простым методом количественной оценки протеинурии, который в значительной степени заменил 24-часовой сбор мочи у неакушерских пациентов. Имеющиеся данные свидетельствуют о том, что соотношение белок/креатинин в моче является точным для количественного определения протеинурии при беременности. Этот анализ стал предпочтительным методом количественной оценки протеинурии из-за его точности, воспроизводимости и отсутствия необходимости сбора мочи за 24 часа.
Точность UPCR при беременности тщательно оценивалась [10]. Большинство исследований, оценивающих полезность UPCR при беременности, проводились у женщин с подозрением на преэклампсию. Эти исследования показали, что UPCR хорошо коррелирует с синхронизированной 24-часовой экскрецией белка с мочой [11]. UPCR оказался действительным как для исходной, так и для последующей протеинурии [12]. Получение образца для UPCR просто, так как для этого требуется только чистый образец средней порции без необходимости катетеризации мочевого пузыря [13] или временного отбора проб [14].
В дополнение ко многим исследованиям, оценивающим точность UPCR, было проведено три систематических обзора, в которых был сделан тот же вывод [10,15,16]. В этих системных обзорах также оценивались различные пороговые значения UPCR. Из этой работы был сделан вывод, что UPCR > 0,7 мг белка/мг креатинина строго предсказывает значительную протеинурию, а UPCR < 0,15 мг белка/мг креатинина исключает значительную протеинурию. Таким образом, большинство авторитетных источников признают UPCR спота ≥ 0.от 26 до 0,3 мг белка/мг креатинина для диагностики преэклампсии [17,18].
Отношение альбумина к креатинину
Альтернативой UPCR является отношение альбумина к креатинину в моче (UACR) [19]. UACR можно измерить с помощью автоматического анализатора, доступного в качестве теста по месту оказания медицинской помощи. Как и UPCR, UACR с отсечкой от 20 до 60 мг альбумина/г креатинина точно предсказывает значительную протеинурию и примерно соответствует > 300 мг белка/день при 24-часовом сборе мочи [20, 21].
Протеинурия беременных может быть разделена на четыре основных класса:
1 — Выделенная протеинурия de novo
2-Протеинурия De novo, связанная с преэклампсией
3-Протеинурия, вторичная по отношению к хронической болезни почек
4-Транзиторная протеинурия вследствие ИМП во время беременности
Изолированная протеинурия de novo
Изолированная протеинурия определяется как появление новой протеинурии с уровнем Cr более 300 мг/г в любой момент беременности при отсутствии гипертонии, ИМП, системных заболеваний или других очевидных причин.Гестационная протеинурия представляет собой разновидность изолированной протеинурии, которая определяется как протеинурия с началом через 20 недель при отсутствии артериальной гипертензии [22]. Поскольку гестационная протеинурия часто прогрессирует до преэклампсии, это ретроспективный диагноз, который может быть поставлен только в послеродовом периоде, если преэклампсия не развилась.
Неясно, что вызывает изолированную протеинурию при отсутствии артериальной гипертензии. Некоторые публикации связывают это с материнскими факторами, отличными от тех, которые участвуют в патогенезе преэклампсии.Holston и соавт. сообщили, что беременные женщины с изолированной протеинурией имеют высокий индекс массы тела и низкий уровень циркулирующих ангиогенных факторов, таких как плацентарный фактор роста (PlGF) [23]. Одни авторы рассматривают изолированную протеинурию как часть спектра преэклампсии, другие считают ее отдельной патологической единицей.
Изолированная протеинурия часто прогрессирует до преэклампсии [24]. Иногда эклампсия может возникать у пациенток с изолированной протеинурией без артериальной гипертензии [24,25].
Такой же вывод о значимости протеинурии при отсутствии гипертензии был сделан Yadama et al. [26] из многоцентрового отчета. Они заявили, что «у некоторых беременных женщин развивается значительная протеинурия при отсутствии артериальной гипертензии». Однако клиническое значение изолированной гестационной протеинурии (IGP) изучено недостаточно. Катта и др. [27] провели проспективное исследование у 142 женщин без протеинурии в анамнезе. Они сообщили, что изолированная протеинурия развилась у 13% нормотензивных беременностей.Они установили, что изолированная протеинурия связана с развитием артериальной гипертензии. Они пришли к выводу, что может существовать другой механизм, который приводит к развитию изолированной протеинурии по сравнению с женщинами с преэклампсией. Аканкша С. и др. [28] также сообщил о том же, что он цитировал, что примерно у 50% женщин с изолированной протеинурией во время беременности развивается преэклампсия даже при отсутствии артериальной гипертензии [29].
Несмотря на то, что большинство опубликованных данных указывают на благоприятный исход протеинурии во время беременности [8,30], данных об отдаленных почечных исходах мало.Преэклампсия увеличивает риск сердечно-сосудистых заболеваний [31-34] и терминальной стадии заболевания почек [35,36] в более позднем возрасте.
Протеинурия de novo, связанная с преэклампсией
Артериальная гипертензия во время беременности определяется как артериальное давление выше 140 мм рт.ст. систолического или выше 90 мм рт.ст. диастолического [1]. Гипертонические расстройства беременных подразделяются на 4 группы; преэклампсия/эклампсия, хроническая гипертензия во время беременности, хроническая гипертензия с наложенной преэклампсией и гестационная гипертензия.Из них протеинурия характерна для всех, кроме гестационной гипертензии (при которой протеинурия по определению отсутствует).
Текущие критерии ACOG для диагностики преэклампсии требуют повышенного артериального давления (≥ 140/90 мм рт. ст. как минимум 2 раза с интервалом в 4 часа после 20 недель беременности) и либо протеинурии (≥ 300 мг в 24-часовом сборе мочи, UPCR ≥ 0,3 мг/мг, или показания тест-полоски для определения содержания белка в моче > 2+, если количественное тестирование недоступно) или, при отсутствии протеинурии, высокое кровяное давление в сочетании с другим тяжелым признаком: почечная недостаточность, низкий уровень тромбоцитов, нарушение функции печени, отек легких или церебральные или зрительные симптомы [1,37] (таблица 1).
Высокое кровяное давление, зарегистрированное до 20 недель беременности, вероятно, связано с хронической гипертензией. Хроническая артериальная гипертензия может осложняться наложенной преэклампсией. Диагноз наложенной преэклампсии часто сложен, но общие признаки включают появление или ухудшение протеинурии, ухудшение артериального давления или развитие признаков тяжелой преэклампсии (таблица 1).
Гестационная гипертензия определяется как новое начало гипертензии без протеинурии (или других диагностических признаков преэклампсии) после 20 недель беременности.Гестационная гипертензия обычно проходит в течение 12 недель после родов [38]. Как и изолированная гестационная протеинурия, гестационная гипертензия может быть предвестником преэклампсии.
Следует отметить, что определение артериальной гипертензии при беременности (систолическое АД > 140 мм рт. ст. или диастолическое АД > 90 мм рт. ст.) не основано на доказательствах. Артериальное давление обычно падает на 10-15 мм рт. ст. в начале беременности [39]. Таким образом, порог определения артериальной гипертензии у беременных, вероятно, должен быть ниже порога у небеременных.Таким образом, определение артериальной гипертензии как АД > 140/90 мм рт. ст. не способствует раннему выявлению гипертензивных нарушений беременности.
Хроническая протеинурия у беременных с сопутствующим заболеванием почек
Протеинурия во время беременности может быть вызвана состояниями, не связанными с преэклампсией, такими как предшествующее или de novo гломерулярное или тубулоинтерстициальное заболевание почек. Когда протеинурия документируется на ранних сроках беременности (до 20 недель), она называется хронической протеинурией и обычно связана с основным заболеванием почек.Когда протеинурия впервые документируется поздно (после 20 недель), это обычно связано с гестационной протеинурией или преэклампсией.
Одно исследование включало две группы беременных, которым была выполнена антенатальная или послеродовая чрескожная биопсия почки. У этих женщин было заболевание почек, развившееся во время беременности, и биопсия почки выполнялась во время или сразу после беременности [40]. Гломерулярная патология была обнаружена у 95% (19/20) беременных женщин, у которых во время беременности была проведена биопсия.У женщин после биопсии после родов 82,6% (62/75) имели значительную протеинурию (40% преэклампсия) во время беременности, которая не разрешилась после родов. Клубочковая аномалия была обнаружена в 64%. Долгосрочное наблюдение в среднем 51,5 месяца за 47 женщинами показало, что у 29,7% (14 женщин) сохраняется значительная протеинурия, у 42,6% (20 женщин) СКФ < 60 мл/мин/1,73 м 2 и 12,7 % (6 женщин) достигли терминальной стадии почечной недостаточности (ТХПН) [40].
Сахарный диабет 1 или 2 типа (СД 1 или 2) является частой причиной протеинурии.Хроническая протеинурия может быть у беременных с сахарным диабетом и гипертонической болезнью. У женщин с СД 1 или 2 в фертильном возрасте может развиться заболевание почек. СД 1 и 2 имеют практически одинаковую распространенность умеренно повышенной альбуминурии и диабетической нефропатии у беременных с СД 1 и 2 типа [41]. Альбуминурия у женщин с СД 1 или 2 также может быть обусловлена гломерулярным заболеванием, отличным от диабетической нефропатии. Альбуминурия, сохраняющаяся более 3 месяцев, считается хронической болезнью почек (ХБП) [42].
Протеинурия во время беременности также может быть вторичной по отношению к хронической гипертензии. Ведение женщин с предсуществующей хронической гипертензией во время беременности отличается от ведения женщин с острым гипертензионным синдромом во время беременности, поскольку женщины с хронической гипертензией подлежат тщательному пренатальному наблюдению [43]. Женщин с хронической гипертензией в идеале следует обследовать до беременности, уделяя особое внимание наличию поражения органов-мишеней, доказательствам вторичных причин гипертензии, корректировке лекарств и консультированию относительно риска преэклампсии и неблагоприятных событий для плода во время беременности [43].
Дифференциация вторичной гипертензии и высокого кровяного давления, вызванного синдромом преэклампсии: Во время нормальной беременности происходит несколько уникальных физиологических изменений [44]. Почки увеличиваются в размерах и собирательная система расширяется, ренин-ангиотензин-альдостероновая система (РААС) активируется без гипертензии, а почки гиперфильтрируются без долгосрочных последствий [44]. Наблюдается легкая гипонатриемия и респираторный алкалоз [44].Активация РААС начинается во время лютеиновой фазы менструального цикла и продолжает расти после оплодотворения вместе с параллельным увеличением уровней эстрогена и прогестерона [45]. Уровни ренина могут повышаться до восьми раз, ангиотензина — до четырех раз, а альдостерона — до десяти-двадцати раз выше нормы [45]. К нефрологу можно обратиться, если у беременных развивается острая почечная недостаточность (ОПП), гломерулонефрит ГН, рефрактерная гипертензия, сниженная расчетная скорость клубочковой фильтрации (рСКФ), протеинурия или иногда микроангиопатия [46].Крайне важно, но очень сложно отличить высокое кровяное давление, вызванное синдромом преэклампсии, от других причин вторичной гипертензии, например, гипертонии. артериальная гипертензия на фоне стеноза почечных артерий. Биохимические параметры, которые обычно используются для дифференциации вторичной гипертензии, а именно стимулированная РААС с высоким уровнем ренина, также являются высокими из-за беременности как таковой. Несмотря на стимуляцию РААС, у большинства беременных гипертония не развивается. Предполагается, что это связано с сосудорасширяющим действием эстрогена и/или прогестерона и секретируемого яичниками гестационного гормона релаксина [47].Сообщалось, что эта системная вазодилатация, опосредованная гормонами, снижает систолическое артериальное давление примерно на 10–15 мм рт. ст. во время беременности [48]. Гемодинамические изменения, вызванные этой глобальной вазодилатации, затрагивают почки и приводят к снижению почечного сосудистого сопротивления, что приводит к раннему увеличению СКФ примерно на 25-50%. Предполагается, что результирующее состояние гиперфильтрации вызывает увеличение экскреции белка при нормальной беременности [8] без долгосрочных последствий, в отличие от того, что мы наблюдаем при других состояниях гиперфильтрации, таких как сахарный диабет, единственная почка и почка у пациентов с высоким ИМТ [8, 49].
Все больше женщин вступают в беременность с ранее существовавшей гипертензией и имеют факторы риска развития эссенциальной гипертензии, такие как ожирение, расовая принадлежность и пожилой возраст матери [44]. По оценкам, у 25% этих пациентов может развиться синдром наложенной преэклампсии [8,44]. В этой относительно молодой популяции эссенциальная гипертония с меньшей вероятностью проживет достаточно долго, чтобы вызвать поражение органов-мишеней. В таких обстоятельствах развитие протеинурии de novo потенциально может указывать на начало перекрывающегося синдрома преэклампсии [44].
Протеинурия также может наблюдаться у беременных, перенесших трансплантацию почки. Терминальная стадия почечной недостаточности нарушает нормальную функцию половых желез и делает беременность относительно редкой [50]. Однако после успешной трансплантации почки фертильность улучшается в течение нескольких месяцев [51]. В случае зачатия после трансплантации влияние заболевания почек на исходы беременности зависит от степени почечной дисфункции, предшествующей гипертензии и степени протеинурии [52].Беременные женщины с артериальной гипертензией, перенесшие трансплантацию почки, подвергаются повышенному риску наложенной преэклампсии. Заболеваемость колеблется от 15 до 25% по сравнению с 5% при нормальной беременности [53].
Протеинурия, осложняющая ИМП при беременности
Инфекция мочевыводящих путей (ИМП) часто встречается во время беременности из-за застоя мочи и дилатации мочевыводящих путей [54]. Инфекция мочевыводящих путей может вызывать транзиторную протеинурию и должна быть исключена, прежде чем связывать протеинурию во время беременности с другой причиной, такой как хроническое заболевание почек или преэклампсия [55].Cote et al. сообщили, что ИМП может вызывать временное повышение экскреции белка (выше 30 мг/ммоль), поэтому ее следует исключить [10]. Некоторые недавние данные предполагают связь между ИМП и преэклампсией [56]. Однако к этим данным следует относиться с осторожностью.
В настоящее время Целевая группа по профилактике США рекомендует проводить скрининг преэклампсии у беременных женщин с измерением артериального давления на протяжении всей беременности. В соответствии с текущими рекомендациями преэклампсия может быть диагностирована при отсутствии протеинурии, что вызывает опасения по поводу достоверности имеющейся литературы, которая в основном основывалась на том, что протеинурия является обязательным признаком для диагностики преэклампсии.
Несмотря на тот факт, что большинство опубликованных данных указывает на благоприятный исход протеинурии во время беременности, нет доказательств того, что это относится к отдаленным исходам для почек, тогда как накапливаются данные о том, что преэклампсия увеличивает риск сердечно-сосудистых заболеваний.
Артериальная гипертензия может быть поздним последствием продолжающейся патологии, которая в конечном итоге приводит к повышению артериального давления. Отсутствуют данные о клинических проявлениях ранних изменений, предшествующих явной артериальной гипертензии.
Артериальное давление падает ниже нормы в первом триместре. Также неясно, каково нормальное значение артериального давления для беременных женщин. Необходима дополнительная исследовательская работа для определения норм для беременных женщин и разработки чувствительного инструмента скрининга для групп риска.
- [Авторы не указаны] (2019 г.) Практический бюллетень ACOG No.202: Гестационная гипертензия и преэклампсия. Obstet Gynecol 133: e1-1e25. [Перекрестная ссылка]
- Thornton CE, Makris A, Ogle RF, Tooher JM, Hennessy A (2010)Роль протеинурии в определении преэклампсии: клинические исходы для женщин и детей. Clin Exp Pharmacol Physiol 37: 466-470. [Перекрестная ссылка]
- Сибай Б.М. (1990) Эклампсия. VI. Материнско-перинатальный исход в 254 последовательных случаях. Am J Obstet Gynecol 163: 1049-1054.[Перекрестная ссылка]
- Уильямс Д., Дэвисон Дж. (2008) Хроническая болезнь почек при беременности. BMJ 336: 211-215. [Перекрестная ссылка]
- Dissanayake VH, Morgan L, Broughton Pipkin F, Vathanan V, Premaratne S, et al. (2004) Тест на коагуляцию белка мочи — полезный скрининговый тест на протеинурию во время беременности в развивающихся странах: исследование по валидации метода. БЙОГ 111: 491-494. [Перекрестная ссылка]
- Fine LG, Salehmoghaddam S (1990) Протеинурия.В: Уокер Х.К., Холл В.Д., Херст Дж.В., редакторы. Клинические методы: анамнез, физические и лабораторные исследования. 3-е издание. Бостон: Баттервортс, глава 192.
- Осман О., Бакаре А.О., Эламин С. (2011)Распространенность протеинурии среди беременных женщин, выявленная полуколичественным методом: опыт одного центра. Arab J Nephrol Transplant 4: 77-82. [Перекрестная ссылка]
- Котэ А.М., Фироз Т., Маттман А., Лам Э.М., фон Дадельзен П. и др.(2008) 24-часовой сбор мочи: золотой стандарт или историческая практика? Am J Obstet Gynecol 199: 625. [Crossref]
- Котэ А.М., Браун М.А., Лам Э., фон Дадельсен П., Фироз Т. и др. (2008) Диагностическая точность отношения белок пятна мочи: креатинин для протеинурии у беременных женщин с гипертонией: систематический обзор. BMJ 336: 1003-1006. [Перекрестная ссылка]
- Robert M, Sepandj F, Liston RM, Dooley KC (1997) Случайное соотношение белок-креатинин для количественного определения протеинурии во время беременности. Obstet Gynecol 90: 893-895. [Перекрестная ссылка]
- Neithardt AB, Dooley SL, Borensztajn J (2002)Прогнозирование 24-часовой экскреции белка при беременности с использованием соотношения белка и креатинина в однократной мочеиспускании. Am J Obstet Gynecol 186: 883-886. [Перекрестная ссылка]
- Hirshberg A, Draper J, Curley C, Sammel MD, Schwartz N (2014) Случайное соотношение белок-креатинин точно предсказывает исходную протеинурию на ранних сроках беременности. J Matern Fetal Neonatal Med 27: 1834-1838.[Перекрестная ссылка]
- Чен Б.А., Парвиайнен К., Джеябалан А. (2008) Корреляция соотношения белок/креатинин катетеризированной и чистой мочи при оценке преэклампсии. Obstet Gynecol 112: 606-610. [Перекрестная ссылка]
- Verdonk K, Niemeier IC, Hop WC, de Rijke YB, Steegers EA, et al. (2014) Изменение соотношения белка в моче к креатинину в течение дня у женщин с подозрением на преэклампсию. БЙОГ 121: 1660-1665. [Перекрестная ссылка]
- Papanna R, Mann LK, Kouides RW, Glantz JC (2008) Соотношение белок/креатинин при преэклампсии: систематический обзор. Obstet Gynecol 112: 135-144. [Перекрестная ссылка]
- Моррис Р.К., Райли Р.Д., Дуг М., Дикс Дж.Дж., Килби М.Д. (2012) Диагностическая точность отношения белка и альбумина к креатинину в разовой моче для выявления значительной протеинурии или неблагоприятного исхода беременности у пациенток с подозрением на преэклампсию: систематический обзор и метаанализ -анализ. BMJ 345: e4342. [Перекрестная ссылка]
- Висинтин С., Магглстоун М.А., Алмери М.К., Нхерера Л.М., Джеймс Д. и др.(2010) Ведение гипертонических расстройств во время беременности: краткое изложение руководства NICE. BMJ 341: c2207. [Перекрестная ссылка]
- Gillon TE, Pels A, von Dadelszen P, MacDonell K, Magee LA (2014)Гипертонические расстройства беременности: систематический обзор международных руководств по клинической практике. PLoS One 9: e113715. [Перекрестная ссылка]
- Nisell H, Trygg M, Bäck R (2006)Соотношение альбумин/креатинин в моче для оценки альбуминурии при гипертензии беременных. Acta Obstet Gynecol Scand 85: 1327-1330. [Перекрестная ссылка]
- Гао Ю.Ф., Хуан К.Т., Чжун М., Ван Ю., Ван В. и др. (2012) Диагностическое значение отношения альбуминурии радомного пятна к креатинину у женщин с преэклампсией. Чжунхуа Фу Чан Кэ За Чжи 47: 166-70. Китайский язык. [Перекрестная ссылка]
- Gangaram R, Naicker M, Moodley J (2009)Сравнение исходов беременности у женщин с гипертензивными нарушениями беременности с использованием 24-часового содержания белка в моче и отношения микроальбумина в моче к креатинину. Int J Gynecol Obstet 107: 19-22. [Перекрестная ссылка]
- Кайзер С. (2018) Гестационная протеинурия. https://hsc.ghs.org/obgyn-clinical-practice-guidelines/outpatient/gestational-proteinuria/ по состоянию на 07.04.2019.
- Холстон А.М., Цянь С., Ю К.Ф., Эпштейн Ф.Х., Каруманчи С.А. и соавт. (2009) Циркулирующие ангиогенные факторы при гестационной протеинурии без артериальной гипертензии. Am J Obstet Gynecol 200: 392.e1-10. [Перекрестная ссылка]
- Морикава М., Ямада Т., Минаками Х. (2009) Исход беременности у пациенток с изолированной протеинурией. Curr Opin Obstet Gynecol 21: 491-495. [Перекрестная ссылка]
- Морикава М., Ямада Т., Ямада Т., Чо К., Ямада Х. и др. (2008) Исходы беременности у женщин, у которых развилась протеинурия при отсутствии артериальной гипертензии после середины гестации. J Perinat Med 36: 419-424. [Перекрестная ссылка]
- Ямада Т., Обата-Ясуока М., Хамада Х., Баба Ю., Окучи А. и др. (2016)Изолированная гестационная протеинурия, предшествующая диагностике преэклампсии — обсервационное исследование. Acta ObstetGynecol Scand 95: 1048-1054. [Перекрестная ссылка]
- Andrea Kattah, NatasaMilic, Wendy White и Vesna Garovic (2017) Измерение белка в моче при нормотензивных беременностях, беременностях с изолированной протеинурией и преэклампсией. Am J Physiol Regul Integr Comp Physiol 313: R418-R424. [Перекрестная ссылка]
- Аканкша С., Стефи М. (2017) Аудит лечения гестационной протеинурии [25L]. Obstet Gynecol 129: S128.
- Gongora MC, Wenger NK (2015) Сердечно-сосудистые осложнения беременности. Int J Mol Sci 16: 23905-23928.
- Behrens I, Basit S, Lykke JA, Ranthe MF, Wohlfahrt J, et al. (2016) Связь между гипертоническими расстройствами беременности и последующим риском кардиомиопатии. JAMA 315: 1026-1033. [Перекрестная ссылка]
- Браун М.С., Бест К.Е., Пирс М.С., Во Дж., Робсон С.К. и др. (2013) Риск сердечно-сосудистых заболеваний у женщин с преэклампсией: систематический обзор и метаанализ. Eur J Epidemiol 28: 1-19. [Перекрестная ссылка]
- McDonald SD, Malinowski A, Zhou Q, Yusuf S, Devereaux PJ (2008) Сердечно-сосудистые последствия преэклампсии/эклампсии: систематический обзор и метаанализ. Am Heart J 156: 918-930. [Перекрестная ссылка]
- Vikse BE, Irgens LM, Leivestad T, Skjaerven R, Iversen BM (2008) Преэклампсия и риск терминальной стадии почечной недостаточности. N Engl J Med 359: 800-809. [Перекрестная ссылка]
- Wang IK, Muo CH, Chang YC, et al.(2013) Связь между гипертоническими расстройствами во время беременности и терминальной стадией почечной недостаточности: популяционное исследование. CMAJ 185: 207-213. [Перекрестная ссылка]
- Kattah AG, Scantlebury DC, Agarwal S, Mielke MM, Rocca WA, et al. (2017) Преэклампсия и тХПН: роль общих факторов риска. Am J Kidney Dis 69: 498-505. [Перекрестная ссылка]
- Скрининг на преэклампсию: Заявление о рекомендациях. Семейный врач .[Перекрестная ссылка]
- Williams Obstetrics (2014) 24 th edn, McGraw-Hill Professional. ISBN 9780071798938.
- Scantlebury DC, Schwartz GL, Acquah LA, White WM, Moser M, et al. (2013) Лечение гипертонии во время беременности: когда следует начинать прием лекарств от артериального давления? Curr Cardiol Rep 15: 412. [Crossref]
- День С, Хьюинс П., Хильдебранд С., Шейх Л., Тейлор Г. и др.(2008) Роль биопсии почки у женщин с заболеванием почек, выявленным во время беременности. Трансплантат нефролового набора 23: 201-206. [Перекрестная ссылка]
- Damm JA, Asbjörnsdóttir B, Callesen NF, Mathiesen JM, Lingholm L, et al. (2013)Диабетическая нефропатия и микроальбуминурия у беременных с сахарным диабетом 1 и 2 типа: распространенность, антигипертензивная стратегия и исход беременности. Diabetes Care 36: 3489-3494. [Перекрестная ссылка]
Руководство- KDIGO сосредоточено на темах, связанных с профилактикой или лечением людей с заболеваниями почек.http://kdigo.org/home/guidelines/.
- Каттах А.Г., Гарович В.Д. (2013) Лечение артериальной гипертензии во время беременности. Adv Chronic Kidney Dis 20: 229-239. [Перекрестная ссылка]
- Берри С., Атта М.Г. (2016)Гипертонические расстройства при беременности. World J Nephrol 5: 418-428. [Перекрестная ссылка]
- O’Donnell E, Floras JS, Harvey PJ (2014)Статус эстрогена и ренин-ангиотензин-альдостероновая система. Am J Physiol Regul Integr Comp Physiol 307: R498-R500. [Перекрестная ссылка]
- Чидамбарам М., Дункан Дж. А., Лай В. С., Каттран Д. С., Флорас Дж. С. и др. (2002)Изменение ренин-ангиотензиновой системы в течение нормального менструального цикла. J Am SocNephrol 13: 446-452. [Перекрестная ссылка]
- August P (2013) Преэклампсия: «нефроцентрический» взгляд. Adv Chronic Kidney Dis 20: 280-286. [Перекрестная ссылка]
- Конрад К.П. (2011)Возникающая роль релаксина в материнской адаптации к нормальной беременности: значение для преэклампсии. Семин Нефрол 31: 5-32. [Перекрестная ссылка]
- Scantlebury DC, Schwartz GL, Acquah LA, White WM, Moser M, et al. (2013) Лечение гипертонии во время беременности: когда следует начинать прием лекарств от артериального давления? Curr Cardiol Rep 15: 412. [Crossref]
- Пикколи Г.Б., Аттини Р., Виготти Ф.Н., Паризи С., Фассио Ф. и др. (2015) Является ли почечная гиперфильтрация защитной при хронической болезни почек на 1 стадии беременности? Шаг вперед, раскрывающий тайну влияния хронической болезни почек 1 стадии на исходы беременности. Нефрология (Карлтон) 20: 201-208. [Перекрестная ссылка]
- Reddy SS, Holley JL (2007) Ведение беременных с хроническим диализом. Adv Chronic Kidney Dis 14: 146-155. [Перекрестная ссылка]
- Дэвисон Дж. М. (1991) Диализ, трансплантация и беременность. Am J Kidney Dis 17: 127-132. [Перекрестная ссылка]
- Fischer MJ (2007) Хроническая болезнь почек и беременность: исходы для матери и плода. Adv Chronic Kidney Dis 14: 132–145. [Перекрестная ссылка]
- Подымов Т., Август П. (2007) Гипертония при беременности. Adv Chronic Kidney Dis 14: 178-190. [Перекрестная ссылка]
- Пикколи Г.Б., Аттини Р., Паризи С., Виготти Ф.Н., Дайдола Г. и др. (2013) Чрезмерное расширение мочевыводящих путей и протеинурия при беременности: распространенная и упускаемая из виду ассоциация?. BMC Nephrol 14: 52. [Crossref]
- Руководство по клинической практике доступно по адресу https://hsc.ghs.org/obgyn-clinical-practice-%20guidelines/outpatient/gestational-proteinuria/, по состоянию на 05.07.2019.
- Yan L, Jin Y, Hang H, Yan B (2018) Связь между инфекцией мочевыводящих путей во время беременности и преэклампсией: метаанализ. Медицина (Балтимор) 97: e12192. [Перекрестная ссылка]
Диагностическая точность отношения белка к креатинину в разовой моче для определения протеинурии и его связи с неблагоприятными исходами беременности у беременных с преэклампсией в Китае
DOI: 10.12809/hkmj154659
ОРИГИНАЛЬНЫЙ АРТИКУЛ
Диагностическая точность отношения белка к креатинину в разовой моче для определения протеинурии и его связи с неблагоприятными исходами беременности у беременных с преэклампсией в Китае
HC Cheung, MB, BS, MRCOG 1 ;
KY Leung, FRCOG, FHKAM (акушерство и гинекология) 1 ;
CH Choi, FHKCP, FHKAM (медицина) 2
1 Отделение акушерства и гинекологии, Больница королевы Елизаветы, Иордания, Гонконг
2 Медицинское отделение больницы королевы Елизаветы, Иордания, Гонконг
Полный
бумага в ПДФ Аннотация
Введение: Международные руководства имеют
Рекомендуемое соотношение белка и креатинина в разовой моче
>30 мг белка/ммоль креатинина в качестве альтернативы
к 24-часовому образцу мочи, чтобы представить значительный
протеинурия.Это исследование было направлено на определение
точность определения отношения белка к креатинину в разовой моче
в прогнозировании значительной протеинурии и неблагоприятных
исход беременности.
Методы: Эта серия случаев была проведена в
региональное акушерское отделение в Гонконге. В общей сложности
120 китайских беременных пациенток с преэклампсией
доставлен в больницу королевы Елизаветы с января
были включены с 2011 по декабрь 2013 года. Отношение
соотношения белка и креатинина в разовой моче и 24-часового
протеинурия; точность соотношения по отношению к 24-часовому
белок мочи при различных пороговых значениях; и отношения
такого соотношения и неблагоприятный исход беременности были
изучал.
Результаты: Отношение белка к креатинину разовой мочи было
коррелирует с 24-часовым белком мочи по Пирсону
коэффициент корреляции 0,914 (P<0,0001), когда
соотношение было <200 мг/ммоль. Оптимальный порог
соотношение белка и креатинина в разовой моче для диагностики
протеинурия у китайских беременных (33 мг/ммоль) была сходной
к заявленному в международной литературе (30 мг/ммоль). Отключение
20 мг/ммоль обеспечивали 100% чувствительность, а 52
мг/ммоль обеспечивали 100% специфичность.Там было
нет существенной разницы в соотношении белка и креатинина в разовой моче
соотношение между случаями с и без
неблагоприятный исход беременности.
Выводы: Отношение белка к креатинину в разовой моче
имел положительную и достоверную корреляцию с 24-часовым
моча приводит к преэклампсии китайских женщин, когда
отношение составляло <200 мг/ммоль. Тем не менее это соотношение
не является предиктором неблагоприятного исхода беременности.
Новые знания, добавленные этим исследованием - Отношение белка к креатинину в разовой моче (uPCR) имело положительную и достоверную корреляцию с результатами 24-часовой анализа мочи у китайских женщин с преэклампсией, когда uPCR был <200 мг/ммоль.
- uPCR не был прогностическим фактором неблагоприятного исхода беременности у китайских женщин с преэклампсией.
Значение для клинической практики или политики - Оптимальный порог для диагностики протеинурии у местного китайского населения был аналогичен 30 мг/ммоль, рекомендованным международными рекомендациями.
- Когда uPCR составляет <20 мг/ммоль (значительная протеинурия очень маловероятна) или >52 мг/ммоль (значительная протеинурия весьма вероятна), раннее клиническое лечение может быть облегчено, не дожидаясь результатов 24-часового определения белка в моче.
- Когда uPCR составляет ≥200 мг/ммоль, для точного количественного определения необходима 24-часовая моча, поскольку корреляция между
эти два теста ниже этого уровня.
Введение
Преэклампсия или протеинурическая гипертензия de novo
после 20 недель беременности1 является основной причиной
материнская и перинатальная заболеваемость и смертность
вследствие эклампсии, нарушений мозгового кровообращения, недоношенных
родоразрешение и ограничение роста плода.В промышленно развитых
странах заболеваемость составляет 3%.
до 5% беременностей.2 3 В масштабном исследовании, проведенном в Китае, гипертензивные расстройства осложняли 5,2% беременностей.
все беременности, причем более 50% из них
преэклампсия.4
Золотой стандарт диагностики протеинурии
наличие >300 мг белка в 24-часовом
образец мочи.1 Этот тест, однако, громоздкий.
и трудоемкий для женщин, стоил
последствия, может привести к задержке диагностики и
следовательно, управление из-за его времени оборота,
и может привести к неточным результатам из-за неполного
сбор или различное использование анализов.
Международные рекомендации одобрили пятно
отношение белка к креатинину в моче (uPCR)> 30
мг белка/ммоль креатинина в качестве альтернативы
24-часовой образец мочи для представления значительного
протеинурия.1 5 6 Метаанализы 2012 и 2013 гг.
показали, что материнская uPCR показала многообещающие
диагностическое значение значительной протеинурии у
подозрение на преэклампсию.7,8 Оптимальный порог для выявления значительной протеинурии варьировал от 0,30
до 0,35, и существовала значительная неоднородность в
диагностическая точность при большинстве пороговых значений
исследования.7 Более того, исследований по
диагностическое значение uPCR в китайской популяции.
Так как китаянки обычно имеют более низкую мускулатуру
массой, чем их западные аналоги, бывшие
может иметь более низкую экскрецию креатинина с мочой
которые могут изменить их уровень uPCR9 и, как следствие,
диагностическая точность uPCR.
Хотя некоторые исследования10, 11, 12 предполагают, что
протеинурия связана с неблагоприятным исходом беременности,
другие нет.1 13 В метаанализе 2012 г. было недостаточно доказательств того, что uPCR может
прогнозировать неблагоприятный исход беременности.7 Последние
рекомендации по артериальной гипертензии у беременных от
Национальный институт здравоохранения и передового опыта
рекомендовал исследование для выявления диагностических
пороги протеинурии, которые могут точно предсказать
клинически важные исходы.5
Целью данного исследования было определить
точность uPCR в прогнозировании значительных
протеинурия у местного населения и неблагоприятные
материнские или неонатальные исходы. Если uPCR может
точно предсказать значительную протеинурию и неблагоприятные
исходов беременности, она будет быстрой, приемлемой,
и потенциально рентабельная альтернатива 24-часовому
моча для анализа на белок.Клиническое управление
при подозрении на протеинурическую гипертензию при беременности
затем могут быть изменены для облегчения ранней диагностики
или исключение преэклампсии.
Методы
Все китайские беременные женщины с диагнозом
преэклампсия (новая протеинурическая гипертензия
после 20 недель беременности) и родивших
в больнице королевы Елизаветы в Гонконге с
с января 2011 г. по декабрь 2013 г. (36 месяцев) были
право на первоначальное включение в эту ретроспективу
изучать.Артериальная гипертензия определялась как артериальное давление
≥140/90 мм рт.ст. Определялась значительная протеинурия
как 24-часовой общий белок мочи ≥300 мг/день
или uPCR ≥30 мг/ммоль (местная лаборатория
ссылка), если первый был недоступен. Испытание
uPCR был доступен в течение длительного периода времени и
широко используется в нашем отделе с января
2011. Диагноз протеинурии в основном основывался
на 24-часовой анализ мочи, а не uPCR перед
Январь 2011 г. Женщины были исключены из
исследование, если у них были ранее существовавшие заболевания почек, хронические
артериальная гипертензия или сопутствующая инфекция мочевыводящих путей
(определяется положительной культурой средней порции мочи).Исследование было одобрено больничным исследованием и
комитет по этике как зарегистрированное исследование (Ref.: KC/KE-15-0025), с требованием информирования пациента
согласие отменено из-за его обратной силы.
В этом исследовании uPCR собирали как случайную
анализ мочи в любое время суток. Он был собран
при наличии положительного теста мочи на белок
или у женщин с артериальной гипертензией (даже
тест-полоска отрицательный) для подтверждения или исключения протеинурии.
Для суточной мочи женщинам выдавали
бутылка и инструкции по сбору всей мочи внутри
24-часовой период.Все коллекции отправлены в
лаборатории в течение 1 дня после завершения. Моча всего
белок измеряли турбидиметрическим методом
на основе реакции с хлоридом бензетония. Моча
креатинин измеряли кинетическим колориметрическим
анализ по методу Яффе. Оба теста были
на анализаторе Roche/Hitachi cobas c501.
(система cobas 6000; Roche Diagnostics GmbH,
Мангейм, Германия). Неточность (коэффициент
вариации) анализа белка мочи составил 3,7% при
0,18 г/л и 1,9% при 0.54 г/л. Неточность
креатинин мочи был 6,9% при 7,0 ммоль/л и
2,2% при 20,8 ммоль/л.
Для первичного анализа результатов женщины, которые
имели как uPCR, так и адекватные результаты 24-часовой мочи
собранные в течение 24 часов, были идентифицированы. 24 часа
сбор мочи часто был неточным (из-за чрезмерного или
недостаточная коллекция), даже если пациенты были
снабжен стандартной инструкцией. Это было
сообщили, что от 13% до 54% 24-часового сбора мочи
были неточными, с 24.8% пациентов, имеющих
разница ≥25% в результатах между коллекциями,
превышение аналитической и биологической изменчивости.14
Полнота сбора 24-часовой мочи была
оценивают по экскреции креатинина с мочой. Нормальный
диапазон экскреции креатинина с мочой был от 7 до 14.
ммоль/день в нашей лаборатории в соответствии с рекомендациями
продавец теста. С учетом средней массы тела
70 кг во время беременности и понимание того, что
экскреция креатинина с мочой остается неизменной
во время беременности этот референсный диапазон был совместим
с рекомендациями по общей нефрологии от 133 до 177
мкмоль/кг/день безжировой массы тела.15 Два анализа мочи
должны быть собраны в течение 1 дня, чтобы избежать эффекта
ежедневные колебания количества белка в
моча.
Для анализа вторичного исхода, неблагоприятный
материнские исходы были представлены тяжелыми
артериальная гипертензия (артериальное давление ≥160/110 мм рт.ст.),
повышенный фермент печени (аланинаминотрансфераза
или аспартатаминотрансфераза ≥70 МЕ/л), почечный
недостаточность (креатинин сыворотки ≥80 мкмоль/л),
тромбоцитопения (количество тромбоцитов <100 x 10 9 /л),
госпитализация в отделение интенсивной терапии (ОИТ), эклампсия,
или материнской смертности.Неблагоприятные неонатальные исходы
были представлены недоношенностью (роды в <37
недель беременности), низкий вес при рождении (<2500 г), маленький для гестационного возраста по данным местного населения,
низкая оценка по шкале Апгар (<7) через 1 и 5 минут
роды, госпитализация в отделение реанимации новорожденных
(ОИТН), мертворождение или ранняя неонатальная смерть. Данные для
материнские и неонатальные исходы были получены из
Анализ клинических данных больницы и отчетность
Системные и индивидуальные медицинские карты. Чтобы свести к минимуму
Влияние многоплодной беременности на клиническое
исход, учитывались только одноплодные беременности
для вторичного анализа результатов.Если более одного
образец uPCR был собран во время беременности,
первая uPCR в начале протеинурии была использована для
определить связь с неблагоприятными исходами.
Данные были проанализированы с использованием статистического пакета
для социальных наук (версия Windows 22.0; SPSS
Inc, Чикаго [Иллинойс], США). Для основного результата
анализ, взаимосвязь между uPCR и 24-часовым
мочи оценивали по коэффициенту корреляции Пирсона
после логарифмирования распределения данных
эти два параметра не были номинальными.Чувствительность,
специфичность, положительный и отрицательный прогностический
рассчитывали значения uPCR. Чувствительность
и специфичность uPCR при различных порогах отсечки.
анализируются по рабочим характеристикам приемника (ROC)
изгиб. Для вторичного анализа результатов использовали тест Манна-Уитни U для определения разницы
уровень протеинурии между случаями с или без
неблагоприятный исход беременности.
Результаты
Из 432 случаев преэклампсии, выявленных в течение 36-месячного периода исследования, 175 (40.5%) анализировали uPCR после исключения случаев без сбора uPCR
перед доставкой или заказом из-за индивидуальных
предпочтения клинициста или потому, что немедленное родоразрешение
ожидалось. Из этих 175 случаев 55 (31,4%) были
исключены после просмотра медицинских документов, в том числе
28 пациентов некитайского происхождения, 24 случая с ранее существовавшим
артериальная гипертензия или ранее существовавшее заболевание почек, один
женщина с активной инфекцией мочевыводящих путей, одна с
недостающая информация, и тот, кто не
родить в нашей больнице. Образцы мочи, взятые из
остальные 120 женщин в возрасте от 24
недель до 41 недели беременности.То
общие характеристики изучаемой популяции:
показано в таблице 1.
Таблица 1. Общая характеристика исследуемой популяции (n=120)
Отношение белка к креатинину в разовой моче и белок в суточной моче
Из этих 120 случаев 98 пар образцов мочи были
собрано, из них 12 неадекватных и 20
собраны с интервалом более 1 дня. Остальные 66
сочетается как с uPCR, так и с адекватной 24-часовой мочой
коллекция, доступная в течение 1 дня, была использована для
первичный анализ результатов.Средняя масса тела
из этих 66 женщин – 72,1 кг (диапазон 56,5–97,0 кг).
Два теста коррелировали с критерием Пирсона.
коэффициент корреляции ( r ) 0,914 (на рис. 1 видно, что положительный и линейный
корреляция между uPCR и 24-часовой мочой
белок был очевиден до uPCR 200 мг/ммоль.
При анализе подгрупп коэффициент корреляции составил
высокая (0,875) и значимая (P
Рис. 1. Индивидуальные значения отношения белка к креатинину мочи (uPCR) за 24 часа в разовой моче (n=66)
С местной лабораторной ссылкой uPCR
установлен на уровне 30 мг/ммоль, как это предлагается международными
руководства,1 5 6 положительное прогностическое значение
значительная протеинурия (определяется по 24-часовому анализу мочи
общий белок ≥300 мг/сут) составил 96%, чувствительность
96%, отрицательная прогностическая ценность 87% и специфичность
87%.Два ложноположительных случая и два ложноотрицательных
случаи были обнаружены. Для двух ложноположительных случаев
результаты 24-часовой мочи были 0,28 г / сут и 0,26 г / сут.
и соответствующие результаты uPCR составили 44 мг/ммоль.
и 31 мг/ммоль. Хотя эти
24-часовые результаты анализа мочи были отрицательными, эти женщины
впоследствии развилась протеинурия и были
подтверждена преэклампсия. Для двух ложноотрицательных
случаев их 24-часовые результаты мочи были 0,31
г/день и 0,38 г/день и соответствующие результаты uPCR
были 26 мг/ммоль и 21 мг/ммоль.
Площадь под ROC-кривой составила 0,981 (95%
доверительный интервал [ДИ], 0,954-1,000; Рис 2). То
оптимальный порог uPCR для диагностики протеинурии
составил 33 мг/ммоль. Это дало ту же чувствительность, но
несколько более высокая специфичность по сравнению с
предлагаемый порог 30 мг/ммоль,1 хотя
наблюдалось большое перекрытие 95% ДИ (таблица 2). А
более низкое пороговое значение 20 мг/ммоль, а не локальное
лабораторный эталон 30 мг/ммоль на uPCR
даст 100% чувствительность. Более высокое отсечение 52
мг/ммоль будет иметь 100% специфичность (таблица 2).
Рис. 2. Анализ характеристик оператора приемника (n=66)
Диагональные отрезки изготавливаются стяжками
Таблица 2. Сравнение точности uPCR с 24-часовым анализом белка мочи при различных пороговых значениях (n=66)
Отношение белка к креатинину в разовой моче и неблагоприятные исходы беременности
Для этого мы исключили 25 многоплодных беременностей.
анализ вторичного результата. Из оставшихся
95 одноплодных беременностей с преэклампсией,
средний гестационный возраст начала протеинурии был
35 недель и 64% были недоношенными (<37 недель) на момент
начало.
По материнскому исходу 47% женщин
развилась тяжелая гипертензия, у 6% развилась
повышенный уровень печеночных ферментов, 6% почечная недостаточность и
2% тромбоцитопения. Поступление в ОРИТ было
требуется на 16%. Случаев эклампсии или
материнская смертность. Существенные различия в uPCR
наблюдались в случаях с повышением и без
печеночные ферменты и тромбоцитопения, хотя
различия не были статистически значимыми из-за
малое количество случаев (табл. 3).
Таблица 3. Протеинурия, определенная с помощью uPCR, у пациенток с преэклампсией с неблагоприятными материнскими осложнениями и без них (n=95)
Для неонатального исхода всех одноплодных
беременностей, 60% родились с низкой массой тела при рождении,
21% с низкой оценкой по шкале Апгар через 1 минуту, 6% с
низкая оценка по шкале Апгар на 5-й минуте рождения и 54%
требуется госпитализация в ОРИТ. Не было случая
мертворождения или ранней неонатальной смерти. С другой
стороны, uPCR был значительно выше у новорожденных
которые нуждались в госпитализации в отделение интенсивной терапии, чем в тех,
кто этого не сделал.Тем не менее, если только женщины с началом
протеинурии до 34 недель были включены, есть
не было разницы в uPCR между новорожденными с
и без неонатальных осложнений (табл. 4).
Таблица 4. Протеинурия, определяемая с помощью uPCR, у пациенток с преэклампсией с неблагоприятными неонатальными осложнениями и без них
Обсуждение
В соответствии с предыдущими исследованиями,7 8 наше настоящее исследование
показал положительную и достоверную корреляцию
УПЦР с результатом 24-часовой мочи.Эта корреляция была
низкий и незначимый, если uPCR был ≥200 мг/ммоль.
Это похоже на вывод другого исследования, в котором
сообщили о более низкой положительной прогностической ценности между
24 — экскреция белка с мочой и uPCR для большего
степень протеинурии (>1 г/сут)16.
В настоящем исследовании оптимальный порог
uPCR для диагностики протеинурии составила 33 мг/ммоль.
Это дало аналогичную прогностическую ценность при сравнении
с предлагаемым порогом 30 мг/ммоль (табл. 2).1 Площадь под ROC-кривой в настоящем исследовании
было 0.981 и был сопоставим с результатом
метаанализ, который включал 24 испытания с 3186
участники, в которых область под сводкой
ROC-кривая составила 0,90 с объединенной чувствительностью и
специфичность 91% и 86,3% соответственно.8
Используя пороговые значения 20 и 52 мг/ммоль,
100% чувствительность и 100% специфичность соответственно.
(Таблица 2). Аналогичные выводы для порогового значения были
отмечено в систематическом обзоре семи исследований с
1717 пациентов.17 Случайные определения uPCR
полезны в первую очередь, когда они 600
мг/г (67.8 мг/ммоль), возможна значительная протеинурия.
быть установлен.
В клинической практике встречаются три сценария.
Во-первых, если uPCR >52 мг/ммоль (66% случаев в
настоящего исследования), значительная протеинурия будет
вероятная и положительная прогностическая ценность композита
неблагоприятный неонатальный исход будет высоким (78,7% в
настоящее исследование). Во-вторых, если uPCR равен 1. Сказав это, в случаях
гестационной гипертензии с протеинурией 30 мг/ммоль, особенно если она показывает нарастание
тенденция.
Если uPCR ≥200 мг/ммоль, корреляция с
Суточный анализ мочи будет низким. В таких случаях,
протеинурия должна быть подтверждена 24-часовым
измерение белка мочи. Вероятно, что
протеинурия нефротического диапазона выше этого
порог, что требует профилактики
тромбоэмболия.1
Спорно, может ли uPCR предсказать
клинический исход. Некоторые исследования10 11 12 предполагают
что протеинурия связана с неблагоприятным течением беременности
последствия, например, тяжелая артериальная гипертензия,
почечная недостаточность, заболевания печени, преждевременные роды,
малы для гестационного возраста и переведены в отделение интенсивной терапии.Тем не менее, последний ISSHP (Международное общество
по изучению артериальной гипертензии у беременных)
предполагает, что степень протеинурии обеспечивает очень
небольшая дополнительная стратификация риска в случаях преэклампсии,
и не включает его при определении
тяжесть заболевания.1 Недавние многоцентровые исследования PIERS
(Комплексная оценка риска преэклампсии) исследование
продемонстрировали, что ни uPCR, ни 24-часовая моча
выход белка был прогностическим фактором неблагоприятного перинатального
результат и, следовательно, пришел к выводу, что сумма
протеинурии не следует применять изолированно для
принятие решений у женщин с преэклампсией.13
В настоящем исследовании, посвященном преэклампсии в Китае,
женщин, uPCR был значительно выше
в случаях, требующих госпитализации в отделение интенсивной терапии. Этот
разница уже не была очевидной, если только случаи с
ранняя протеинурия была включена в анализ.
Это показывает, что наблюдаемая разница в uPCR
было связано со стратегией ведения недоношенных
родоразрешение при ранней преэклампсии
а не к тяжести самой протеинурии.
Исследование дает представление о точности
uPCR и его связь с беременностью
исходы у местного китайского населения.Тем не менее,
настоящее исследование было небольшим и ретроспективным. Только
те, у кого была действующая выборка мочи, были включены в
исследование и женщины с тяжелой преэклампсией, которые
требовалось немедленное лечение и родоразрешение.
не входит. Следовательно, на результаты повлияет
такое предвзятое отношение к выбору. Точность кривой ROC
ограничивается небольшим объемом выборки. Дальнейшие исследования
проспективным исследованием с синхронизированным сбором мочи
и больший размер выборки предлагается для проверки
выводы настоящего исследования.
Выводы
Имелась положительная и значимая корреляция
uPCR с 24-часовым результатом белка мочи на китайском языке
женщины с преэклампсией, когда uPCR <200
мг/ммоль. Значительная протеинурия, вероятно, может быть
исключаются при наличии uPCR <20 мг/ммоль,
но это следует учитывать, когда uPCR > 52 мг/ммоль. Значительная протеинурия должна быть
подтверждается 24-часовым сбором мочи при uPCR
составляет от 20 до 52 мг/ммоль, а uPCR не была значимой в
прогнозирование неблагоприятных исходов беременности.
Благодарности
Авторы благодарят доктора С.С. Шека из
отделение патологии королевы Елизаветы
больнице за ценную помощь в обеспечении
информация о лабораторных исследованиях. Мы бы также
хотел бы поблагодарить г-жу Дженис Юнг за ее любезное канцелярское
помощь в подготовке этой рукописи.
Декларация
Все авторы не сообщили о конфликте интересов.
Ссылки
1.Tranquilli AL, Dekker G, Magee L, et al. классификация,
диагностика и лечение гипертонических расстройств
беременности: пересмотренное заявление ISSHP.
Гипертензия беременных 2014;4:97-104. перекрестная ссылка
2. Хатчеон Дж.А., Лисонкова С., Джозеф К.С. Эпидемиология
преэклампсии и других гипертонических расстройств
беременности. Best Pract Res Clin Obstet Gynaecol
2011;25:391-403. перекрестная ссылка 3. Тан К.Х., Квек К., Йео Г.С. Эпидемиология преэклампсии
и эклампсии в женской и детской больнице КК,
Сингапур.Singapore Med J 2006; 47:48-53.
4. Ye C, Ruan Y, Zou L, et al. Исследование гипертоников 2011 г.
Нарушения беременности (БНБ) в Китае: распространенность, риск
факторы, осложнения, течение беременности и перинатальные исходы.
PLoS One 2014;9:e100180. перекрестная ссылка 5. Артериальная гипертензия при беременности: лечение
гипертонические расстройства во время беременности. NICE клинический
Руководство, № 107. Лондон: RCOG Press; 2010.
6. Lowe SA, Bowyer L, Lust K, et al. Руководство SOMANZ для
лечение гипертензивных расстройств беременных
2014.Aust NZJ Obstet Gynaecol 2015;55:e1-e29. перекрестная ссылка
7. Моррис Р.К., Райли Р.Д., Дуг М., Дикс Дж.Дж., Килби М.Д.
Диагностическая точность определения белка и альбумина в моче
к отношениям креатинина для выявления значительной протеинурии
или неблагоприятный исход беременности у пациенток с подозрением на
преэклампсия: систематический обзор и метаанализ. БМЖ
2012;345:e4342. перекрестная ссылка 8. Санчес-Рамос Л., Гиллен Г., Замора Дж., Стенякина А.,
Кауниц АМ. Соотношение белка и креатинина для
прогнозирование значительной протеинурии у пациентов из группы риска
преэклампсии: метаанализ.Энн Клин Лаборатория Науки
2013;43:211-20.
9. James GD, Sealey JE, Alderman M, et al. Продольный
исследование креатинина в моче и клиренса креатинина у
нормальные предметы. Расовые, половые и возрастные различия. Ам Дж
Hypertens 1988;1:124-31. перекрестная ссылка
10. Чан П., Браун М., Симпсон Дж. М., Дэвис Г. Протеинурия в
преэклампсия: насколько это важно? БДЖОГ 2005; 112:280-5. перекрестная ссылка
11. Торнтон К.Э., Макрис А., Огл Р.Ф., Туэр Дж.М., Хеннесси
А. Роль протеинурии в определении преэклампсии: клинические
результаты для женщин и детей.Клин Эксп Фармакол
Физиол 2010;37:466-70. перекрестная ссылка 12. Бузари З., Джавадианкутенай М., Дарзи А., Барат С. Доу
протеинурия при преэклампсии имеет достаточное значение для
прогнозировать исход беременности? Clin Exp Obstet Gynecol
2014;41:163-8.
13. Payne B, Magee LA, Côté AM, et al. Пирс протеинурия:
связь с неблагоприятным материнским и перинатальным исходом.
J Obstet Gynaecol Can 2011;33:588-97. перекрестная ссылка
14. Котэ А.М., Фироз Т., Маттман А., Лам Э.М., фон Дадельсен
П, Маги Л.А. Сбор мочи за 24 часа: золотой стандарт
или историческая практика? Am J Obstet Gynecol 2008;199:625.е1-6. перекрестная ссылка 15. Перроне Р.Д., Мадиас Н.Е., Леви А.С. Креатинин сыворотки как
индекс почечной функции: новое понимание старых концепций.
Clin Chem 1992; 38:1933-53.
16. Демирджи О., Кумру П., Арынкан А. и др. Точечное соотношение белок/креатинин при преэклампсии как альтернатива
белок мочи за 24 часа. Балкан Мед Ж 2015;32:51-5. перекрестная ссылка
17. Папанна Р., Манн Л.К., Куидес Р.В., Гланц Дж.К. Соотношение белок/креатинин при преэклампсии: систематический обзор.
Obstet Gynecol 2008;112:135-44. перекрестная ссылка
.
Артериальное давление
- Систолическое артериальное давление САД ≥ 140 мм рт. ст. или диастолическое артериальное давление ДАД ≥ 90 в двух случаях с интервалом не менее 4 часов после 20 недель беременности у женщины с ранее нормальным АД.
- Если САД ≥ 160 мм рт. ст. или ДАД ≥ 110 мм рт. ст., артериальная гипертензия может быть подтверждена в течение короткого промежутка времени (минут), чтобы избежать задержек с лечением.
И:
Протеинурия
- ≥ 300 мг в суточной моче или
- UPCR ≥ 0,3 мг/мг или
- Показания тест-полоски для определения белка в моче ≥ 2+, если количественное тестирование недоступно*
Или при отсутствии протеинурии впервые возникшая гипертензия с одним из следующих признаков:
Тромбоцитопения
- Количество тромбоцитов < 100 000/мкл
Почечная недостаточность
- Концентрация креатинина в сыворотке > 1.1 мг/дл или
- Удвоение концентрации креатинина в сыворотке крови при отсутствии других заболеваний почек.
Нарушение функции печени
- Повышение концентрации ферментов печени в крови в два раза выше нормы
Отек легких
Церебральные или зрительные симптомы
Белок (мг/дл)
Степень мутности
0
Прозрачный
1–10
Опаловый
15–30
Печать через трубку
40–100
Может читать только черные линии
150–400
Без видимых черных линий
> 500
Флокулянт


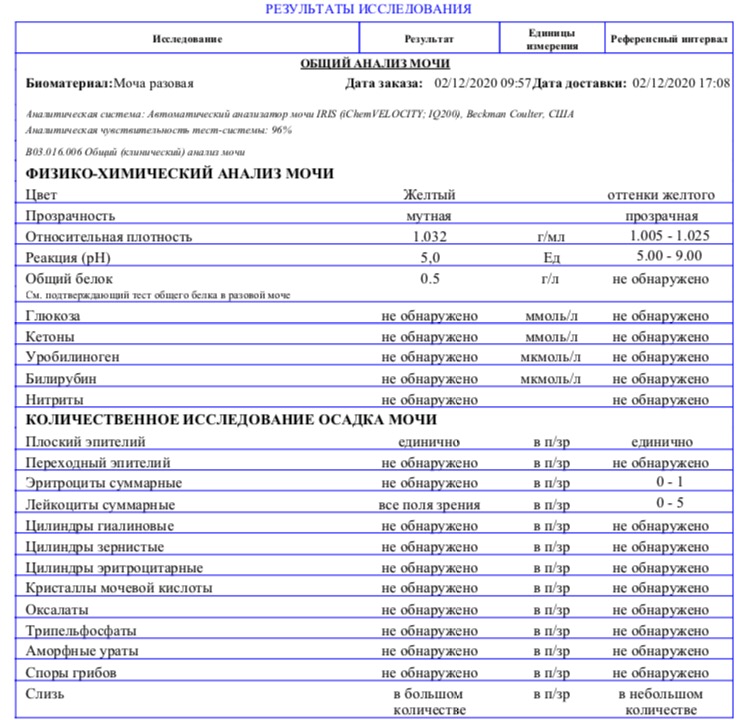 Резкое увеличение потребления соли приводит к повышению уровня белка в моче. Если нет сил устоять перед соленьями, стоит хотя бы отказаться от закусок с глутаматом натрия в составе.
Резкое увеличение потребления соли приводит к повышению уровня белка в моче. Если нет сил устоять перед соленьями, стоит хотя бы отказаться от закусок с глутаматом натрия в составе.

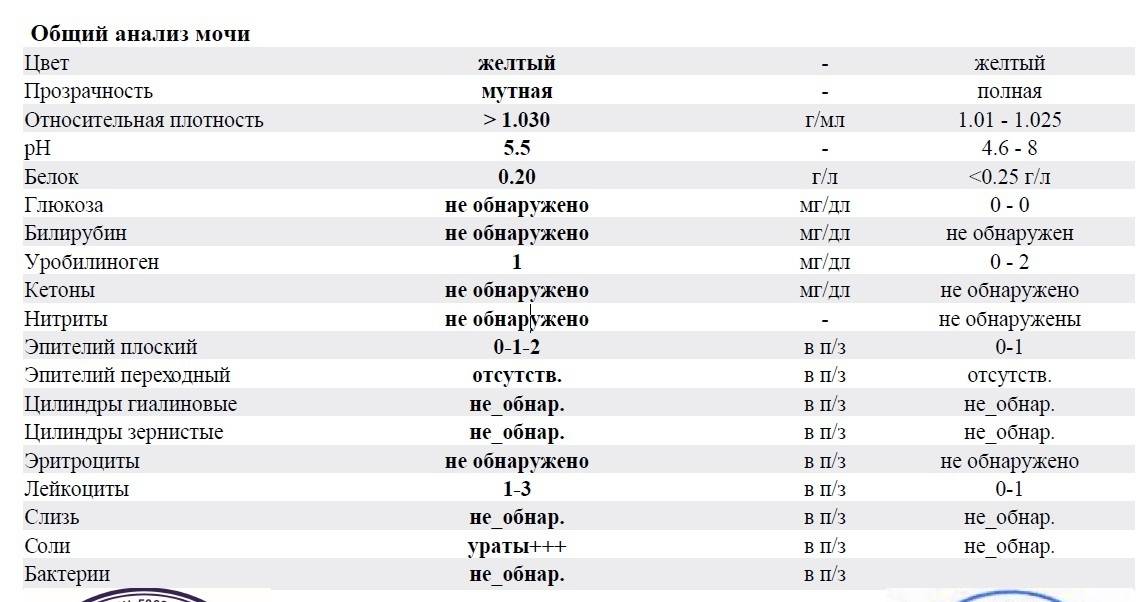

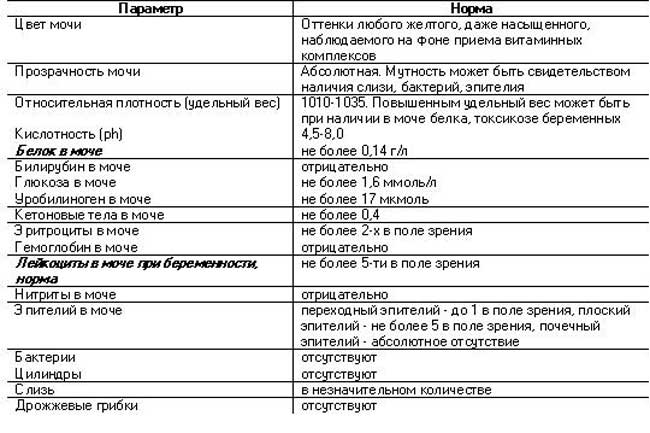
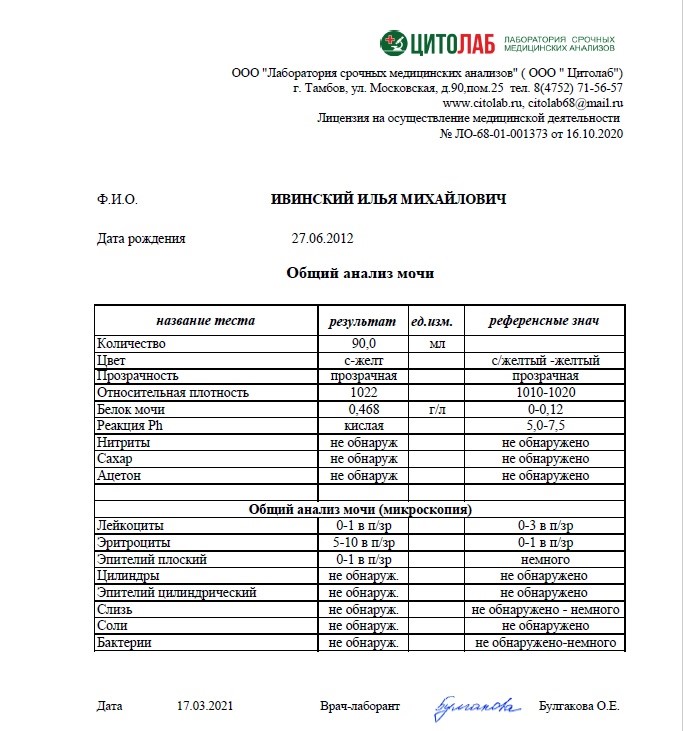 рт. ст. Концентрация белка в моче высокая и превышает 1 г. Это состояние известно в медицине как эклампсия, сопровождается потерей сознания, судорогами, рвотой, высоким давлением.
рт. ст. Концентрация белка в моче высокая и превышает 1 г. Это состояние известно в медицине как эклампсия, сопровождается потерей сознания, судорогами, рвотой, высоким давлением.
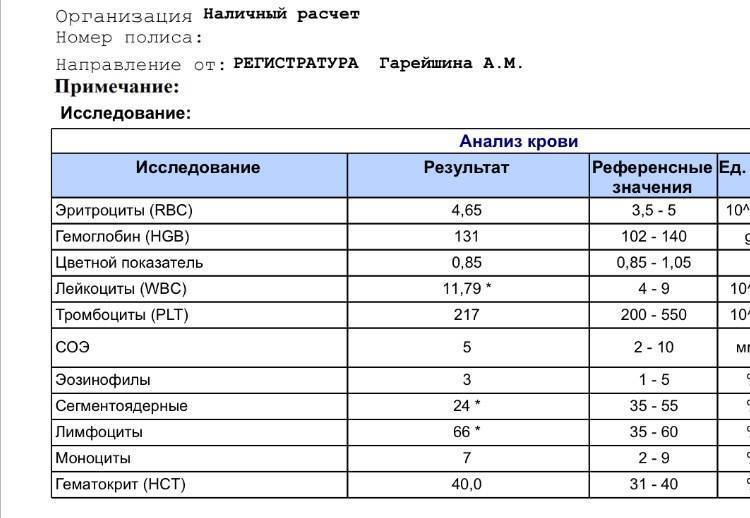
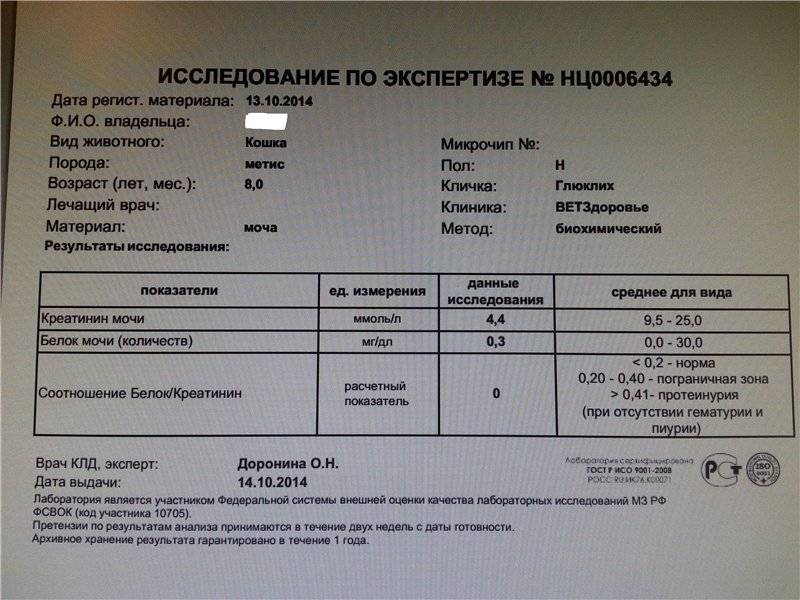
 Суточный анализ мочи на белок назначается, как правило, после того, как повышенный белок был обнаружен при общеклиническом анализе. Нормальные значения для суточного анализа: выделение белка 0,08-0,24 г/сут, концентрация – 0,0 – 0,14 г/л;
Суточный анализ мочи на белок назначается, как правило, после того, как повышенный белок был обнаружен при общеклиническом анализе. Нормальные значения для суточного анализа: выделение белка 0,08-0,24 г/сут, концентрация – 0,0 – 0,14 г/л;