Анализы на гормоны
Как правильно сдать анализы на гормоны
Анализы на фолликулостимулирующий (ФСГ) и лютеинезирующий (ЛГ) гормоны сдаются утром натощак, на 3-5 день цикла.
- За неделю до сдачи крови рекомендуется ограничить физическую активность,
- За 2-3 суток исключить алкоголь,
- В течение 3-х суток перед анализом соблюдать режим дня с полноценным сном и не допускать психоэмоциональных перегрузок.
Анализ на определение уровня прогестерона обычно сдают во второй половине менструального цикла (на 19-24 день).
Анализ на тестостерон рекомендуется сдавать на 2-5 день цикла.
Анализ на уровень эстрадиола в крови сдают натощак до 7 дня цикла.
Анализ на антимюллеров гормон (АМГ)

Анализ на пролактин сдают в разные фазы цикла. Как подготовиться?
- Накануне необходимо: исключить алкоголь, стрессовые ситуации, физическую и половую активность, не посещать баню и сауну.
- За 1 час, а лучше за сутки до сдачи анализа откажитесь от курения.
- Перед сдачей анализа необходимо посидеть в полном покое 10-15 минут.
Сдать анализы на гормоны женского и мужского профиля вы можете в нашей клинике “БэбиБум” в рабочие дни клиники с понедельника по пятницу, а также в любой другой лаборатории по месту жительства.
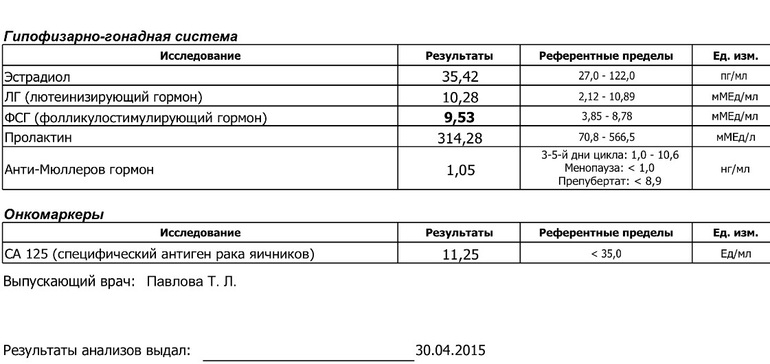
ПОЛОВЫЕ ГОРМОНЫ
Фолликулостимулирующий и лютеинезирующий гормоны
При нарушениях менструального цикла, отклонениях в половом развитии и в поисках причин мужского и женского бесплодия, репродуктолог направит вас сдать анализы на фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны. Оба гормона играют важную роль в процессе зачатия и оплодотворения.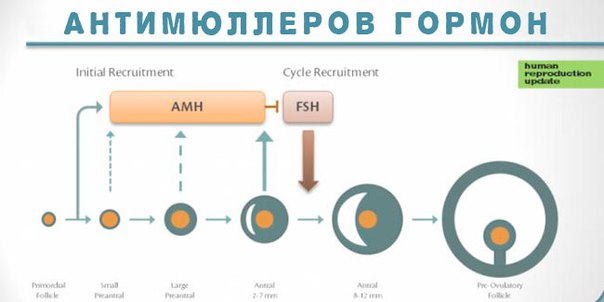
У женщин ФСГ и ЛГ контролируют развитие и функционирование фолликулов яичников. При овуляции вырабатывается наибольшее количество гормона, а затем происходит снижение его уровня. Соответственно при недостаточном уровне ФСГ фолликул не растет, а овуляция не происходит.
В мужском организме ФСГ отвечает за рост тестостерона в крови, активизирует развитие семявыносящих канальцев и семенников, созревание сперматозоидов.
Если фолликулостимулирующий гормон (ФСГ) выше нормы, это может сигнализировать о синдроме истощения яичников, аденоме гипофиза, о наличии эндометриоидных кист яичников, дисфункциональных маточных кровотечениях и др.
Предпосылками к повышению лютеинизирующего гормона (ЛГ) могут быть: аденома гипофиза, синдром истощения яичников, СПКЯ, эндометриоз, почечная недостаточность и др.
Снижение уровня лютеинизирующего гормона (ЛГ) может говорить о стрессе, ожирении, гиперпролактинемии, вторичной аменорее.
Прогестерон
Относится к стероидным гормонам. Вырабатывается яичниками, желтым телом и плацентой. Его также называют гормоном беременности.
Прогестерон необходим для успешной имплантации эмбриона в матке, его дальнейшего роста и развития.
Снижение уровня прогестерона может спровоцировать прерывание беременности.
Тестостерон
Относится к стероидным гормонам (андрогенам). Вырабатывается преимущественно у мужчин, у женщин вырабатывается в значительно меньшем количестве.
У женщин повышение уровня тестостерона может приводить к нарушениям менструального цикла и препятствовать наступлению овуляции – развивается гиперандрогенное бесплодие.
У мужчин снижение уровня тестостерона приводит к снижению оплодотворяющей способности спермы и эректильной дисфункции.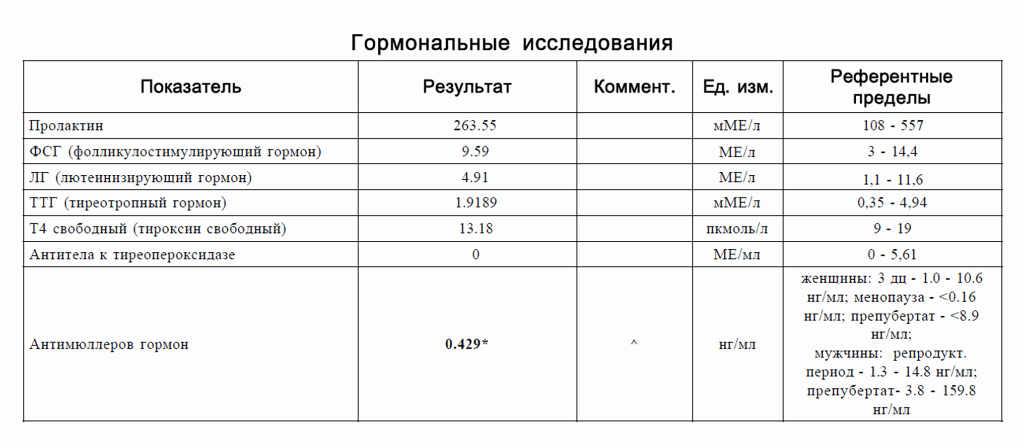
Пролактин
Пролактин — главный женский гормон, который контролирует процессы овуляции, несёт ответственность за детородные функции и циклы менструаций.
Выработка пролактина происходит в передних долях гипофиза, в головном мозге. Его количество резко возрастает под воздействием стрессовых факторов, эмоциональных и физических перенапряжений. Именно поэтому гормон ещё называют стрессовым.
Пролактин оказывает огромное влияние на работу репродуктивной системы женщин и мужчин.
Во время беременности и кормления грудью он выступает в роли естественного контрацептива, предупреждая зачатие.
Однако существуют патологические причины повышения уровня этого гормона в крови.
Врачи рекомендуют пройти обследование на пролактин, если у женщины длительное время не получается забеременеть, нарушился менструальный цикл, снизилось сексуальное влечение, увеличился вес, ухудшилась работа щитовидной железы.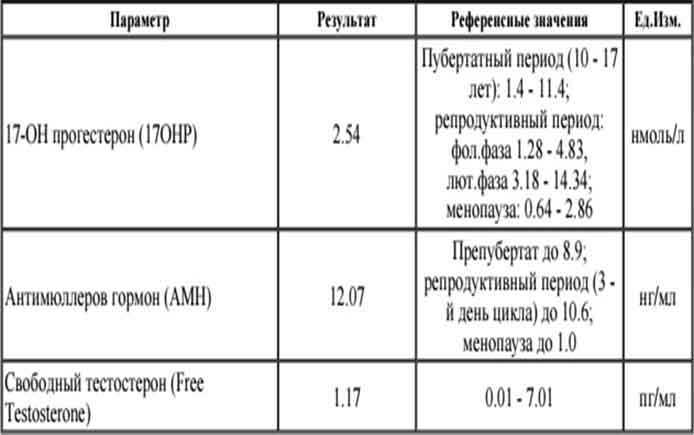 Более подробно о гиперпролактинемии читайте в нашей статье
Более подробно о гиперпролактинемии читайте в нашей статье
Эстрадиол
Женский стероидный гормон с наибольшей эстрогенной активностью, вырабатывается в основном в яичниках у женщин, в меньшей степени – яичками у мужчин, а также надпочечниками.
Эстрадиол влияет на общее состояние женщины: в первую очередь, он на функционирование яичников.
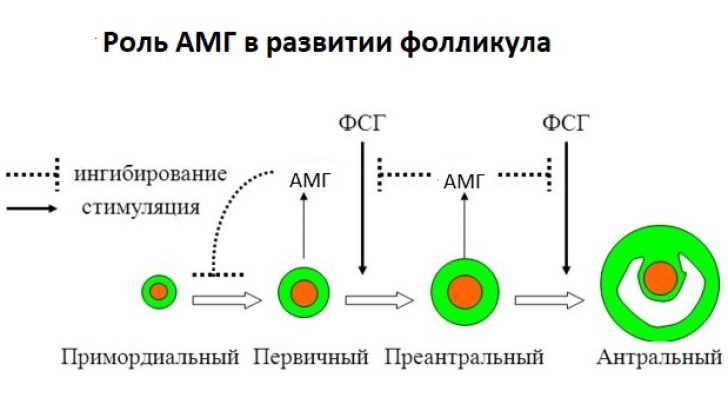
Антимюллеров гормон (АМГ)
Вырабатывается в организме мужчин и женщин.
Анализ крови на АМГ позволяет количественно оценить овариальный запас и спрогнозировать ответ яичников на стимуляцию овуляции.
Гормоны щитовидной железы
Большое значение имеет правильная работа щитовидной железы.
Ее состояние и функционирование отражает уровень тиреотропного гормона (ТТГ), свободного тироксина, антитела к тиреоглобулину и тиреопероксидазе.
При необходимости, коррекция уровня гормонов помогает подготовить организм женщины к ЭКО.
Какие именно анализы на гормоны нужно сдать, и в какие дни цикла потребуется провести исследования, определит ваш лечащий врач на консультации.
Антимюллеров гормон и синдром поликистозных яичников Текст научной статьи по специальности «Клиническая медицина»
ОБЗОРЫ
© И. П. николаенков, В. В. Потин, М. А. Тарасова
аитимюллеров гормон и синдром поликистозных яичников
НИИ акушерства и гинекологии им. Д. О. Отта СЗО РАМН, Санкт-Петербург
УДК: 618.11-006.2-031.14-07
■ Наиболее распространённой формой нормогонадотропной недостаточности яичников, гиперандрогенемии и ановуляторного бесплодия является синдром поликистозных яичников.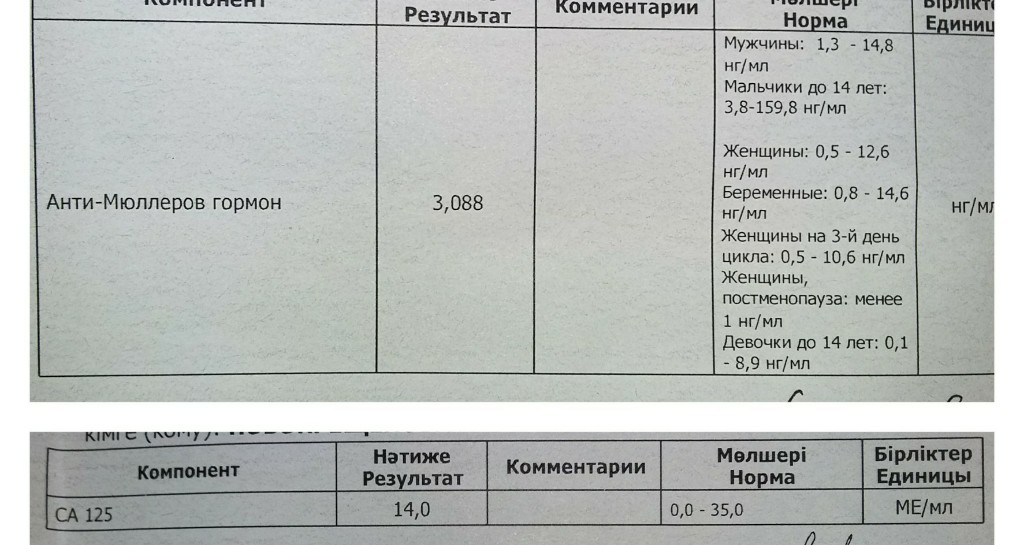 Одной из вероятных причин данной патологии является нарушение фолликулогенеза, которому сопутствует избыточная продукция тканью яичников антимюллерова гормона. Приведены современные данные о структуре, биологических свойствах
Одной из вероятных причин данной патологии является нарушение фолликулогенеза, которому сопутствует избыточная продукция тканью яичников антимюллерова гормона. Приведены современные данные о структуре, биологических свойствах
и о его роли в патогенезе синдрома поликистозных яичников.
■ Ключевые слова: антимюллеров гормон; синдром поликистозных яичников; ановуляция.
Синдром поликистозных яичников (СПЯ) — это заболевание, характеризующееся нарушением процессов фоллику-логенеза, задержкой фолликулов на стадии малых и больших антральных при сохранении числа примордиальных, отсутствием инициации доминантного фолликула и, как следствие, нарушением процессов овуляции, клинически проявляющимся опсо- и аменореей; гирсутизмом, угревой сыпью; изменением размера, формы и структуры яичников в виде их поликистозной трансформации [56].
 В этих пределах его частота варьирует у представительниц различных этнических групп [29]. В России она составляет 6,4 % [3]. СПЯ является самой распространённой формой гиперандрогенемии, занимая 80-90 % в его структуре [41].
В этих пределах его частота варьирует у представительниц различных этнических групп [29]. В России она составляет 6,4 % [3]. СПЯ является самой распространённой формой гиперандрогенемии, занимая 80-90 % в его структуре [41].СПЯ диагностируется у 15-20 % женщин с бесплодием [11]. Среди больных с функциональным бесплодием доля этого синдрома достигает 53 % [6], причём при ановуляции его частота приближается к 75 % [4].
Рядом исследователей было обнаружено повышение содержания антимюллерова гормона (АМГ) в крови [1, 2, 49], фолликулярной жидкости [17] и гранулёзных клетках ан-тральных фолликулов [1, 50] яичников больных СПЯ.
АМГ представляет собой димерный гликопротеид с молекулярной массой 140 кДа, состоящий из двух гомологичных субъединиц, объединенных дисульфидной связью. АМГ относится к семейству цитокинов трансформирующего фактора роста-Р (ТФР-Р) [17]. Это семейство включает в себя более тридцати пяти структурно схожих пептидов. Сюда входят ак-тивины, ингибины, костный морфогенетический белок [43].
Это семейство включает в себя более тридцати пяти структурно схожих пептидов. Сюда входят ак-тивины, ингибины, костный морфогенетический белок [43].Расщепляясь, АМГ образует активный С-концевой фрагмент. Его мишенями являются только органы репродуктивной системы. Члены семейства трансформирующего фактора роста-Р реализуют свои функции после взаимодействия с трансмембранными серин/треонин киназными рецепторами. АМГ действует на специфические рецепторы двух типов: АМГР-1 и АМГР-И. Рецепторы АМГ II типа появляются после соединения специфических лигандов, независимых от рецепторов I типа, однако для запуска сигнального пути действия АМГ необходимо наличие рецепторов обоих типов [20]. Рецепторы I типа имеют промежуточное значение, так как их активация происходит уже после запуска сигнального пути АМГ, когда рецепторы II типа уже активированы [38].
В середине ХХ века проведены первые эксперименты, показавшие, что эмбриональные яички млекопитающих выделяют субстанцию, которая способна вызывать регрессию Мюллерова протока и приводить к фенотипической перестройке организма по мужскому типу. Это вещество в
Это вещество в
1947 году впервые выделил французский эндокринолог Alfred Jost. Вещество было названо «антимюллеровская субстанция» или антимюл-леров гормон. В 1986 году АМГ был отнесён к семейству ТФР-ß [17].
АМГ продуцируется эмбриональными яичками и приводит к регрессии Мюллерова протока у плодов мужского пола. При дефиците АМГ или его рецептора формируется синдром персистен-ции Мюллерова протока, который характеризуется наличием маточных труб, матки и верхней трети влагалища у генетически-детерминиро-ванных плодов мужского пола [13].
Длительное время считалось, что АМГ выполняет исключительно функцию регрессии Мюллерова протока у плодов мужского пола, однако в дальнейшем выяснились иные функции этого гормона, относящиеся к тканям яичников, где АМГ продуцируется, начиная с 36-й недели внутриутробного развития [53] вплоть до менопаузы. В неонатальном периоде его уровень в сыворотке крови постепенно увеличивается, достигая максимума к пубертатному периоду, в течение репродуктивного возраста снижается и достигает неопределяемых значений к менопаузе [49]. Антимюллеров гормон продуцируется гранулёзными клетками растущих фолликулов от стадии первичных, достигая максимума в малых антральных и практически исчезает в фолликулах размерами более 9 мм [49]. Он не синтезируется ни атретическими фолликулами, ни клетками теки. Уровень АМГ в крови тесно коррелирует с количеством антральных фолликулов [21, 32, 39, 48, 50, 61].
В неонатальном периоде его уровень в сыворотке крови постепенно увеличивается, достигая максимума к пубертатному периоду, в течение репродуктивного возраста снижается и достигает неопределяемых значений к менопаузе [49]. Антимюллеров гормон продуцируется гранулёзными клетками растущих фолликулов от стадии первичных, достигая максимума в малых антральных и практически исчезает в фолликулах размерами более 9 мм [49]. Он не синтезируется ни атретическими фолликулами, ни клетками теки. Уровень АМГ в крови тесно коррелирует с количеством антральных фолликулов [21, 32, 39, 48, 50, 61].
Durlinger A. L. и соавторы [24] проводили обработку яичников двухдневных мышей рекомби-нантным АМГ. Контролем служили интактные яичники мышей того же возраста. В этот период яичники мышей содержат отдельные ооциты, примордиальные и единичные первичные фолликулы. Через два дня в исследуемой группе количество первичных фолликулов было на 40 % меньше, чем в контрольной группе. Из этого был сделан вывод, что АМГ тормозит формирование первичных фолликулов.
Из этого был сделан вывод, что АМГ тормозит формирование первичных фолликулов.
Grossman M. и соавторы [30] культивировали in vitro клетки гранулёзы, полученные из яичников женщин во время проведения экстракорпорального оплодотворения. В культуре клеток определяли содержание эстрадиола и уровень экспрессии матричной рибонуклеиновой кислоты цитохрома Р-450 (м-РНК СУР-19). Содержание эстрадиола было значимо больше там, где культивирование клеток происходило без добавления АМГ. Кроме того, обработка культуры клеток АМГ приводила как к сниже-
нию эстрадиола, так и к уменьшению содержания м-РНК СУР-19. Полученные результаты говорят о снижении экспрессии ФСГ-зависимой ароматазы клеток гранулёзы под воздействием АМГ.
Учитывая тот факт, что содержание АМГ в фолликулярной жидкости предоминантного и доминантного фолликулов ничтожно мало [49], т. е. АМГ находится в фолликулах, находящихся в стадиях, предшествующих гормонально-зависимому росту, некоторыми исследователями выдвинуто предположение, что АМГ защищает фолликулы от преждевременного ми-тогенного влияния фолликулостимулирующего гормона [1].
е. АМГ находится в фолликулах, находящихся в стадиях, предшествующих гормонально-зависимому росту, некоторыми исследователями выдвинуто предположение, что АМГ защищает фолликулы от преждевременного ми-тогенного влияния фолликулостимулирующего гормона [1].
Содержание в сыворотке крови АМГ отрицательно коррелирует с возрастом. В исследовании, охватившем более тысячи женщин от 20 до 50 лет с регулярным менструальным циклом, было показано, что среднее содержание АМГ в сыворотке крови женщин возрастной группы от 20 лет до 31 года составляет 4,2 нг/мл, тогда как к возрастному периоду от 41 года до 50 лет снижается до 0,6 нг/мл [32] (рис. 1).
АМГ,
нг/мл (№Уооисоавт.,2011)
4,5]
О -,-,-,-,-,-,
20-31 32-34 35-37 38-40 41-43 44-50
Рис. 1. Связь уровня АМГ с возрастом женщин
1. Связь уровня АМГ с возрастом женщин
Исследование, проведённое Saifer D. В. с соавторами [57] и охватившее 17120 женщин в возрасте от 24 до 50 лет позволило выявить не только средний уровень АМГ в крови, характерный для определённого возраста, но и определить темп снижения его уровня, который составил 0,2 нг/мл ежегодно до 40 лет и 0,1 нг/мл в год после 40 лет. Построение графика снижения АМГ для каждой конкретной женщины может дать достаточно точное представление о возрасте предстоящей менопаузы.
Имеются данные о том, что АМГ практически не подвержен колебаниям в течение менструального цикла [31, 37], не меняется во время бере-
менности [34], во время приема агонистов гона-дотропин-рилизинг гормона (аГРГ) [44] и контрацептивных препаратов [8, 21]. В дальнейшем было показано существенное его снижение в сыворотке крови при использовании комбинированных оральных контрацептивных препаратов, содержащих этинилэстрадиол и дезогестрел, вагинальных колец, содержащих этинилэстрадиол и этоногестрел и трансдермальных пластырей, содержащих этинилэстрадиол и норэлгестромин [33]. Кроме того, более низкие значения уровня АМГ были определены в крови у женщин, применявших гормональные контрацептивные препараты [22]. В течение менструального цикла незначительные колебания АМГ вполне могут присутствовать и характеризуются некоторым его снижением в секреторную фазу [59].
Кроме того, более низкие значения уровня АМГ были определены в крови у женщин, применявших гормональные контрацептивные препараты [22]. В течение менструального цикла незначительные колебания АМГ вполне могут присутствовать и характеризуются некоторым его снижением в секреторную фазу [59].
В отделениях вспомогательных репродуктивных технологий определение в крови АМГ является рутинным методом исследования, как прогностического критерия эффективности стимуляции яичников и получения необходимого числа ооцитов, удовлетворяющих репродук-тологическим критериям качества [7, 36, 61]. Содержание АМГ в сыворотке крови коррелирует с чувствительностью ответа яичников на гонадотропную стимуляцию [15]. В последние годы большое внимание уделяется изучению связи АМГ с синдромом гиперстимуляции яичников [46]. В проспективном исследовании была выявлена достоверная положительная связь эффективности стимуляции овуляции гонадотро-пинами с уровнем АМГ в сыворотке крови, а также с благоприятным течением последующей беременности [47]. F. J. и соавторами [14] исследование не подтвердило наличие закономерности исходов беременностей после ЭКО с содержанием АМГ в сыворотке крови. В этих исследованиях не выделялись группы больных с высоким содержанием АМГ в сыворотке крови, поэтому эти результаты могут значительно отличаться от предшествующих.
F. J. и соавторами [14] исследование не подтвердило наличие закономерности исходов беременностей после ЭКО с содержанием АМГ в сыворотке крови. В этих исследованиях не выделялись группы больных с высоким содержанием АМГ в сыворотке крови, поэтому эти результаты могут значительно отличаться от предшествующих.
Уровень АМГ резко повышен в крови 93 % больных гранулёзоклеточным раком яичников. Среднее его значение составляет 190,3 нг/мл при вариабельности от 2 нг/мл до 1124 нг/мл [54, 55]. Повышение содержания АМГ в сыворотке крови больных гранулёзоклеточным раком яичников на 4-5 месяцев предшествует развитию клинической картины этого заболевания, поэтому АМГ является высокоинформативным маркером и хорошим диагностическим критерием этого заболевания. Кроме того, АМГ является высокоинформативным критерием возможности послеоперационного рецидивирования гранулёзокле-точного рака. Несмотря на то, что большинство
опухолей яичников происходит из целомическо-го эпителия, в настоящее время всё большее количество исследований свидетельствует о том, что доля опухолей из фимбриального отдела маточных труб и прочих компонентов мюллеро-ва протока неуклонно растёт [23]. Так как АМГ приводит к редукции мюллеровых протоков у плодов мужского пола, возникло предположение о возможности применения АМГ для лечения опухолей этого происхождения. Причём in vitro уже получены данные о регрессе опухолевых клеток под воздействием АМГ. Masiakos P. T. с соавторами [42] провели обработку культур клеток, полученных от 27 больных с серозной цистаденокарциномой яичников Ш-1Устадии заболевания рекомбинантным АМГ. Те опухолевые клетки, которые содержали АМГР-II, в 82 % не создавали колоний и скорость их деления резко снижалась. Stephen A. E. и соавторы [58] проводили эксперименты, в которых лабораторным мышам под почечную капсулу вводились клетки рака яичника человека. После появления опухоли наблюдали за её ростом в контрольной группе и в группе мышей, парентерально получавших рекомбинантный АМГ. У мышей, получавших рекомбинантный АМГ в течение двух или трех недель, размеры опухоли были статистически значимо меньше.
Так как АМГ приводит к редукции мюллеровых протоков у плодов мужского пола, возникло предположение о возможности применения АМГ для лечения опухолей этого происхождения. Причём in vitro уже получены данные о регрессе опухолевых клеток под воздействием АМГ. Masiakos P. T. с соавторами [42] провели обработку культур клеток, полученных от 27 больных с серозной цистаденокарциномой яичников Ш-1Устадии заболевания рекомбинантным АМГ. Те опухолевые клетки, которые содержали АМГР-II, в 82 % не создавали колоний и скорость их деления резко снижалась. Stephen A. E. и соавторы [58] проводили эксперименты, в которых лабораторным мышам под почечную капсулу вводились клетки рака яичника человека. После появления опухоли наблюдали за её ростом в контрольной группе и в группе мышей, парентерально получавших рекомбинантный АМГ. У мышей, получавших рекомбинантный АМГ в течение двух или трех недель, размеры опухоли были статистически значимо меньше.
СПЯ характеризуется увеличением числа ан-тральных фолликулов в яичниках, отсутствием селекции доминантного фолликула при сохраненном числе примордиальных и первичных фолликулов. Одним из звеньев этих изменений фолликулогенеза может быть АМГ.
Одним из звеньев этих изменений фолликулогенеза может быть АМГ.
В конце 90-х годов прошлого столетия выявлено, что уровень АМГ в сыворотке крови больных СПЯ в 2-3 раза выше, чем у женщин с неизменёнными яичниками [27]. Изначально предполагалось, что это повышение связано с увеличением количества малых антральных фолликулов, затем было показано, что продукция АМГ гранулёзными клетками больных СПЯ, сопровождающегося ановуляцией, в 75 раз выше, чем в нормальных яичниках [49]. Кроме того было выявлено, что содержание АМГ в фолликулярной жидкости больных СПЯ, сопровождающегося ановуляцией, в 5 раз выше, чем у при СПЯ в овуляторном цикле [19]. Pellatt L. с соавторами [49] показали, что активность клеток гранулёзы, продуцирующих АМГ, у больных СПЯ в 18 раз выше, чем у здоровых женщин. В последующих исследованиях был найден ряд симптомов заболевания, с которыми коррелирует содержание АМГ в сыворотке крови больных СПЯ. Так, Piouka A. и соавторами [52] были выделены четыре группы больных СПЯ: в первой
группе у больных имелась ановуляция, проявляющаяся нарушением менструального цикла по типу опсо- или аменореи, гиперандрогенемия и поликистозная трансформация яичников по данным ультразвукового исследования, во второй — ановуляция и гиперандрогенемия, в третьей — гиперандрогенемия и поликистозная трансформация яичников, в четвертой — ановуляция и поликистозная трансформация яичников. Были обследованы 50 больных СПЯ, у 25 больных отмечалось ожирение, у 25 определялась нормальная масса тела. В контрольную группу входили женщины с овуляторным менструальным циклом. Содержание АМГ в сыворотке крови было значительно выше у больных первой и второй группы, чем у больных третьей и четвертой группы. У женщин контрольной группы уровень АМГ в крови был ниже, чем у больных третьей и четвертой группы. У женщин с ожирением уровень АМГ в крови был ниже, чем у женщин с нормальной массой тела. Pellatt L. с соавторами [50] показали, что увеличение числа фолликулов даёт только 5,3 % от прироста уровня АМГ, остальное же является результатом увеличенной его продукции клетками гранулёзы.
Были обследованы 50 больных СПЯ, у 25 больных отмечалось ожирение, у 25 определялась нормальная масса тела. В контрольную группу входили женщины с овуляторным менструальным циклом. Содержание АМГ в сыворотке крови было значительно выше у больных первой и второй группы, чем у больных третьей и четвертой группы. У женщин контрольной группы уровень АМГ в крови был ниже, чем у больных третьей и четвертой группы. У женщин с ожирением уровень АМГ в крови был ниже, чем у женщин с нормальной массой тела. Pellatt L. с соавторами [50] показали, что увеличение числа фолликулов даёт только 5,3 % от прироста уровня АМГ, остальное же является результатом увеличенной его продукции клетками гранулёзы.
При СПЯ происходит увеличение содержания в яичниках фолликулов размерами 2-7 мм, и отсутствует инициация доминантного фолликула, что вероятнее всего связано с блокированием АМГ экспрессии ФСГ-зависимой ароматазы клеток гранулёзы [30]. Рядом исследователей [24, 25, 62] показано, что АМГ тормозит формирование первичных фолликулов, задерживая их на стадии примордиальных. Кроме того, в исследованиях на мышах показано, что АМГ участвует в формировании пула примордиальных фолликулов [48].
Кроме того, в исследованиях на мышах показано, что АМГ участвует в формировании пула примордиальных фолликулов [48].
Причина повышения АМГ в сыворотке крови при СПЯ остаётся неизвестной. Повышенное его содержание в сыворотке крови может быть следствием воздействия ряда факторов, играющих ведущую роль в патогенезе СПЯ, например гиперандрогенемии. В поддержку этой гипотезы свидетельствуют данные о положительной корреляции между уровнем АМГ в крови и андроге-нами, независимо полученные Pigny P. и соавторами в 2003 году [51], Laven J. S.E. и соавторами в 2004 году [39] и Eldar-Geva T. и соавторами в 2005 году [26]. Так, в исследовании Pigny P. и соавторов [51], включившем 59 больных СПЯ и 45 женщин контрольной группы, была выявлена достоверная положительная связь между АМГ, уровнем свободного тестостерона и андростен-диона в сыворотке крови. У женщин с гипер-андрогенемией и поликистозно изменёнными яичниками уровень АМГ в сыворотке крови был
выше, чем у женщин с поликистозно изменёнными яичниками без гиперандрогенемии [26]. Но результаты последующих исследований скорее опровергают гипотезу о стимулирующем влиянии андрогенов на прирост АМГ, чем подтверждают её. Несмотря на то, что в начале исследования, проведённого Carlsen S. M. и соавторами [16], имелась прямая корреляция между уровнем АМГ и андрогенами в крови больных СПЯ, после шестимесячной торможения синтеза андрогенов дексаметазоном уровень АМГ оставался неизменным.
Но результаты последующих исследований скорее опровергают гипотезу о стимулирующем влиянии андрогенов на прирост АМГ, чем подтверждают её. Несмотря на то, что в начале исследования, проведённого Carlsen S. M. и соавторами [16], имелась прямая корреляция между уровнем АМГ и андрогенами в крови больных СПЯ, после шестимесячной торможения синтеза андрогенов дексаметазоном уровень АМГ оставался неизменным.
Помимо гиперандрогенемии, гиперинсули-немия также может претендовать на роль причины повышенного синтеза АМГ яичниками больных СПЯ. Значительно чаще гиперинсули-немия встречается у больных с ановуляторным, чем с овуляторным менструальным циклом [18]. Принимая во внимание факт усиления инсулином стимулированной гонадотропинами секреции андрогенов клетками гранулёзы и теки [64], нельзя исключить вторичной, опосредованной зависимости эффектов инсулина на синтез АМГ. Вместе с тем другими исследователями [35] связи уровня андрогенов и АМГ не было прослежено, но была продемонстрирована связь между содержанием АМГ в сыворотке крови и инсулинорезистентностью. Eldar-Geva T. с соавторами [26] и Pigny P. с соавторами [51] эта вероятная причина повышения уровня АМГ не была подтверждена. Кроме того, при снижении уровня инсулина в крови при лечении больных СПЯ и восстановлении овуляции, последующего уменьшения содержания АМГ в крови не происходило [12, 16]. Двойное слепое исследование, проведенное Carlsen S. M. с соавторами [16], включало 50 больных СПЯ, которые соблюдали диету и получали метформин в дозе 850 мг три раза в сутки. Больные были рандомизированы в 2 группы: 25 человек принимали 0,25 мг дек-саметазона ежедневно, 25 человек — плацебо. Исследование длилось 26 недель, завершило его 36 человек. Результаты оценивались спустя 8 и 26 недель лечения. Базальный уровень АМГ в крови, составивший в среднем 7,1 нг/мл, положительно коррелировал с уровнем тестостерона и отрицательно — с уровнем в крови ДГЭА-С. Шестимесячная терапия метформином и декса-метазоном не привела к снижению подавлению синтеза АМГ.
Eldar-Geva T. с соавторами [26] и Pigny P. с соавторами [51] эта вероятная причина повышения уровня АМГ не была подтверждена. Кроме того, при снижении уровня инсулина в крови при лечении больных СПЯ и восстановлении овуляции, последующего уменьшения содержания АМГ в крови не происходило [12, 16]. Двойное слепое исследование, проведенное Carlsen S. M. с соавторами [16], включало 50 больных СПЯ, которые соблюдали диету и получали метформин в дозе 850 мг три раза в сутки. Больные были рандомизированы в 2 группы: 25 человек принимали 0,25 мг дек-саметазона ежедневно, 25 человек — плацебо. Исследование длилось 26 недель, завершило его 36 человек. Результаты оценивались спустя 8 и 26 недель лечения. Базальный уровень АМГ в крови, составивший в среднем 7,1 нг/мл, положительно коррелировал с уровнем тестостерона и отрицательно — с уровнем в крови ДГЭА-С. Шестимесячная терапия метформином и декса-метазоном не привела к снижению подавлению синтеза АМГ.
Диетотерапия больных СПЯ, приводящая к увеличению количества овуляторных менструальных циклов, сопровождалась снижением уровня АМГ в сыворотке крови [45]. Thomson R. L. и соавторами [60] установили, что на фоне лечения метформином уже через месяц
Thomson R. L. и соавторами [60] установили, что на фоне лечения метформином уже через месяц
происходит уменьшение числа антральных фолликулов, но вместе с этим уровень АМГ в крови остаётся неизменным [12]. Через 4-8 месяцев применения метформина уровень АМГ в сыворотке крови больных СПЯ снижается [28].
Одним из самых надёжных методов достижения овуляции у больных СПЯ является стимуляция ФСГ. У женщин, получавших рекомбинант-ный человеческий ФСГ, содержание АМГ в сыворотке крови уменьшалось на фоне лечения [35], свидетельствуя о том, что снижение секреции АМГ является необходимым условием восстановления овуляции. Терапия ФСГ больных СПЯ приводит к значительному снижению продукции АМГ гранулёзными клетками, что не происходит в яичниках здоровых женщин [49]. Некоторые исследователи [27, 35] продемонстрировали отрицательную корреляцию между уровнями эстрадиола и АМГ в сыворотке крови больных СПЯ.
Важное место в лечении СПЯ занимает хирургический метод. Он применяется, претерпевая эволюционные изменения, на протяжении практически целого века. В мировой науке первое описание клинической картины СПЯ, а также метода хирургического лечения посредством клиновидной резекции трети каждого яичника, связана с именами И. Штейна и М. Левенталя и датируются 1935 годом. Тем не менее отечественным врачом С. К. Лесным уже в 1928 году были представлены сведения об эффективности клиновидной резекции яичников у больных с олиго-и аменореей, ожирением, гипертрихозом и увеличенными в размерах яичниками [5]. Свыше 30 лет клиновидная резекция яичников с удалением до 75 % их ткани оставалась единственным методом лечения СПЯ. Развитие лапароскопической техники позволило не только снизить частоту послеоперационных осложнений, характерных для лапаротомии, но и ввести этот метод в ряд рутинных способов лечения СПЯ. Оперативное вмешательство влечёт за собой уменьшение размеров яичников и снижение в крови АМГ, приводя к восстановлению овуляции [4].
Таким образом, в настоящее время получено достаточное количество данных о структуре и биологических свойствах антимюллерова гормона. Повышенное содержание АМГ в крови больных СПЯ следует считать твердо установленным фактом. Остается неясным вопрос: является ли это повышение АМГ вторичным по отношению к гипоталамо-гипофизарным нарушениям или первично-овариальным повреждениям, приводящим к увеличению числа антраль-ных фолликулов и ановуляции. Решить эту проблему помогут исследования, направленные на изучение связи АМГ и овариальной ароматазы.
Литература
1. Бебия З. Н., Орлов В. М. Антимюллеровый фактор. Журнал акушерства и женских болезней. 1999; 2: 66-70.
2. Боярский К. Ю., Гайдуков С. Н. Роль антимюллерова гормона (АМГ) в норме и при различных гинекологических заболеваниях.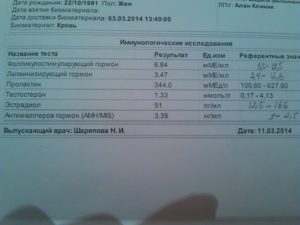 Журнал акушерства и женских болезней. 2009; 3: 74-83.
Журнал акушерства и женских болезней. 2009; 3: 74-83.
3. Дедов И. И., Г. А. Мельниченко, Т. В. Чеботникова и др. Распространенность и клиническая картина синдрома поликистозных яичников в популяции Москвы. Клиническая эндокринология. 2010; 4: 7-8.
4. Дедов И. И., Мельниченко Г. А. ред. Синдром поликистозных яичников: Руководство для врачей. М.: МИА; 2007.
5. Лесной С. К. Частичная резекция яичников при олигомено-рее и аменорее. Акушерство и гинекология. 1928; 7: 16-19.
6. Назаренко Т. А. Женское бесплодие, обусловленное нарушениями процесса овуляции (клиника, диагностика, лечение). Автореф. дис. … д-ра мед. наук. М. 1998.
7. Al-Qahtami A., GroomeN. Anti-Mullerian hormone: Cinderella finds new admirers. J. Clin. Endocrinol. Metab. 2006; 91: 3760-2.
Metab. 2006; 91: 3760-2.
8. ArboE., VetoriD. V., JimenezM. F. et al. Serum anti-mullerian hormone levels and follicular cohort characteristics after pituitary suppression in the late luteal phase with oral contraceptive pills. Human Reproduction. 2007; 22: 3192-6.
9. AsuncionM., CalvoR. M., San Millan J. L. et al. A prospective study of the prevalence of the polycystic ovary syndrome in unselected Caucasian women from Spain. J. Clin. Endocrinol. Metab. 2000; 85 (7): 2434-8.
10. AzzizR., WoodsK. S., ReynaR. et al. The prevalence and features of the polycystic ovary syndrome in an unselected population. J. Clin. Endocrinol. Metab. 2004; 89: 2745-9.
11. BadawyA., Elnashar A. Treatment options for polycystic ovary syndrome. Int. J. Womens Health. 2011; 3: 25-35.
12. BayrakA., TerbellH., Urwitz-LaneR. et al. Acute effects of met-formin therapy include improvement of insulin resistance and ovarian morphology. Fertil. Steril. 2007; 87: 870-5.
BayrakA., TerbellH., Urwitz-LaneR. et al. Acute effects of met-formin therapy include improvement of insulin resistance and ovarian morphology. Fertil. Steril. 2007; 87: 870-5.
13. BehringerR. R., FinegoldM. J., CateR. L. Mullerian inhibiting substance function during mammalian sexual development. Cell. 1994; 79: 415-25.
14. Broekmans F. J., Kwee J., Hendriks D. J. A systematic review of tests predicting ovarian reserve and IVF outcome. Hum. Re-prod. 2006; 12: 685-718.
15. Broer S., MolB. W., DollemanM. et al. The role of anti-Mullerian hormone assessment in assisted reproductive technology outcome. Curr. Opin. Obstet. Gynecol. 2010; 22: 193-201.
16. Carlsen S. M., Vanky E., FlemingR. Anti-Mullerian hormone concentrations in androgen-suppressed women with polycystic ovary syndrome. Hum. Reprod. 2009; 24: 1732-8.
Hum. Reprod. 2009; 24: 1732-8.
17. CateR. L., MattalianoR. J., Hession C. et al. Isolation of the bovine and human genes for Mullerian inhibiting substance and expression of the human gene in animal cells. Cell. 1986; 45: 685-98.
18. Conway G. S., JacobsH. S. Clinical implications of hyperinsu-linaemia in women. Clinical Endocrinology. 1993; 39: 623-32.
19. DasM., Gillott D. J., SaridoganE., Djahanbakhch O. Anti-Mulleri-an hormone is increased in follicular fluid from unstimulated
ovaries in women with polycystic ovary sundrome. Hum. Re-prod. 2008; 23: 2122-6.
20. de Santa Barbara P., Moniot B., Poulat F et al. Steroidogenic Factor-1 regulates transcription of the human anti-Mullerian hormone receptor. J. Biol. Chemistry. 1998; 273 (45): 2965460.
1998; 273 (45): 2965460.
21. Deb S., Campbell B. K, Pincott-Allen C. et al. Quantifying effect of combined oral contraceptive pill on functional ovarian reserve as measured by serum anti-Mullerian hormone and small antral follicle count using three-dimensional ultrasound. Ultrasound Obstet. Gynecol. 2012; 39 (5): 574-80.
22. DollemanM., Verschuren W. M., EijkemansM. J. et al. Reproductive and lifestyle determinants of anti-Mullerian hormone in a large population-based study. J. Clin. Endocrinol. Metabol. 2013; 98 (5): 2106-15.
23. DubeauL. The cell of origin of ovarian epithelial tumours. Lancet Oncol. 2008; 9: 1191-7.
24. Durlinger A. L., Gruijters M. J., Kramer P. et al. Anti-Mullerian hormone inhibits initiation of primordial follicle growth in the mouse ovary. Endocrinology. 2002; 143: 1076-84.
2002; 143: 1076-84.
25. Durlinger A. L., Visser J. A., Themmen A. P. Regulation of ovarian function: the role of anti-Mullerian hormone. Reproduction. 2002; 124: 601-9.
26. Eldar-Geva T., Margalioth E. J., Gai M. et al. Serum anti-Mulle-rian hormone levels during controlled ovarian hyperstimulation in women in polycystic ovaries with and without hyperan-drogenism. Hum. Reprod. 2005; 20: 1814-9.
27. Fallat M. E., Cook C., Siow Y., Carrillo A., Marra M. Mullerian-inhibiting substance in follicular fluid and serum: a comparison of patients with tubal factor infertility, polycystic ovary syndrome, and endometriosis. Fertil. Steril. 1997; 67: 962-5.
28. FlemingR., HarborneL., MacLaughlin D.T. et al. Metformin reduces serum Mullerian-inhibiting substance levels in women with polycystic ovary syndrome after protracted treatment. Fertil. Steril. 2005; 83: 130-6.
Fertil. Steril. 2005; 83: 130-6.
29. GoodarziM. O., QuinonesM. J., AzzizR. et al. Polycystic ovary syndrome in Mexican-Americans: prevalence and association with the severity of insulin resistance. Fertil. Steril. 2005; 84 (3): 766-9.
30. Grossman M., Nakajima S., FallatM., Siow Y. Mullerian inhibiting substance inhibits cytochrome P450 aromatase activity in human granulosa lutein cell culture. Fertil. Steril. 2008; 89: 1364-70.
31. Hehenkamp W. J., Looman C. W., Themmen A. P. et al. Anti-Mul-lerian hormone levels in the spontaneous menstrual cycle do not show substantial fluctuation. J. Clin.Endocrinol. Metabol. 2006; 91: 4057-63.
32. Ji Hee Yoo, Hye Ok Kim, Sun Wha Cha et al. Age specific serum anti-Mullerian hormone levels in 1,298 Korean women with regular menstruation. Clin. Exp. Reprod. Med. 2011; 38 (2): 93-97.
Clin. Exp. Reprod. Med. 2011; 38 (2): 93-97.
33. Kallio S., Puurunen J., RuokonenA. et al. Antimullerian hormone levels decrease in women using combined contraception independently of administration route. Fertil. Steril. 2013; 99 (5): 1305-10.
34. LaMarcaA., Giulini S., OrvietoR. et al. Anti-Mullerian hormone concentrations in maternal serum during pregnancy. Hum. Reprod. 2005; 20: 1569-72.
35. La Marca A., Orvieto R., Giulini S. et al. Mullerian-inhibiting substance in women with polycystic ovary syndrome: relationship with hormonal and metabolic characteristics. Fertil. Steril. 2004; 82: 970-2.
36. La Marca A., Sighinolfi G., Radi D. et al. Anti-Mullerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART). Hum. Reprod. 2010; 16: 113-30.
37. La Marca A., Stabile G., Artenisio A. C., Volpe A. Serum anti-Mul-lerian hormone throughout the human menstrual cycle. Hum. Reprod. 2006; 21: 3103-7.
La Marca A., Stabile G., Artenisio A. C., Volpe A. Serum anti-Mul-lerian hormone throughout the human menstrual cycle. Hum. Reprod. 2006; 21: 3103-7.
38. La Marca A., Volpe A. Anti-Mullerian hormone (AMH) in female reproduction: is measurement of circulating AMH a useful tool? Clin. Endocrinol. 2006; 64 (6): 603-10.
39. Laven J. S.E., Mulders A. M., Visser J. et al. Anti-Mullerian hormone serum concentrations in normoovulatory and anovula-tory women of reproductive age. J. Clin. Endocrinol. Metabol. 2004; 89: 318-23.
40. Lee M. M., Donahoe P. K., Hasegawa T. et al. Mullerian inhibiting substance in humans: normal levels from infancy to adulthood. J. Clin. Endocrinol. 1996; 81: 571-6.
41. LoboR. A., CarminaE. The importance of diagnosing the polycystic ovary syndrome Ann. Intern. Med. 2000; 132 (12): 989-93.
Med. 2000; 132 (12): 989-93.
42. MasiakosP. T., MacLaughlin D.T., Maheswaran S. et al. Human ovarian cancer, cell lines and primary ascites all express the human Mullerian inhibiting substance (MIS) type II receptor, bind and are responsive to MIS. Clin. Cancer Res. 1999; 5: 3488-99.
43. Massagué J. The transforming growth factor-b family. Ann. Rev. Cell Biol. 1990; 6: 597-641.
44. Mohamed K. A., Davies W. A., Lashen H. Antimullerian hormone and pituitary gland activity after prolonged down-regulation with goserelin acetate. Fertil. Steril. 2006; 86: 1515-7.
45. Moran L. J., NoakesM., Clifton P. M., Norman R. J. The use of anti-Mullerian hormone in predicting menstrual response after weight loss in overweight women with polycystic ovary syndrome. J. Clin. Endocrinol. Metabol. 2007; 92: 3796-802.
2007; 92: 3796-802.
46. Nakhuda G. S., Chu M. C., Wang J. et al. Elevated serum MIS levels may be a marker for ovarian hyperstimulation syndrome in normal women undergoing IVF. Fertil. Steril. 2006; 85: 1541-3.
47. Nelson S. M., Yates R. W., Lyall H. et al. Anti-Mullerian hormone-based approach to controlled ovarian stimulation for assisted conception. Hum. Reprod. 2009; 24: 867-75.
48. Nilsson E. E., Schindler R., Savenkova M. I., Skinner M. K. Inhibitory actions of anti-Mullerian hormone (AMH) on ovarian primordial follicle assembly. PLoS One. 2011; 6 (5): 20087.
49. PellattL., HannaL., BrincatM. et al. Granulosa cell production of anti-Mullerian hormone is increased in polycystic ovaries. J. Clin. Endocrinol. Metab. 2007; 92: 240-5.
50. PellattL., Rice S., Mason H. D. Anti-Mullerian hormone and polycystic ovary syndrome: a mountain too high? Reproduction. 2010; 139 (5): 825-33.
PellattL., Rice S., Mason H. D. Anti-Mullerian hormone and polycystic ovary syndrome: a mountain too high? Reproduction. 2010; 139 (5): 825-33.
51. Pigny P., Merlen E., Robert Y. et al. Elevated serum level of anti-Mullerian hormone in patients with polycystic ovary syndrome:
relationship to the ovarian follicle excess and to the follicle arrest. J. Clin. Endocrinol. Metabol. 2003; 88: 5957-62.
52. PioukaA., FarmakiotisD., KatsikisI. et al. Anti-Mullerian hormone levels reflect severity of PCOS but are negatively influenced by obesity: relationship with increased luteinizing hormone levels. Am. J. Physiol. Endocrinol. Metabol. 2009; 296: 238-43.
53. Rajperts-de MeytsE., JorgensenN, Graem N. et al. Expression of anti-Mullerian hormone during normal and pathological gonadal development: association with differentiation of Sertoli and granulosa cells. J. Clin. Endocrinol. Metabol. 1999; 84: 3836-44.
J. Clin. Endocrinol. Metabol. 1999; 84: 3836-44.
54. Rey R., Belville C., Nihoul-Fekete C. et al. Evaluation of gonadal function in 107 intersex patients by means of serum anti-Mullerian hormone measurement. J. Clin. Endocrinol. Metab. 1999; 84: 627-31.
55. Rey R., Sabourin J. C., Venara M. et al. Anti-Mullerian hormone is specific marker of sertoli- and granulose-cell origin in gonadal tumors. Hum. Pathol. 2000; 31: 1202-3.
56. Rotterdam E. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil. Steril. 2004; 81 (1): 19-25.
57. SeiferD. B., Baker V. L., LeaderB. Age-specific serum anti-Mullerian hormone values for 17,120 women presenting to fertility centers within the United States. Fertil. Steril. 2011; 95: 747-50.
58. Stephen A. E., Pearsoll L. A., Christian B. P. et al. Highly purified Mullerian inhibiting substance inhibits human ovarian cancer in vivo. Clin. Cancer Res. 2002; 8: 2640-6.
59. Streuli I., Fraisse T., Chapron C. et al. Clinical uses of anti-Mulle-rian hormone assays: pitfalls and promises. Fertil. Steril. 2009; 91: 226-30.
60. Thomson R. L., Buckley J. D., Moran L. J. et al. The effect of weight loss on anti-Mullerian hormone levels in overweight and obese women with polycystic ovary syndrome and reproductive impairment. Hum. Reprod. 2009; 24: 1976-81.
61. Van Rooij I. A., Broekmans F. J., te Velde E. R. et al. Serum anti-Mullerian hormone levels: a novel measure of ovarian reserve. Hum. Reprod. 2002; 17: 3065-71.
62. Visser J. A., Themmen A. P. Anti-Mullerian hormone and follicu-logenesis. Mol. Cell Endocrinol. 2005; 234: 81-6.
Visser J. A., Themmen A. P. Anti-Mullerian hormone and follicu-logenesis. Mol. Cell Endocrinol. 2005; 234: 81-6.
63. Wachs D. S., CofflerM. S., Malcom P. J., Chang R. J. Serum anti-Mullerian hormone concentrations are not altered by acute administration of follicle stimulating hormone in polycystic ovary syndrome and normal women. J. Clin. Endocrinol. Metabol. 2007; 92: 1871-14.
64. Willis D, Mason H, Gilling-Smith C, Franks S. Modulation by insulin of follicle-stimulating hormone and luteinizing hormone actions in human granulosa cells of normal and polycystic ovaries. J. Clin.Endocrinol. Metabol. 1996; 81: 302-9.
Статья представлена А. М. Гзгзяном, ФГБУ «НИИАГ им. Д. О. Отта» СЗО РАМН, Санкт-Петербург
anti-mullerian hormone and polycystic ovary syndrome
Nikolaenkov I. P., Potin V. V., Tarasova M. A.
P., Potin V. V., Tarasova M. A.
■ Summary: Polycystic ovary syndrome (PCOS) is the most common form of normogonadotropic ovarian insufficiency, hy-perandrogenaemy and anovulation sterility. One of the probable causes of this disease is disturbance of folliculogenesis, which is accompanied by overproduction of anti-Mullerian hormone (AMH) by ovarian tissue. There is a literature review about structure, biological properties and the role of AMH in pathogenesis of PCOS in this article.
■ Key words: Anti-Mullerian hormone, polycystic ovary syndrome, anovulation.
■ Адреса авторов для переписки-
Николаенков Игорь Павлович — аспирант. НИИ акушерства и гинекологии им. Д. О. Отта СЗО РАМН, отделение гинекологической эндокринологии. 199034, Россия, Санкт-Петербург, Менделеевская линия, д. 3. E-mail: Nikolaenkov_igor@ mail.ru
3. E-mail: Nikolaenkov_igor@ mail.ru
Потин Владимир Всеволодович — з. д. н. РФ, профессор, руководитель отделения гинекологической эндокринологии. НИИ акушерства и гинекологии им. Д. О. Отта СЗО РАМН. 199034, Россия, Санкт-Петербург, Менделеевская линия, д. 3. E-mail: [email protected]
Тарасова Марина Анатольевна — д. м. н., профессор. НИИ акушерства и гинекологии им. Д. О. Отта СЗО РАМН. 199034, Россия, Санкт-Петербург, Менделеевская линия, д. 3. E-mail: [email protected]
Nikolaenkov Igor Pavlovich — PhD student. D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS, Department of Gynecological Endocrinology. 199034 Russia, St. Petersburg, Mendeleyevskaya Line, 3. E-mail: E-mail: [email protected]
Potin Vladimir Vsevolodovich — PhD, Honoured figure, professor, Head of Gynecological Endocrinilogy Department. D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS. 199034 Russia, St. Petersburg, Mendeleyevskaya Line, 3. E-mail: [email protected]
D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS. 199034 Russia, St. Petersburg, Mendeleyevskaya Line, 3. E-mail: [email protected]
Tarasova Marina Anatol’evna — MD, PhD, specialist, professor. D. O. Ott Research Institute of Obstetrics and Gynecology, RAMS. 199034 Russia, St. Petersburg, Mendeleyevskaya Line, 3. E-mail: [email protected]
Бесплодие – Диагностика женщины | INVICTA
Фертильность и возраст женщиныСамым существенным отдельным фактором, влияющим на фертильность женщины, является возраст. В организме женщины на протяжении жизни происходят изменения, которые сокращают ее шансы на оплодотворение. Постепенно снижается количество фолликулов, оставшиеся стареют, увеличивается процент анеуплоидий (нарушений числа хромосом), что приводит к снижению шанса на оплодотворение и ростом риска потери беременности.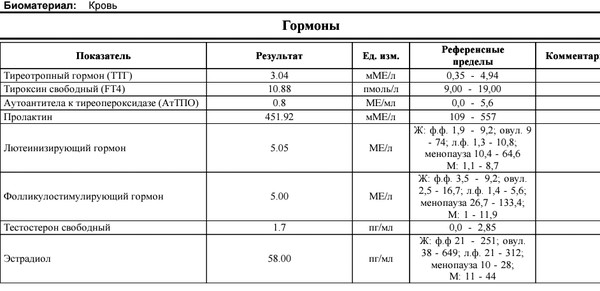
– ключевой элемент диагностики бесплодия
Генеративный потенциал женщины определяется на основании оценки ее яичникового запаса. Каждая женщина обладает определенным числом первичных фолликулов, часть которых расходуется в каждом цикле. Овариальный резерв зависит от числа оставшихся в яичнике первичных фолликулов. Это они могут превратиться в зрелую яйцеклетку.
Цель оценки овариального (яичникового) резерва:
- выявление молодых пациенток с пониженным яичниковым резервом – ускоренное лечение
- выявление пациенток среднего возраста, у которых все еще есть полноценные яйцеклетки – определение дальнейшего клинического ведения
- исключение пациенток, которые не имеют шансов на получение беременности (стоимость лечения, обременительность терапии)
AMH (антимюллеров гормон, АМГ, англ. Anti-Müllerian Hormone)
Anti-Müllerian Hormone)
AMH (англ. Anti-Müllerian Hormone) является гормоном, вырабатываемым как у женщин, так и у мужчин. У женщин AMH вырабатывается в фолликулах в яичнике клетками, окружающими яйцеклетки, готовые к росту. Уровень AMH не обусловлен менструальным циклом женщины, поэтому его можно определять в произвольный день цикла. Его уровень уменьшается с возрастом женщины, в связи с чем он является очень хорошим маркером снижения фертильности, в том числе преждевременного угасания функции яичников. У пациенток с СПЯ (PCO, синдром поликистозных яичников) уровень AMH значительно повышен.
ИНГИБИН B (INHIBIN B)
ИНГИБИН B используется для оценки овариального резерва. Ингибин B вырабатывается зернистыми клетками ранних антральных фолликулов. Это вещество выделяется главным образом во время фолликулярной фазы менструального цикла. Его концентрация в ранней фолликулярной фазе отражает число и качество фолликулов. Существует положительное соотношение между концентрациями ингибина B и количеством антральных фолликулов, оцениваемых в ультразвуковом обследовании в первых днях менструального цикла.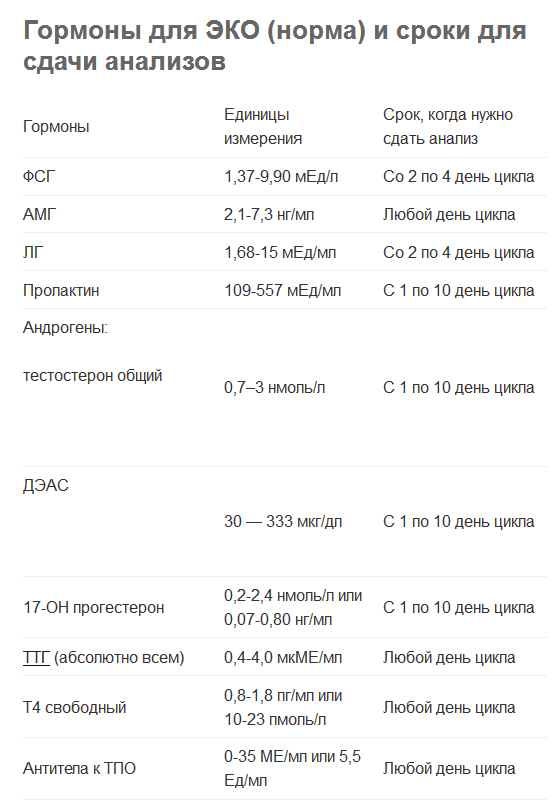
AFC
Другим важным анализом являтся AFC (оценка количества антральных фолликулов). В этом случае дополнительную информацию о яичниковом резерве дает ультразвуковое обследование. При помощи УЗИ можно оценить эндометрий и структуру яичника, число антральных фолликулов (пузырьков с размерами 2-6 мм) и рост пузырька у пациенток с нарушениями овуляции или прошедших отбор для лечения методами вспомогательной репродукции.
ЛАБОРАТОРНЫЕ АНАЛИЗЫ – ДИАГНОСТИКА БЕСПЛОДИЯ У ЖЕНЩИНЛабораторные анализы, если выполнены и интерпретированы правильно, представляют собой значимый диагностический инструмент. Основная диагностическая панель INVICTA включает у женщин набор 12 лабораторных анализов.
ЗАГАДОЧНЫЙ АНТИМЮЛЛЕРОВ ГОРМОН. Почему так важен для женщины?
Когда самое подходящее время для беременности? Ведь к этому моменту хочется стабильного финансового и семенного положения, а время идет, и биологические часы не стоят на месте. Способность женщины к зачатию уменьшается с возрастом. Одним из показателей возможного бесплодия является уровень антимюллерова гормона. С репродуктологом клиники репродукции «Вита ЭКО» Еленой Голеневой разберемся, что это за гормон, когда необходимо контролировать уровень АМГ, какие нормы для него существуют.
Способность женщины к зачатию уменьшается с возрастом. Одним из показателей возможного бесплодия является уровень антимюллерова гормона. С репродуктологом клиники репродукции «Вита ЭКО» Еленой Голеневой разберемся, что это за гормон, когда необходимо контролировать уровень АМГ, какие нормы для него существуют.
Елена Михайловна, что это за гормон?
Антимюллеров гормон (АМГ) вырабатывается в яичниках и показывает их потенциал. Его количество позволяет довольно точно определить так называемый «овариальный резерв» – сколько фолликулов потенциально готовы к овуляции, а значит, – насколько велика вероятность зачатия. Также уровень АМГ является лабораторным показателем приближения менопаузы.
Когда следует контролировать уровень АМГ?
1. Всем женщинам после тридцати лет, даже если не планируется беременность.
2. Обязательно смотреть АМГ перед операциями на яичниках. При низком уровне необходимо проконсультироваться с репродуктологом, так как после хирургического вмешательства на яичниках АМГ может снижаться до критически низких цифр, что резко снижает шансы на наступление беременности.
В каких случаях еще необходим анализ на гормон?
Кроме определения фолликулярного запаса яичников, результат анализа может быть использован для других показаний:
• Прогнозы успеха для проведения ЭКО
• Точное назначение гормональной стимуляции для лечения бесплодия
• Снижение риска гиперстимуляции
• Диагностика преждевременного истощения яичников или раннего климакса
• Диагностика синдрома поликистозных яичников
Как правильно сдавать анализ?
Хотя уровень АМГ не зависит от фазы менструального цикла, обычно его сдают вместе с другими гормональными анализами, на 3-5 день цикла. Специальной подготовки перед сдачей крови на АМГ не требуется.
Какая норма антимюллерова гормона у женщины?
Наиболее высокие показатели АМГ наблюдаются в репродуктивном периоде жизни женщины: 2 – 7 нг/мл. После 37 лет с уменьшением запаса фолликулов в яичнике уровень АМГ начинает снижаться. При показателях ниже единицы ЭКО за счет средств ОМС, скорее всего, пройти не получится, так как во время стимуляции яичников созревает меньше пяти фолликулов.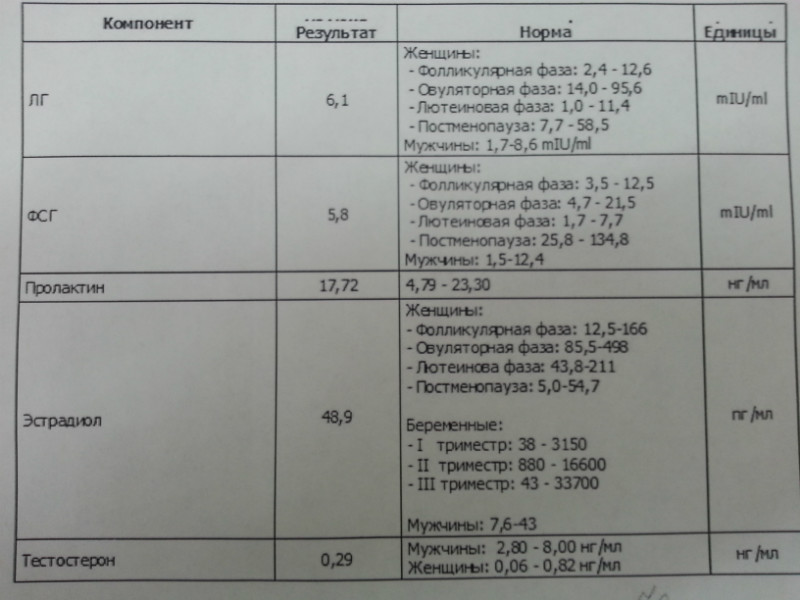 Соответственно, шансы на наступление беременности снижаются. Низкий уровень АМГ – не приговор, а всего лишь повод обратиться к репродуктологу в ближайшее время.
Соответственно, шансы на наступление беременности снижаются. Низкий уровень АМГ – не приговор, а всего лишь повод обратиться к репродуктологу в ближайшее время.
Низкий уровень АМГ является косвенным признаком снижения качества яйцеклеток. Но, в большей степени, это зависит от возраста женщины. Гормон нельзя повысить лекарствами! Но можно подобрать индивидуальный протокол стимуляции яичников. При крайне низком уровне АМГ (менее 0,3 нг/мл) и неудачных попытках ЭКО с собственными яйцеклетками, есть вариант использования донорских клеток в дальнейших программах ЭКО.
Не теряйте драгоценное время! Запишитесь на прием к репродуктологу!
г. Вологда, ул. Герцена, д. 50
Звоните! (8172) 26-44-26
Антимюллеров гормон
Антимюллеров гормон
Антимюллеров гормон (ингибирующее вещество Мюллера)
Anti Mullerian Hormone
Антимюллеров гормон – это биологически активное вещество, которое вырабатывают клетки Сертоли яичек у мужчин и зернистые клетки яичников у женщин. Основная его функция – дифференциация половых органов у эмбрионов.
Основная его функция – дифференциация половых органов у эмбрионов.
Антимюллеров гормон начинает вырабатываться у эмбрионов мужского пола с 7 недели развития. Он внутриутробно угнетает развитие женских половых органов из мюллерового протока и стимулирует мужские. У эмбрионов женского пола антимюллеров гормон внутриутробно не вырабатывается, что предопределяет развитие женских половых органов из мюллерового протока.
Антимюллеров гормон у мальчиков регулирует процесс опускания яичек в мошонку, а у мужчин – синтез андрогенов и процесс сперматогенеза. У девочек он начинает вырабатываться в пубертатный период клетками фолликул. То есть его уровень прямо зависит от количества яйцеклеток, которые находятся в яичниках и не зависит от фазы менструального цикла. С возрастом количество яйцеклеток уменьшается, и уровень антимюллерового гормона тоже. Низкий уровень антимюллерового гормона свидетельствует о развитии менопаузы в ближайшие 5 лет. В этот период его уровень минимальный или не определяется вообще.
Подготовка пациентов согласно общих правил
Ограничения:
- исключить прием эстрогенов и андрогенов за 48 часов до обследования
Материал: сыворотка крови
Транспортная среда: вакутейнер с активатором свертывания с/без гелевой фазы, объемом 4 или 6 мл
Стабильность пробы:
- 8 часов при температуре +20 – +250С
- 48 часов при температуре +2 – +80С
- 30 дней при температуре – 200С
- замораживать только 1 раз
Метод: электрохемилюминисцентный
Анализатор: Cobas e411
Тест-система: AMH, Roche Diagnostics, Германия
Референсные значения (норма):
|
Возрастная группа |
Нормативные значения, нг/мл |
|
|
Женщины |
Мужчины |
|
|
0 — 17 лет |
0. |
3.8 – 159.8 |
|
18 — 99 лет |
0.08 – 12.6 |
1.3 – 14.8 |
Основные показания для назначения анализа:
В педиатрии:
- определение пола (показатель наличия ткани яичек в организме)
- нарушение сроков полового созревания
У женщин:
- бесплодие
- определение резерва яйцеклеток
- синдром поликистозных яичников
- подозрение на гранулезный рак яичников и контроль его лечения
- определение вероятности развития менопаузы
У мужчин:
Интерпретация результатов:
Увеличение концентрации:
- синдром поликистозных яичников
- гормонально активные опухоли яичек или яичников
- преждевременное половое созревание у женщин
- задержка полового созревания у мужчин
Уменьшение концентрации:
- низкий функциональный резерв яичников (осталось малое количество яйцеклеток)
- задержка полового созревания у женщин
- отсутствие или недоразвитие яичек
- синдром персистирующего протока Мюллера (постоянно функционирующего)
- преждевременное половое созревание у мужчин
- ожирение
- менопауза
- прием препаратов: метилдопа
АМГ — антимюллеров гормон — ОВУМ – медицинская лаборатория в Кемерοво
Описание
АМГ — антимюллеров гормон
У женщин:
Антимюллеров гормон (АМГ) — гликопротеин, секретируется гранулезными клетками зреющих фолликулов яичников женщин. У женщин Мюллеровы протоки являются предшественниками матки, фаллопиевых труб и верхней части влагалища.
У женщин Мюллеровы протоки являются предшественниками матки, фаллопиевых труб и верхней части влагалища.
У женщин до наступления пубертата уровень АМГ относительно низкий по сравнению с мужчинами. После наступления пубертата концентрация АМГ медленно снижается до периода менопаузы.
АМГ- маркер овариального резерва, позволяющий оценить фертильность женщины. Концентрация АМГ у женщин коррелирует с числом антральных фолликулови не зависит от уровня гонадотропинов, с возрастом отражает снижение репродуктивной функции (40-100 фолликулов исчезают в течение одного менструального цикла). Число фолликулов начинает резко уменьшаться после 30 лет.
АМГ- показатель биологического возраста женщины. Число фолликулов начинает резко уменьшаться после 30 лет. Чем старше женщина, тем меньше у неё фолликулов и меньше концентрация АМГ.
У женщин исследование АМГ позволяет точно определиться со сроком планирования беременности.
Одиночное измерение АМГ, на любой день менструального цикла дает полную клиническую информацию о состоянии овариального резерва.
Показания к определению АМГ:
-оценка овариального резерва и перименопаузальных изменений у женщин фертильного возраста,
— диагностика преждевременного или замедленного полового созревания,
— как онкомаркер для выявления и контроля за лечением при гранулезоклеточном раке яичников.
У мужчин
АМГ вырабатывается клетками Сертоли яичек. В период эмбрионального развития у мужчин АМГ необходим для регрессии Мюллеровых протоков. Нарушение функции АМГ вызывает у мужчин сохранение дериватов Мюллеровых протоков, что проявляется крипторхизмом, паховыми грыжами и нарушениями репродуктивной функции.
У мужчин секреция АМГ клетками Сертоли начинается в период эмбриогенеза и продолжается на протяжении всей жизни, после пубертатного периода его экспрессия снижается. АМГ подтверждает приближающееся половое созревание у мальчиков. При половом созревании уровень АМГ резко снижается (концентрация АМГ обратно коррелирует с уровнем тестостерона), а уровень ингибина В- растет.
Показания к определению АМГ:
— дифференциальная диагностика интерсексуальных расстройств,
— установление пола в сомнительных случаях
— диагностика крипторхизма и анорхизма,
— выявление преждевременного или замедленного полового созревания,
— оценка функции яичек у мужчин в любом возрасте.
Референтные интервалы АМГ в сыворотке крови:
У женщин до 10,6 нг/мл; медиана 1,5
У мужчин 0,8-14,6 нг/мл; медиана 5,3
Правила подготовки
Антимюллеров гормон (AMH/MIS) в медицинском центре «Академия здоровья»
Антимюллеров гормон (АМГ, АМH, МIS) — димерный гликопротеин, принадлежащий к семейству β-трансформирующих факторов роста.
Мужчины. Во время дифференциации плода мужского пола АМГ продуцируется клетками Сертоли и индуцирует дегенерацию мюллерова протока. Нарушение функции АМГ вызывает у мужчин сохранение дериватов мюллеровых протоков. Это состояние клинически проявляется крипторхизмом, паховыми грыжами и нарушением репродуктивной функции и названо синдромом персистенции мюллеровых протоков (СПМП). До наступления половой зрелости АМГ продуцируется яичками, а затем его уровень постепенно снижается до остаточных постпубертатных значений. АМГ участвует в трансформации гоноцитов и сперматогоний, тормозя до позднего пубертата вхождение половых клеток в мейоз и пролиферацию клеток Лейдига. Андрогены и развивающиеся сперматоциты ингибируют секрецию АМГ. В отсутствие андрогенов и герминативных клеток (или при резистентности к андрогенам) под вдиянием ФСГ увеличивается выработка АМГ клетками Сертоли. Уровень АМГ в норме повышен в сыворотке мужчин в препубертатном периоде. Концентрация АМГ падает в период пубертата, далее у взрослых мужчин АМГ поддерживается на относительно низком уровне в течение жизни. Антимюллеров гормон используется в диагностике преждевременного пубертата – снижение АМГ относительно возраста; отсроченного полового развития — АМГ повышен относительно возраста, в оценке тестикулярной функции.
Это состояние клинически проявляется крипторхизмом, паховыми грыжами и нарушением репродуктивной функции и названо синдромом персистенции мюллеровых протоков (СПМП). До наступления половой зрелости АМГ продуцируется яичками, а затем его уровень постепенно снижается до остаточных постпубертатных значений. АМГ участвует в трансформации гоноцитов и сперматогоний, тормозя до позднего пубертата вхождение половых клеток в мейоз и пролиферацию клеток Лейдига. Андрогены и развивающиеся сперматоциты ингибируют секрецию АМГ. В отсутствие андрогенов и герминативных клеток (или при резистентности к андрогенам) под вдиянием ФСГ увеличивается выработка АМГ клетками Сертоли. Уровень АМГ в норме повышен в сыворотке мужчин в препубертатном периоде. Концентрация АМГ падает в период пубертата, далее у взрослых мужчин АМГ поддерживается на относительно низком уровне в течение жизни. Антимюллеров гормон используется в диагностике преждевременного пубертата – снижение АМГ относительно возраста; отсроченного полового развития — АМГ повышен относительно возраста, в оценке тестикулярной функции. В дошкольном возрасте АМГ является маркёром наличия тестикулярной ткани в условиях, когда концентрация тестостерона очень низка. Сдать кровь на анализ крови мужчинам, сдледует подготавливаясь также ка ки женщинам.
В дошкольном возрасте АМГ является маркёром наличия тестикулярной ткани в условиях, когда концентрация тестостерона очень низка. Сдать кровь на анализ крови мужчинам, сдледует подготавливаясь также ка ки женщинам.
Женщины. У плодов женского пола AMГ продуцируется гранулезными клетками яичника в постнатальном периоде. Экспрессия АМГ начинается в гранулёзных клетках первичных фолликулов, максимальна в гранулёзных клетках преантральных и малых антральных фолликулов, далее постепенно снижается на последующих стадиях развития фолликулов и практически отсутствует при размере фолликулов более 8 мм. АМГ не экспрессируется во время финальных ФСГ — зависимых стадий роста фолликула. В яичнике AMГ ингибирует селекцию примордиальных фолликулов, а также стимуляцию фолликулогенеза ФСГ. Тот факт, что AMГ специфически продуцируется в гранулезных клетках растущих, но неселектированных фолликулов делает его идеальным маркером для определения размера фолликулярного резерва яичника. К тому же АМГ не контролируется гонадотропинами, не вовлечен в классическую петлю обратной связи (в отличие от ФСГ, эстрадиола и ингибина В), не зависит от менструального цикла, действует не как системный, а скорее как паракринный фактор регуляции и отражает популяцию фолликулов в яичнике. Уровни АМГ в крови отражают число фолликулов в яичниках женщины, способных к репродукции и обеспечивающих ежемесячную овуляцию. Низкие уровни АМГ в крови связаны с малым количеством фолликулов в яичниках, вследствие чего АМГ все чаще измеряется у женщин, проходящих лечение по поводу бесплодия. Уровень АМГ повышен при синдроме поликистозных яичников, при котором отмечается увеличение пула антральных фолликулов. Увеличение количества антральных фолликулов в 2-3 раза сопровождается 2-3 кратным увеличением уровня AMГ в сыворотке крови. Еще одна область применения АМГ — выявление гранулёзоклеточных опухолей яичников, при наличии которых уровень АМГ существенно повышается.
Уровни АМГ в крови отражают число фолликулов в яичниках женщины, способных к репродукции и обеспечивающих ежемесячную овуляцию. Низкие уровни АМГ в крови связаны с малым количеством фолликулов в яичниках, вследствие чего АМГ все чаще измеряется у женщин, проходящих лечение по поводу бесплодия. Уровень АМГ повышен при синдроме поликистозных яичников, при котором отмечается увеличение пула антральных фолликулов. Увеличение количества антральных фолликулов в 2-3 раза сопровождается 2-3 кратным увеличением уровня AMГ в сыворотке крови. Еще одна область применения АМГ — выявление гранулёзоклеточных опухолей яичников, при наличии которых уровень АМГ существенно повышается.
Подготовка к исследованию: Женщинам исследование обычно проводят на 3 — 5-й день цикла. За 3 дня до сдачи крови на анализ исключить интенсивные спортивные тренировки, исследование не следует проводить во время любых острых заболеваний. За 1 час до взятия крови не курить.
антимюллеровский гормон (АМГ) | Сеть гормонального здоровья
Что делает антимюллеров гормон?
Когда вы ждете ребенка, антимюллеров гормон (АМГ) играет важную роль в его развитии. Этот гормон способствует репродуктивному развитию плода мужского пола. До рождения АМГ вырабатывается в семенниках и яичниках плода.
Этот гормон способствует репродуктивному развитию плода мужского пола. До рождения АМГ вырабатывается в семенниках и яичниках плода.
Примерно через восемь недель после зачатия у плода имеются как мюллеровы (женские), так и волльфианские (мужские) протоки, которые могут развиться в мужскую или женскую репродуктивную систему.Если у плода есть XY (мужские) хромосомы, семенники будут производить АМГ, и мюллеровы протоки исчезнут. Затем тестостерон, вырабатываемый в яичках, будет способствовать развитию мужской репродуктивной системы. Если у плода есть ХХ (женские) хромосомы, недостаток тестостерона приведет к исчезновению воллфиевского протока и развитию женской репродуктивной системы.
AMH также играет роль в половом созревании и в яичниках и семенниках взрослых. В яичниках это помогает на раннем этапе развития фолликулов.Фолликулы удерживают и поддерживают яйца до оплодотворения. Большое количество фолликулов яичников означает, что яичники могут вырабатывать большее количество АМГ. Уровни АМГ можно измерить, чтобы определить, сколько фолликулов у женщины в яичниках.
Уровни АМГ можно измерить, чтобы определить, сколько фолликулов у женщины в яичниках.
Какие проблемы могут возникнуть с AMH?
Если мужской плод не производит достаточного количества АМГ, Мюллеров проток не исчезает, что может привести к аномальному развитию репродуктивной системы. У пациентов может быть диагностирован стойкий синдром мюллерова протока.Это редкое заболевание, но симптомы включают низкий уровень или отсутствие сперматозоидов.
У женщин АМГ вырабатывается в зрелом возрасте. Измерение уровня АМГ — хороший способ определить количество оставшихся яйцеклеток у женщины. Уровни АМГ также используются для определения доз гормонов, вводимых при экстракорпоральном оплодотворении. У большинства женщин уровень АМГ достигает пика в период полового созревания и остается на постоянном уровне до наступления менопаузы. Когда фолликулов яичников больше нет, уровень АМГ снижается.
Низкий уровень АМГ может быть связан с первичной недостаточностью яичников (ПНЯ). Высокий уровень гормона может быть связан с синдромом поликистозных яичников (СПКЯ). Однако одного измерения уровня АМГ недостаточно для точного диагноза ПНЯ или СПКЯ.
Высокий уровень гормона может быть связан с синдромом поликистозных яичников (СПКЯ). Однако одного измерения уровня АМГ недостаточно для точного диагноза ПНЯ или СПКЯ.
Вопросы, которые следует задать вашей команде HealthCare
- Как измеряются уровни АМГ у женщин и младенцев?
- Что означают результаты теста?
- Что мне делать, чтобы подготовиться к тестированию AMH?
Что на самом деле означает ваш уровень AMH
Что ваш уровень AMH может и не может сказать вам
Перво-наперво: давайте проясним все неправильные представления о тесте AMH как о «святом Граале».Это не так — это всего лишь один из множества данных, которые врач будет использовать для оценки вашего репродуктивного здоровья. Ваш уровень AMH не является критерием того, можете ли вы забеременеть прямо сейчас. Прежде всего, ваш уровень AMH говорит вам только о том, сколько яиц у вас осталось, и ничего не говорит о качестве (или генетическом здоровье) этих яиц, что на самом деле гораздо важнее, когда дело доходит до беременности. Не существует теста на качество яиц, но оно предсказуемо снижается с возрастом. Узнать больше о Качество яиц .
Не существует теста на качество яиц, но оно предсказуемо снижается с возрастом. Узнать больше о Качество яиц .
не может сказать нам, есть ли у вас миома, рубцы на матке или другое заболевание, которое может затруднить зачатие. Тест AMH также не может сказать нам, насколько быстро уменьшается количество яиц, поскольку это всего лишь снимок вашего уровня в определенный момент времени.
Узнайте больше о , что действительно может сказать нам анализ резерва яичников .
Но это не значит, что это бесполезно. Особенно низкий АМГ для вашего возраста может указывать на возможность ранней менопаузы, в то время как аномально высокий уровень АМГ может указывать на синдром поликистозных яичников (СПКЯ), гормональный дисбаланс, который может затруднить беременность.А в мире замораживания яиц AMH предлагает нам одну важную информацию: сколько яиц вы можете заморозить за один цикл.
Понимание «среднего» AMH
Многие женщины хотят понять, выше или ниже средний у них уровень АМГ. Что же на самом деле «среднее» в отношении AMH? Поскольку АМГ обычно тестируется только у женщин, которые обращаются к врачу после трудностей с зачатием, прошлые средние значения были основаны на популяции, в которую входят многие женщины с проблемами фертильности.Чтобы по-настоящему понять, в каком диапазоне спектра находится ваш уровень АМГ, вам нужно сравнить его с популяцией женщин, у которых нет известных проблем с фертильностью. Мы провели именно такое исследование через Центр исследований и образования в области фертильности (CFRE).
Что же на самом деле «среднее» в отношении AMH? Поскольку АМГ обычно тестируется только у женщин, которые обращаются к врачу после трудностей с зачатием, прошлые средние значения были основаны на популяции, в которую входят многие женщины с проблемами фертильности.Чтобы по-настоящему понять, в каком диапазоне спектра находится ваш уровень АМГ, вам нужно сравнить его с популяцией женщин, у которых нет известных проблем с фертильностью. Мы провели именно такое исследование через Центр исследований и образования в области фертильности (CFRE).
В нашем исследовании, представленном на ежегодном собрании ACOG в начале этого месяца, мы рассмотрели результаты более 2600 тестов AMH среди женщин, не страдающих бесплодием, которые пришли в Extend Fertility для оценки фертильности. Как и ожидалось, АМГ был отрицательно связан с возрастом — это означает, что по мере увеличения возраста уровень АМГ в целом снижался.
Средний уровень АМГ по возрасту:
Возраст | Медианные уровни AMH |
До 30 лет | 2,91 |
30–34 | 2,42 |
35–37 | 2,03 |
38–40 | 1. |
41–42 | .92 |
Более 42 | .59 |
Что означает ваш уровень АМГ для цикла замораживания яиц
Как мы упоминали выше, тестирование AMH является бесценным инструментом для женщин, рассматривающих возможность замораживания яиц (и их врачей). Уровни АМГ тесно связаны с количеством яиц, которое вы сможете получить за один цикл замораживания яиц или ЭКО.
Здесь, в Extend Fertility, мы используем собственный алгоритм, основанный на вашем уровне AMH и возрасте, чтобы предсказать — с достоверностью 90% — сколько яиц вы сможете заморозить за один цикл. Наше прошлое исследование показало, что, хотя женщины в возрасте 34 лет и младше могут замораживать в среднем 17 яиц за цикл, у женщин старше 41 года этот показатель снижается до 10 яиц за цикл.
Возраст | Среднее количество замороженных яиц за цикл |
34 или моложе | 17. |
35–37 | 15,48 |
38–40 | 12,87 |
41 и старше | 9,67 |
Возраст | Количество замороженных яиц, необходимое для обеспечения 50% вероятности живорождения с этими яйцами позже |
34 или моложе | 7 |
35–37 | 9 |
38–40 | 11 |
41 и старше | 20 |
 Е. Те, у кого более высокий уровень АМГ, скорее всего, достигнут своей цели с вероятностью 50% за один цикл, в то время как людям с более низким уровнем может потребоваться несколько циклов для достижения этой цели.
Е. Те, у кого более высокий уровень АМГ, скорее всего, достигнут своей цели с вероятностью 50% за один цикл, в то время как людям с более низким уровнем может потребоваться несколько циклов для достижения этой цели.Возраст | Количество замороженных яиц, необходимое для обеспечения 50% вероятности живорождения с этими яйцами позже | Уровень AMH, необходимый для достижения 50% вероятности живорождения за один цикл |
34 или моложе | 7 | 1,25 |
35–37 | 9 | 1.5 |
38–40 | 11 | 1,75 |
41 и старше | 20 | 2,25 |
Итак, что все это значит для женщин, которые на самом деле рассматривают возможность замораживания яиц? Это может помочь вам выяснить, сколько циклов вам, возможно, потребуется запланировать, или каковы ваши реальные шансы на беременность в будущем, если вы сделаете только один цикл. Например, если вам 39 лет и у вас уровень АМГ ниже 1,75, вы знаете, что вам, возможно, придется запланировать несколько циклов, чтобы получить 50% шанс забеременеть позже замороженными яйцами.
Например, если вам 39 лет и у вас уровень АМГ ниже 1,75, вы знаете, что вам, возможно, придется запланировать несколько циклов, чтобы получить 50% шанс забеременеть позже замороженными яйцами.
Если вам кажется, что данных слишком много, не волнуйтесь. Оценка фертильности в Extend Fertility сопровождается консультацией врача, чтобы ваш врач мог интерпретировать ваши результаты AMH в контексте и сообщить вам, что это означает для вашего здоровья фертильности и ваших планов замораживания яиц.
Свяжитесь с нами, чтобы узнать больше или позвоните нам по телефону 212-810-2828, чтобы назначить оценку!
Какова роль антимюллерова гормона в женской фертильности и бесплодии?
Антимюллеров гормон ( гормон AMH) — один из естественных гормонов женского тела, который может указывать на потенциал фертильности.В этой статье мы рассмотрим последствия этого как для фертильности, так и для бесплодия, а также то, как тест AMH может дать полезный указатель как для врачей, так и для пациентов, которые могут иметь какие-либо опасения по этим вопросам.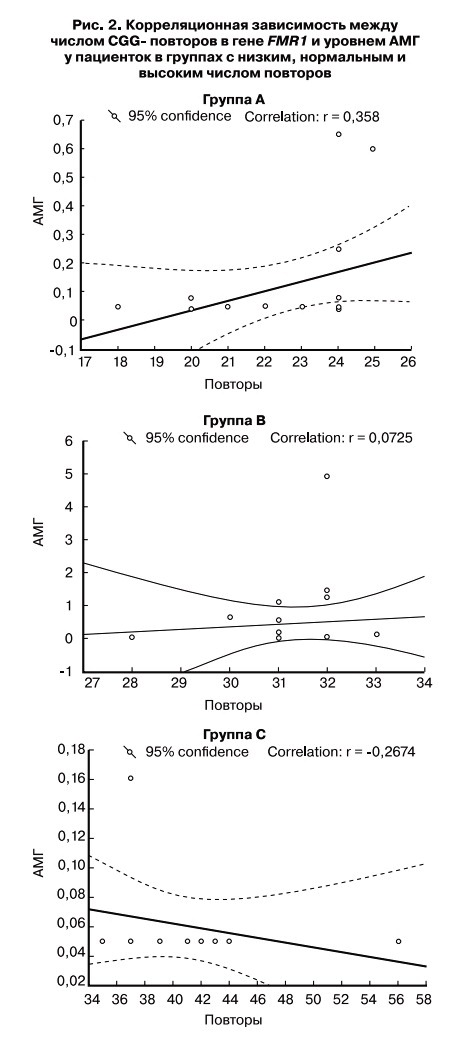 Возможно, вы слышали о историях успеха с высоким уровнем ФСГ и низким уровнем АМГ, и мы раскроем значение этих концепций. Мы также рассказали, что включает в себя анализ крови AMH, и , как долго для результатов теста AMH может быть ваше время ожидания, что низкий AMH может означать для ваших перспектив стать родителем, а также некоторые факты и мифы о как увеличить АМГ естественным путем .
Возможно, вы слышали о историях успеха с высоким уровнем ФСГ и низким уровнем АМГ, и мы раскроем значение этих концепций. Мы также рассказали, что включает в себя анализ крови AMH, и , как долго для результатов теста AMH может быть ваше время ожидания, что низкий AMH может означать для ваших перспектив стать родителем, а также некоторые факты и мифы о как увеличить АМГ естественным путем .
Наконец, мы расскажем вам немного о себе, как мы можем предложить помощь пациентам с низкими уровнями AMH и чего вы можете ожидать, посетив клинику IVI.
Что такое АМГ и какова его роль в женской фертильности? Антимюллеров гормон — это вещество, которое выделяют развивающиеся яйцевые мешочки (фолликулы яичников), и его уровни можно определить с помощью простого анализа крови AMH . Чем выше количество яиц, оставшихся в яичниках, тем выше уровень АМГ, который будет отображаться в кровотоке. Следовательно, низкий уровень считается признаком низкого резерва яичников, то есть небольшого количества оставшихся фолликулов. Это нормально для женщины, приближающейся к менопаузе. Точно так же ожидается, что у женщины с синдромом поликистозных яичников, характеризующимся наличием большого количества мелких фолликулов яичников, будет высокий уровень АМГ.
Следовательно, низкий уровень считается признаком низкого резерва яичников, то есть небольшого количества оставшихся фолликулов. Это нормально для женщины, приближающейся к менопаузе. Точно так же ожидается, что у женщины с синдромом поликистозных яичников, характеризующимся наличием большого количества мелких фолликулов яичников, будет высокий уровень АМГ.
Таким образом, уровни АМГ в плазме отражают непрерывный рост мелких фолликулов и, таким образом, отражают размер оставшегося пула фолликулов, что представляет собой полезный маркер овариального резерва.Антимюллеров гормон особенно полезен в качестве эндокринного маркера для оценки возрастного снижения пула яичников и, следовательно, его способности прогнозировать будущую продолжительность репродуктивной жизни. Это особенно полезно, хотя и не является полным диагностическим решением, поскольку тест AMH можно проводить в любое время месячного цикла, даже если соответствующая женщина принимает оральные контрацептивы.
Часто время ожидания результатов других типов гормональных тестов может включать ожидание подходящей точки в вашем месячном цикле для проведения теста, поэтому с AMH это не проблема.Итак, , сколько времени для результатов теста AMH — это всего лишь вопрос нескольких дней в любое время месяца.
Какова роль низкого АМГ в бесплодии?Если вы или вы и ваш партнер хотите создать семью и у вас есть какие-либо опасения по поводу возможности снижения фертильности из-за вашего возраста или по любой другой причине, было бы полезно пройти тест AMH . Мы отметили, что это хороший показатель оставшегося в организме запаса яичных фолликулов.Однако, если ваш анализ крови AMH показывает, что у вас низкие уровни AMH , это не равносильно диагнозу бесплодия, а только снижению уровня фертильности. Результаты на этом этапе ничего не говорят нам о качестве оставшихся яичных фолликулов. Факторы, отличные от возраста, также могут влиять на овариальный резерв, и в случае более молодых женщин низкий овариальный резерв может не указывать на плохое качество ооцитов.
Какие еще тесты могут помочь определить овариальный резерв?
Тест AMH — лишь один из способов определения овариального резерва.Другие гормоны, влияющие на фертильность или ее отсутствие, включают:
- Фолликулостимулирующий гормон (ФСГ), который действует на фолликулы яичников, регулируя менструальный цикл и стимулируя производство яйцеклеток.
- Лютеинизирующий гормон (ЛГ) контролирует созревание фолликулов. Повышение уровня ЛГ действует как сигнал для яичника к высвобождению яйцеклетки. Тест на ЛГ позволяет оценить овуляцию и определить, достигла ли женщина менопаузы.
- Эстрадиол — самый важный из эстрогенов.Тест на этот гормон (иногда также известный как E2) позволяет оценить функцию яичников. Тест необходимо проводить между 3 и 5 днями менструального цикла.
В дополнение к измерению АМГ, тестирование уровня этих гормонов помогает врачам оценить уровень фертильности женщины и вероятность естественного зачатия. Еще одна очень важная функция тестирования AMH заключается в том, что это важный индикатор потенциальной эффективности лечения вспомогательной бесплодия.Это связано с тем, что он позволяет оценить вероятную реакцию яичников на гормональное лечение.
Что такое низкие уровни АМГ и как они измеряются
Ожидается, что уровень AMH будет падать с возрастом до тех пор, пока он не станет неопределяемым в период менопаузы. В этом контексте очень низкий уровень АМГ обычно считается АМГ ниже 1,05 нг / мл, а необнаружимо низкий уровень АМГ рассчитывается как ниже 0,16 нг / мл. Низкий уровень ФСГ (фолликулостимулирующего гормона) может быть дополнительным индикатором проблемы с количеством яйцеклеток у женщины.
Если вы просматривали любую информацию о фертильности, доступную в Интернете, вы, несомненно, натолкнулись на истории успеха с высоким содержанием ФСГ и низким уровнем АМГ, и, естественно, многие из них обнадеживают и вселяют надежду для всех, кто также надеется на репродуктивный успех. Часто эти отчеты сочетаются с советами о том, как естественным образом увеличить АМГ и укрепить здоровье яичников с помощью диеты, трав, добавок и улучшения кровообращения в репродуктивной системе. Однако эти методы не получили научных доказательств.Хотя нет сомнений в том, что поддержание здорового образа жизни, включая диету и упражнения, полезно для общего состояния здоровья и, следовательно, в целом полезно для оптимальной фертильности, сообщается о , как увеличить АМГ естественным путем, , а также различные истории успеха с высоким содержанием ФСГ и низким уровнем АМГ. К следует подходить со здоровым скептицизмом.
Какую помощь предлагает IVI женщинам с низким уровнем гормона AMH?IVI — это крупнейшая группа специалистов по вспомогательной репродукции в мире, и наш опыт в предоставлении лучших методов вспомогательной репродукции насчитывает более 27 лет.Благодаря нашим услугам на сегодняшний день родилось более 160 000 детей. Посетив одну из наших клиник, вы окажетесь в гостеприимной обстановке, в которой опыт и потребности пациентов лежат в основе всех клинических разработок. Мы стремимся воплотить в жизнь мечты наших пациентов стать родителями, и при этом мы всегда следуем неизменно высоким стандартам, которые применяются во всех наших клиниках IVI по всему миру. Это уровень профессиональной ответственности и опыта, на который вы можете положиться.
В случае низкого уровня гормона АМГ сначала вам могут предложить тест на АМГ и ФСГ, чтобы узнать, насколько хорошо ваши яичники могут реагировать на препараты для лечения бесплодия. Это может помочь вашему клиническому консультанту решить, является ли ЭКО лучшим лечением. Если ваш клинический консультант в IVI считает, что уровень АМГ достаточен для ЭКО, экстракорпоральное оплодотворение вполне может быть рекомендованным лечением. В качестве альтернативы, если уровни АМГ и, следовательно, резерв яичников настолько низки, что этот тип лечения вряд ли будет успешным, ваш врач может посоветовать вам рассмотреть возможность использования донорства яйцеклеток.Донорство яйцеклеток может быть лучшим вариантом для достижения беременности, особенно для женщин с чрезвычайно низким резервом яичников, и если несколько раундов ЭКО не увенчались успехом.
Если лечение, которое наиболее подходит в вашем конкретном случае, — это ЭКО, оно может проводиться либо с помощью хорошо зарекомендовавшего себя обычного ЭКО, которое состоит из помещения яйцеклеток в контакт со спермой в чашке Петри, либо с помощью ИКСИ (интрацитоплазматическая инъекция спермы). Он состоит из микроинъекции спермы непосредственно в зрелую яйцеклетку с помощью пипетки.Вы можете узнать больше об ЭКО и ИКСИ на нашем видеоканале на YouTube. С другой стороны, если оптимальной техникой вспомогательной репродукции в ваших уникальных обстоятельствах является донорство яйцеклеток, вы можете узнать больше и получить ответы на некоторые из ваших вопросов в этой статье о донорстве яйцеклеток на нашем веб-сайте. Вы, конечно, также должны свободно читать о нашем спектре методов лечения и получать самую последнюю информацию о наших методах и клинических результатах на нашем веб-сайте.
Если эта статья или ваше прочтение информации на нашем веб-сайте вызвали какие-либо вопросы, которые вы хотели бы обсудить с одним из наших консультантов, свяжитесь с нами.Когда вы почувствуете, что готовы записаться на первую встречу в IVI, чтобы обсудить, как мы можем помочь вам на вашем пути к тому, чтобы стать родителем, продолжайте. Вы можете позвонить нам по бесплатному телефону 08 000 850 035 из Великобритании или по +34 960 451 185 из других стран. Вы также можете заполнить нашу онлайн-форму для связи, и один из наших консультантов сразу же свяжется с вами.
Запросить дополнительную информацию, без обязательств
антимюллерова гормона и яичникового резерва: обновленная информация об оценке функции яичников | Журнал клинической эндокринологии и метаболизма
Абстрактные
Контекст
Антимюллеров гормон (АМГ) вырабатывается клетками гранулезы небольших растущих фолликулов яичника.Уровни АМГ в сыворотке сильно коррелируют с количеством растущих фолликулов, и поэтому АМГ привлекает все большее внимание как маркер резерва яичников. В этом обзоре обобщены недавние результаты и ограничения в применении сывороточного АМГ для оценки резерва яичников.
Получение доказательств
Был проведен поиск в PubMed с целью найти недавнюю литературу по измерениям и использованию сывороточного АМГ в качестве маркера овариального резерва.
Evidence Synthesis
Уровни АМГ в сыворотке измеряются для оценки «функционального резерва яичников», термина, который предпочтительнее «резерва яичников», поскольку уровни АМГ отражают пул растущих фолликулов, которые потенциально могут овулировать.Уровни АМГ в сыворотке используются в индивидуальных протоколах дозирования фолликулостимулирующего гормона и могут прогнозировать риск плохого ответа или синдрома гиперстимуляции яичников, но имеет ограниченное значение для прогнозирования продолжающейся беременности. Уровни АМГ в сыворотке крови исследуются для прогнозирования естественного возраста менопаузы или возраста, связанного с заболеванием. Исследования показывают, что темпы снижения АМГ в зависимости от возраста у женщин различаются. Обобщенная реализация измерения АМГ в сыворотке также привела к увеличению количества диагностических тестов, включая автоматизированные.Однако прямое сравнение результатов остается проблематичным.
Заключение
Сывороточный АМГ остается предпочтительным маркером резерва яичников. Однако отсутствие международного стандарта для сравнения AMH ограничивает между анализами AMH. Более того, мало что известно об эндогенных и экзогенных факторах, влияющих на уровни АМГ в сыворотке, что ограничивает правильную интерпретацию значений АМГ в клинических условиях.
Введение
Антимюллеров гормон (АМГ) является членом семейства трансформирующих факторов роста бета, получившего свое название от его роли в дифференциации мужского пола, вызывая регрессию мюллерова протоков.На сегодняшний день АМГ наиболее известен как сывороточный маркер функции яичников с оценкой уровней АМГ на обоих концах спектра, то есть резерва яичников и синдрома поликистозных яичников. В яичнике АМГ экспрессируется клетками гранулезы растущих фолликулов от первичной до малой антральной стадии. После фолликулостимулирующего гормона (ФСГ) -зависимого отбора экспрессия АМГ исчезает, хотя некоторая экспрессия остается в кумулюсных клетках преовуляторных фолликулов. Кроме того, в атретических фолликулах и желтых телах экспрессия АМГ теряется.Это окно выражения в значительной степени сохраняется среди видов и в яичниках взрослого человека. Повышенные уровни экспрессии AMH обнаруживаются в фолликулах размером до 8 мм, а экспрессия отсутствует в фолликулах размером более 8 мм. Этот паттерн экспрессии положительно согласуется с концентрациями АМГ в фолликулярной жидкости, показывая самые высокие уровни в фолликулах размером до 8 мм и затем резкое падение (рис. 1А) (1).
Рисунок 1.
Экспрессия и концентрация антимюллерова гормона в зависимости от фолликулогенеза и овариального резерва.( A ) Экспрессия антимюллерова гормона (АМГ) возрастает от вторичной стадии и далее до стадии малого антрального фолликула. В преовуляторных фолликулах АМГ экспрессируется только в гранулезных клетках кумулюса, окружающих ооцит (темно-розовый слой). ( B ) С возрастом функциональный резерв яичников снижается в результате истощения пула примордиальных фолликулов. Это приводит к уменьшению количества мелких антральных фолликулов и, как следствие, к снижению уровня АМГ в сыворотке, достигая неопределяемого уровня в период менопаузы. Рисунок, созданный с помощью Biorender.
Рисунок 1.
Экспрессия и концентрация антимюллерова гормона в зависимости от фолликулогенеза и овариального резерва. ( A ) Экспрессия антимюллерова гормона (АМГ) возрастает от вторичной стадии и далее до стадии малого антрального фолликула. В преовуляторных фолликулах АМГ экспрессируется только в гранулезных клетках кумулюса, окружающих ооцит (темно-розовый слой). ( B ) С возрастом функциональный резерв яичников снижается в результате истощения пула примордиальных фолликулов.Это приводит к уменьшению количества мелких антральных фолликулов и, как следствие, к снижению уровня АМГ в сыворотке, достигая неопределяемого уровня в период менопаузы. Рисунок, созданный с помощью Biorender.
Поскольку АМГ экспрессируется растущими фолликулами до ФСГ-зависимого отбора и, как было показано, обнаруживается в кровотоке, сывороточный АМГ приобрел импульс в качестве маркера функции яичников, в частности, при оценке количественного аспекта яичников. резерв, которому и посвящен данный обзор.По определению, яичниковый резерв состоит из качества и количества примордиальных фолликулов, которые с возрастом уменьшаются (2). Количество растущих фолликулов, привлеченных из пула примордиальных фолликулов, отражает количество примордиальных фолликулов. Поскольку не существует маркера сыворотки, который напрямую может измерить количество примордиальных фолликулов, маркер, отражающий количество растущих фолликулов, в настоящее время является лучшим показателем количественного аспекта резерва яичников. Первоначальные исследования, проведенные почти два десятилетия назад, показали, что уровни АМГ в сыворотке действительно сильно коррелируют с количеством растущих фолликулов и оба снижаются с возрастом (3).На основании этих первоначальных исследований сывороточный AMH был быстро выдвинут в качестве косвенного маркера яичникового резерва, несмотря на ограниченные знания о факторах, регулирующих экспрессию AMH в яичниках, и отсутствие стандартизированных анализов AMH.
Поскольку сывороточный АМГ является лишь косвенным маркером, это привело к путанице или даже неправильному толкованию термина овариальный резерв. Чтобы провести четкое различие между пулом покоящихся примордиальных фолликулов и пулом растущих фолликулов, был предложен термин функциональный резерв яичников (FOR) (4).FOR представляет собой пул фолликулов диаметром от 2 до 5 мм, из которых 1 фолликул должен быть выделен ФСГ и овулировать (4, 5). Этот пул растущих фолликулов известен как фолликулы, продуцирующие АМГ, и, таким образом, уровни АМГ в сыворотке напрямую отражают ФОР (рис. 1В). Поэтому при клиническом применении сывороточного АМГ для оценки овариального резерва точнее использовать термин «ЗА». Важность различения овариального резерва и FOR при интерпретации уровней АМГ иллюстрируется исследованиями на мышах и немногочисленными исследованиями на людях, в которых определялось количество примордиальных фолликулов.У мышей уровни АМГ оставались постоянными в более молодом возрасте, несмотря на уменьшение количества примордиальных фолликулов. Только в более старшем возрасте уровни АМГ отражали количество примордиальных фолликулов, тогда как во всех возрастных группах уровни АМГ в сыворотке коррелировали с количеством растущих фолликулов (6). Аналогичные результаты наблюдались в исследованиях на людях, в которых плотность первичных и первичных фолликулов определялась непосредственно в яичниках, удаленных по доброкачественным гинекологическим показаниям или перед гонадотоксической терапией. У более молодых женщин уровни АМГ не коррелировали, в то время как у женщин позднего репродуктивного возраста значимая корреляция наблюдалась с плотностью примордиальных фолликулов (7-10).Эти исследования показывают, что в любом возрасте уровни АМГ в сыворотке отражают ФОР, и только в более старшем репродуктивном возрасте уровни АМГ могут также отражать резерв яичников. Поэтому в этом обзоре мы будем использовать термин FOR, чтобы обсудить недавние открытия и ограничения в использовании сывороточного АМГ для прогнозирования возраста менопаузы у здоровых женщин и в болезненных состояниях.
Уровни АМГ в сыворотке среди населения в целом
Уровни АМГ в сыворотке у взрослых женщин отрицательно коррелируют с возрастом.Однако исследования, направленные на получение нормативных данных для AMH, также показали, что эта корреляция зависит от анализируемой возрастной категории. С момента рождения уровень АМГ повышался до плато примерно в возрасте 25 лет (11, 12). До возраста примерно 16 лет уровни АМГ явно положительно коррелировали с возрастом. Эта положительная корреляция может отражать повышенную скорость рекрутирования примордиальных фолликулов, наблюдаемую от рождения примерно до 14 лет (13). Начиная с 25 лет, уровни АМГ начинают снижаться до неопределяемых уровней в период менопаузы, и только с этого возраста можно наблюдать отрицательную корреляцию между уровнями АМГ и возрастом (11, 12).Эта закономерность в зависимости от возраста, похоже, одинакова для разных этнических групп (14–16). Однако исследования показывают, что в любом возрасте уровни АМГ в сыворотке значительно варьируются (14, 17, 18). Таким образом, аналогично тому, что наблюдалось при подсчете антральных фолликулов (AFC), существуют большие индивидуальные различия в уровнях AMH (19, 20). Этническая принадлежность может способствовать этому изменению и должна приниматься во внимание при интерпретации ценностей AMH. Хотя пиковые уровни АМГ в возрасте 25 лет были выше у китайских женщин по сравнению с европейскими женщинами, возрастное снижение у китайских женщин было более значительным, что привело к снижению уровней АМГ на 28% и 80% в возрасте 30 и 45 лет соответственно (21).Кроме того, у афроамериканских женщин уровень АМГ в сыворотке был ниже, чем у белых женщин, но с более медленным снижением в зависимости от возраста (22, 23).
Уровни АМГ в сыворотке обычно измеряются во время ранней фолликулярной фазы, аналогично другим гормональным маркерам функции яичников, таким как ФСГ, эстрадиол и ингибин В. Однако возник вопрос, можно ли объяснить вариации уровней АМГ в сыворотке различия во время менструального цикла. В то время как первоначальные исследования показали, что уровни АМГ относительно стабильны во время менструального цикла (24), более поздние исследования показывают, что уровни АМГ демонстрируют значительные внутрицикловые колебания до 20.7% (25-27). Хотя небольшое количество людей, проанализированных в этих исследованиях, является ограничением, четкой картины менструального цикла, очевидной для ФСГ или эстрадиола, не было. Скорее, изменение уровней АМГ отражает изменение АФК во время менструального цикла, согласно исследованию Overbeek и соавторов, у женщин, регулярно курсирующих на велосипеде (28). В этом исследовании также было показано, что у женщин с более высоким базальным уровнем АМГ, в основном более молодых женщин, были относительно более высокие уровни АМГ в течение менструального цикла (28).Кроме того, исследования показали, что межцикловые вариации AMH могут составлять от 28% до 163%, в зависимости от используемого анализа AMH (27, 29). Это внутриличностное изменение предполагает, что одно измерение AMH может привести к неточной оценке FOR, что может иметь клинические последствия, когда значение AMH используется в индивидуальном протоколе стимуляции яичников.
Измерение сыворотки AMH
AMH продуцируется как гомодимер с дисульфидной связью (proAMH) массой 140 кДа, состоящий из ковалентно связанных мономеров, каждая из которых состоит из 560 аминокислот (аа) (30).Пропротеин AMH требует расщепления в его одноосновном сайте расщепления на aa451 для образования димера N-концевой прорегиона 110 кДа (AMH N ) и димера зрелой области 25 кДа (AMH C ), которые вместе образуют стабильный нековалентно связанный комплекс (AMH N, C ) (31-33). Исследования in vitro с использованием семенников и клеточных линий эмбрионов крысы предполагают, что протеолитическое расщепление АМГ происходит после секреции и необходимо для того, чтобы он стал биологически активным (32). Дополнительный сайт расщепления на aa229, влияние которого на функцию AMH еще предстоит определить, генерирует потенциально 3 дополнительных изоформы AMH, а именно более короткий N-концевой пептид (AMH N, 229 ), среднюю область (AMH M ) и область средней зрелости (AMH M, C ) (рис.2А).
Рисунок 2.
Возможные изоформы антимюллерова гормона (АМГ) и характеристики анализа на АМГ. ( A ) Иллюстрация возможных изоформ AMH, присутствующих в кровотоке. Черные пунктирные линии представляют сайты расщепления по аминокислотам 229 и 451 соответственно. N-концевой прорегион показан зеленым цветом, а С-концевой зрелый регион показан красным. ( B ) Отображает характеристики различных анализов AMH. Захватывающее антитело показано фиолетовым цветом, а детекторное антитело показано оранжевым.Тип анализа, предел обнаружения и диапазон измерений различных анализов AMH показаны в таблице ниже. Фигурка создана с помощью Biorender .
Рисунок 2.
Потенциальные изоформы антимюллерова гормона (АМГ) и характеристики анализа на АМГ. ( A ) Иллюстрация возможных изоформ AMH, присутствующих в кровотоке. Черные пунктирные линии представляют сайты расщепления по аминокислотам 229 и 451 соответственно. N-концевой прорегион показан зеленым цветом, а С-концевой зрелый регион показан красным.( B ) Отображает характеристики различных анализов AMH. Захватывающее антитело показано фиолетовым цветом, а детекторное антитело показано оранжевым. Тип анализа, предел обнаружения и диапазон измерений различных анализов AMH показаны в таблице ниже. Фигурка создана с помощью Biorender .
Клиническая важность измерения AMH привела к разработке нескольких тестов AMH. Часто используемые в настоящее время ручные анализы включают модифицированный анализ Gen II (Beckman Coulter) и сверхчувствительный иммуноферментный анализ AMH (ELISA) и анализ picoAMH (оба Ansh Labs), в которых используются антитела, отличные от анализа AMH Gen II (рис. .2Б). ELISA picoAMH имеет улучшенную чувствительность в нижнем диапазоне, что приводит к пределу обнаружения 1,3 пг / мл по сравнению с 0,08 нг / мл для анализа Gen II (рис. 2B). Эта разница в чувствительности может иметь клиническое значение при оценке сывороточного уровня АМГ, особенно в случаях, когда подозревается низкий овариальный резерв. Кроме того, в настоящее время доступны два автоматизированных анализа AMH: Access AMH (Beckman Coulter) и Elecsys AMH (Roche). В этих автоматизированных анализах используется та же пара антител, что и в анализе Gen II (рис.2Б). Тем не менее, прямое сравнение значений AMH, полученных с помощью этих анализов, все еще проблематично. Различия в значениях можно объяснить использованием разных пар антител (для ручных анализов), что может привести к обнаружению различных изоформ АМГ. Также могут иметь значение нестабильность образца или матричный эффект, который влияет на межлабораторную воспроизводимость. Разработка автоматизированных анализов повысила точность, воспроизводимость и скорость измерений и, следовательно, превосходит ручные анализы.
В нескольких исследованиях сравнивали ручные и автоматические анализы и представляли уравнения регрессии, позволяющие сравнить уровни АМГ в сыворотке, измеренные с помощью различных анализов (34–38). Однако, как показано в таблице 1, в зависимости от исследования и уровня AMH степень и направление конверсии значительно меняются. Например, уровень АМГ в 1 нг / мл показал отклонение от –12,8% до –25,2% при сравнении автоматического анализа Elecsys с ИФА Gen II в различных исследованиях.Однако уровень АМГ 5 нг / мл дает разброс от –24% до + 45% (34–36). Аналогичные результаты были получены при сравнении ИФА Gen II с автоматическим анализом Access (36-38). Корреляция варьировала от –9% до + 34% и от –19,4% до + 7% для 1 нг / мл и 5 нг / мл АМГ, соответственно. Хотя влияние этой вариации на абсолютные значения AMH может показаться не таким большим, эти изменения повлияют на пороговые значения AMH и последующее принятие клинических решений при лечении бесплодия.
Таблица 1.Сравнение уравнений регрессии между анализами антимюллерова гормона
| Бумага . | Уравнение регрессии . | Gen II нг / мл . | Elecsys нг / мл (%) . | Access нг / мл (%) . |
|---|---|---|---|---|
| Gassner et al, 2014 | Elecsys = 0,81 * Gen II — 0,046 | 1 | 0.76 (–24%) | |
| 5 | 4,00 (–20%) | |||
| Hyldgaard et al, 2015 | Elecsys = 0,68 * Gen II + 0,769 | 1 | 1,45 (+ 45%) | |
| 5 | 4,17 (–16,6%) | |||
| Nelson et al, 2015 | Elecsys = 0,73 * Gen II + 0,087 | 1 | 0.82 (–18%) | |
| 5 | 3,74 (–25,2%) | |||
| Van Helden et al, 2015 | Elecsys = 0,88 * Gen II — 0,039 | 1 | 0,84 (–16%) | |
| 5 | 4,36 (–12,8%) | |||
| Nelson et al, 2015 | Доступ = 0,78 * Поколение II + 0,128 | 1 | 0.91 (–9%) | |
| 5 | 4,03 (–19,4%) | |||
| Van Helden et al, 2015 | Доступ = 0,91 * Поколение II — 0,033 | 1 | 0,88 (–12%) | |
| 5 | 4,52 (–9,6%) | |||
| Pearson et al, 2016 | Доступ = 1,00 * Gen II + 0,341 | 1 | 1.34 (+ 34%) | |
| 5 | 5,35 (+ 7%) |
| Бумага . | Уравнение регрессии . | Gen II нг / мл . | Elecsys нг / мл (%) . | Access нг / мл (%) . |
|---|---|---|---|---|
| Gassner et al, 2014 | Elecsys = 0.81 * Поколение II — 0,046 | 1 | 0,76 (–24%) | |
| 5 | 4,00 (–20%) | |||
| Hyldgaard et al, 2015 | Elecsys = 0,68 * Gen II + 0,769 | 1 | 1,45 (+ 45%) | |
| 5 | 4,17 (–16,6%) | |||
| Нельсон и др., 2015 | Elecsys = 0.73 * Поколение II + 0,087 | 1 | 0,82 (–18%) | |
| 5 | 3,74 (–25,2%) | |||
| Van Helden et al, 2015 | Elecsys = 0,88 * Gen II — 0,039 | 1 | 0,84 (–16%) | |
| 5 | 4,36 (–12,8%) | |||
| Nelson et al. , 2015 | Доступ = 0.78 * Поколение II + 0,128 | 1 | 0,91 (–9%) | |
| 5 | 4,03 (–19,4%) | |||
| Van Helden et al, 2015 | Доступ = 0,91 * Поколение II — 0,033 | 1 | 0,88 (–12%) | |
| 5 | 4,52 (–9,6%) | |||
| Pearson et al. , 2016 | Доступ = 1.00 * Gen II + 0,341 | 1 | 1,34 (+ 34%) | |
| 5 | 5,35 (+ 7%) |
Сравнение уравнений регрессии между анализами на антимюллеровы гормоны
| Бумага . | Уравнение регрессии . | Gen II нг / мл . | Elecsys нг / мл (%) . | Access нг / мл (%) . |
|---|---|---|---|---|
| Gassner et al, 2014 | Elecsys = 0,81 * Gen II — 0,046 | 1 | 0,76 (–24%) | |
| 5 | 4,00 (- 20%) | |||
| Hyldgaard et al, 2015 | Elecsys = 0,68 * Поколение II + 0,769 | 1 | 1,45 (+ 45%) | |
| 5 | 4.17 (–16,6%) | |||
| Nelson et al, 2015 | Elecsys = 0,73 * Gen II + 0,087 | 1 | 0,82 (–18%) | |
| 5 | 3,74 (–25,2%) | |||
| Van Helden et al, 2015 | Elecsys = 0,88 * Gen II — 0,039 | 1 | 0,84 (–16%) | |
| 5 | 4.36 (–12,8%) | |||
| Nelson et al, 2015 | Доступ = 0,78 * Поколение II + 0,128 | 1 | 0,91 (–9%) | |
| 5 | 4,03 (–19,4%) | |||
| Van Helden et al, 2015 | Доступ = 0,91 * Gen II — 0,033 | 1 | 0,88 (–12%) | |
| 5 | 4.52 (–9,6%) | |||
| Pearson et al, 2016 | Доступ = 1,00 * Поколение II + 0,341 | 1 | 1,34 (+ 34%) | |
| 5 | 5,35 (+ 7%) |
| Бумага . | Уравнение регрессии . | Gen II нг / мл . | Elecsys нг / мл (%) . | Access нг / мл (%) . |
|---|---|---|---|---|
| Gassner et al, 2014 | Elecsys = 0,81 * Gen II — 0,046 | 1 | 0,76 (–24%) | |
| 5 | 4,00 (- 20%) | |||
| Hyldgaard et al, 2015 | Elecsys = 0,68 * Поколение II + 0,769 | 1 | 1,45 (+ 45%) | |
| 5 | 4.17 (–16,6%) | |||
| Nelson et al, 2015 | Elecsys = 0,73 * Gen II + 0,087 | 1 | 0,82 (–18%) | |
| 5 | 3,74 (–25,2%) | |||
| Van Helden et al, 2015 | Elecsys = 0,88 * Gen II — 0,039 | 1 | 0,84 (–16%) | |
| 5 | 4.36 (–12,8%) | |||
| Nelson et al, 2015 | Доступ = 0,78 * Поколение II + 0,128 | 1 | 0,91 (–9%) | |
| 5 | 4,03 (–19,4%) | |||
| Van Helden et al, 2015 | Доступ = 0,91 * Gen II — 0,033 | 1 | 0,88 (–12%) | |
| 5 | 4.52 (–9,6%) | |||
| Pearson et al, 2016 | Доступ = 1,00 * Поколение II + 0,341 | 1 | 1,34 (+ 34%) | |
| 5 | 5,35 (+ 7%) |
Эти различия между анализами в зависимости от уровней АМГ остаются загадочными и приводят к противоречивым результатам в клинических исследованиях по оценке АМГ. Отсутствие международного стандарта AMH даже через 20 лет после разработки первого анализа AMH ELISA — одна из основных проблем, препятствующих сравнению результатов анализа AMH.Отсутствие единообразно откалиброванных анализов ограничивает разработку стандартизированных пороговых значений АМГ, необходимых для повышения безопасности пациентов и предотвращения неправильной интерпретации клиницистами, не осведомленными об этой вариабельности между анализами.
Различия можно частично объяснить большим разбросом характеристик населения. Некоторые исследования включали женщин, проходящих курс лечения экстракорпоральным оплодотворением (ЭКО), в то время как другие включали женщин, подвергшихся лапароскопической стерилизации или образцы с неясным клиническим статусом, связанным с фертильностью.Кроме того, размер выборки был относительно небольшим (от 23 женщин до 142 женщин), а возрастной диапазон был весьма различным (23-56 лет). Следовательно, необходимы дополнительные исследования, чтобы обеспечить надлежащее сравнение различных анализов с использованием более крупных, четко определенных когорт, стратифицированных по возрасту.
Кроме того, при разработке международного стандарта AMH важно раскрыть существование и клиническую значимость различных изоформ AMH. Современные анализы обнаруживают проAMH и AMH N, C .Однако мало что известно о наличии и концентрации других изоформ AMH в кровотоке. Хотя фрагмент AMH C является биологически активной формой AMH, Pankhurst et al предполагают, что он не обнаруживается в кровотоке (39). Это может указывать на то, что AMH C образуется только после связывания рецептором изоформы AMH N, C , как показано in vitro (40). В недавнем исследовании Wissing et al (41) было показано, что количество нерасщепленного АМГ (проАМГ) у нормовулирующих женщин составляет всего 3% от общего количества промозирующих изоформ (проАМГ и АМГ N, C ).Этот результат был получен с помощью ELISA Ansh Labs, в которых либо используется другая пара антител, либо обработка образца для различения различных изоформ (41). Это говорит о том, что большая часть сывороточных уровней АМГ представляет собой расщепленный АМГ. Однако результаты следует интерпретировать с осторожностью, поскольку матричные эффекты могут изменить конформацию изоформы, ограничивая прямое сравнение значений.
В настоящее время неизвестно, отличается ли обработка AMH с возрастом, клиническим состоянием или даже среди женщин.Таким образом, еще предстоит определить, улучшило ли измерение различных изоформ AMH или их соотношения клиническую значимость по сравнению с общим AMH, как оценивается с помощью текущих анализов.
Факторы, влияющие на сывороточный АМГ
Для правильной интерпретации уровней АМГ в сыворотке критически важно знать факторы, влияющие на уровни АМГ. Большинство женщин репродуктивного возраста используют гормональные противозачаточные средства (ГК), однако данные о влиянии ГК на уровень АМГ в сыворотке противоречивы.Систематический обзор, проведенный Amer et al (42), повторно оценивший 15 исследований, пришел к выводу, что уровни АМГ в сыворотке у нормоовуляторных женщин снижались при использовании ГК в течение не менее года, и в большинстве исследований этот эффект был обратимым после прекращения использования ГК. . Однако степень снижения варьировала от 14% до 55%, что можно объяснить различиями в типе использования HC, продолжительности использования, времени измерения AMH во время менструального цикла и используемых анализах AMH. Действительно, Landersoe et al (43) показали в ретроспективном исследовании, что уровни АМГ в сыворотке были на 30-40% ниже у женщин, принимающих оральные контрацептивы или таблетки, содержащие только прогестерон, в то время как у женщин, использующих внутриматочную спираль, снижение только на 17%. % наблюдалось.Кроме того, в обоих исследованиях сообщалось о снижении AFC (42, 43), что убедительно свидетельствует о том, что изменение уровней AMH в сыворотке, вызванное использованием HC, является результатом изменения динамики фолликулов, а не прямого воздействия на регуляцию гена AMH. Однако нельзя исключать прямое влияние измененной среды гонадотропинов и половых стероидов на экспрессию АМГ.
Несколько исследований показали, что индекс массы тела (ИМТ) отрицательно влияет на уровень АМГ. В исследовании Moslehi et al (44), в котором повторно анализировалось 26 исследований, пациенты были разделены на фертильную группу без синдрома поликистозных яичников (СПКЯ), группу бесплодия без СПКЯ и группу СПКЯ.Авторы обнаружили отрицательную корреляцию между ИМТ и АМГ во всех группах со статистикой Z Фишера -0,15 (95% доверительный интервал [ДИ] от -0,20 до -0,11) в общей популяции. Однако ИМТ не коррелировал с AFC, что позволяет предположить, что ИМТ может напрямую влиять на уровни AMH, а не FOR. Хотя точный механизм еще предстоит выяснить, предполагается, что лептин играет определенную роль. Merhi и др. (45) продемонстрировали на культивируемых клетках гранулезы человека, выделенных как из маленьких фолликулов (SF; <14 мм), так и из крупных фолликулов (LF; ≥14 мм), что обработка рекомбинантным лептином значительно подавляла рибонуклеиновые мессенджеры AMH и рецептора AMH II. кислотные (мРНК) уровни.Обработка ингибитором JAK2 / STAT3 предотвращала индуцированное лептином подавление экспрессии мРНК AMH, что свидетельствует о прямом участии сигнального пути лептина. Напротив, более недавнее исследование продемонстрировало, что ингибирование передачи сигналов лептина посредством трансфекции культивируемых клеток гранулезы человека малой интерферирующей РНК лептина (сиЛептин) значительно снижает секрецию АМГ (46). Вполне вероятно, что лептин по-разному влияет на экспрессию и секрецию АМГ. Тем не менее точный механизм еще предстоит выяснить.
Было обнаружено, что витамин D (VitD) влияет на уровень АМГ. Уровни VitD демонстрируют сезонные колебания с более высокими уровнями летом по сравнению с зимой. Деннис и др. (47) продемонстрировали, что уровни АМГ у женщин репродуктивного возраста также демонстрируют сезонные колебания, причем уровни зимой на 18% ниже, чем летом. В последующем исследовании здоровые нормоовуляторные женщины были рандомизированы для получения однократной пероральной дозы 1,25-дигидроксивитамина D (VD3), активного метаболита VitD или плацебо (48).В течение 24 часов после лечения VD3 уровни АМГ в сыворотке резко выросли до 15,8 ± 1,1 нмоль / л по сравнению с 1,2 ± 0,7 нмоль / л у контрольных участников. Однако остается вопрос, увеличивает ли VD3 концентрацию АМГ в сыворотке напрямую через регуляцию экспрессии АМГ или косвенно через изменение количества клеток гранулезы. Чтобы ответить на этот вопрос, Xu et al (49) исследовали влияние лечения VD3 на развитие фолликулов и концентрацию AMH у макак путем культивирования растущих фолликулов в присутствии VD3.Анализ показал, что VD3 увеличивал выживаемость преантральных фолликулов, а уровни AMH были значительно выше по сравнению с контролем (49). В течение первых 2 недель культивирования лечение VD3 не влияло на развитие фолликулов или гормональную среду. Однако в течение 3–5 недель воздействие VD3 увеличивало выживаемость антрального фолликула и концентрацию АМГ, в то время как уровни мРНК АМГ и рецептора АМГ II оставались неизменными (50). Эти находки предполагают, что VD3 предотвращает апоптоз гранулезных клеток, а не напрямую регулирует экспрессию AMH, как также предположили Merhi et al (51).В их исследовании лечение VitD не влияло на экспрессию мРНК AMH, а скорее подавляло индуцированную AMH передачу сигналов. Это может привести к ускоренному созреванию фолликулов, что может объяснить наблюдаемую отрицательную корреляцию между уровнями VitD в фолликулярной жидкости и экспрессией мРНК AMH (51). Однако нельзя исключить прямое влияние на экспрессию AMH, поскольку ответный элемент VDR был картирован с промотором AMH (52).
Эти исследования показывают, что при консультировании женщин по поводу их FOR на основе уровней AMH важно понимание факторов, которые влияют на экспрессию AMH, а также динамику фолликулов.Остается определить, приводят ли изменения в экспрессии AMH также к изменениям количества примордиальных фолликулов, то есть резерва яичников, и имеют ли такие изменения в том же направлении. Это подчеркивает необходимость использования FOR сверх овариального резерва по отношению к оценке AMH.
Использование уровней АМГ в сыворотке для прогнозирования возраста менопаузы
В западном мире возраст, в котором женщина решает родить первого ребенка, увеличился, а значит, и риск возрастного непроизвольного бесплодия (53).Учитывая сильную корреляцию между возрастным снижением количества примордиальных фолликулов, количеством растущих фолликулов и уровнями АМГ в сыворотке, в нескольких исследованиях было изучено, может ли АМГ в сыворотке помочь в прогнозировании возраста менопаузы. Метаанализ, проведенный Depmann et al (54), в котором повторно анализировались уровни AMH из 6 исследований, пришел к выводу, что сывороточный AMH может предсказать время наступления менопаузы. Однако по сравнению с возрастом женщины добавленная ценность сывороточного АМГ была ограничена, так как статистика C увеличилась только с 84% до 86%.Более того, сывороточный АМГ, по-видимому, имел ограниченную точность на индивидуальном уровне. Сообщалось о противоречивых результатах в прогнозировании наступления менопаузы у женщин позднего репродуктивного возраста. В недавнем популяционном исследовании, в котором большинство женщин имели избыточный вес или страдали ожирением, было показано, что женщины в возрасте от 45 до 49 лет с неопределяемым уровнем АМГ имели 60% вероятность наступления менопаузы в течение 5 лет (55). Кроме того, AMH действительно улучшил прогноз наступления менопаузы по сравнению с одним только возрастом (C-статистика 91% против 83%) (55).Недавнее мультиэтническое исследование, в которое вошли 1537 женщин в пре- или ранней перименопаузе на исходном уровне и с последующим наблюдением до 12 месяцев аменореи (исследование SWAN), проанализировало прогноз заключительного менструального цикла (FMP) по уровням AMH. Хотя АМГ оценивался серийно в небольшой подгруппе этой когорты, несколько выборок отдельных женщин были независимо использованы в статистических моделях для прогнозирования FMP. В сочетании с возрастом и ИМТ АМГ имел лучшую прогностическую ценность для FMP, чем ФСГ. У женщин моложе 48 лет значение АМГ <10 пг / мл имело 51% положительную прогностическую ценность для прогнозирования достижения FMP в течение 12 месяцев, которая увеличивалась до 78% при достижении FMP в течение 36 месяцев.У женщин в возрасте ≥51 года эти значения составили 79% и 97% соответственно. Важно отметить, что продление прогноза FMP с 12 месяцев до 36 месяцев значительно снизило чувствительность AMH. Напротив, у женщин в возрасте <45 лет АМГ <10 пг / мл имел низкую чувствительность и низкую положительную прогностическую ценность при прогнозировании FMP (56). Таким образом, объединение этих двух последних исследований показывает, что у женщин позднего репродуктивного возраста оценка АМГ может помочь в прогнозировании возраста менопаузы. Однако можно утверждать, что предсказание возраста менопаузы в более молодом возрасте клинически более актуально для отдельной женщины, как и предсказание ранней менопаузы, то есть менопаузы в возрасте до 45 лет.
В рассмотренном выше метаанализе Depmann et al (54) по сравнению с одним только возрастом AMH увеличил статистику C с 52% до 80% в прогнозировании ранней менопаузы. В недавнем проспективном исследовании с вложенным дизайном случай-контроль, содержащим 327 случаев, было подтверждено использование сывороточного АМГ для прогнозирования ранней менопаузы. Снижение АМГ на 0,10 нг / мл увеличивало риск ранней менопаузы на 14% (95% ДИ, 1,10–1,18). По сравнению с уровнем АМГ 2,0 нг / мл отношение шансов (ОШ) для ранней менопаузы составляло 23 для женщин с уровнем АМГ 0.5 нг / мл (57).
Большинство моделей прогнозирования основаны на одном измерении АМГ и предполагают сопоставимую картину снижения у каждой женщины. Недавние исследования, анализирующие продольные измерения AMH, показывают, что AMH может не следовать равномерной траектории снижения. Анализ популяционного когортного исследования Doetinchem с данными, доступными из 5 посещений в течение 20-летнего периода наблюдения, показал возрастное снижение уровня АМГ, которое значительно варьировалось для отдельных женщин. Кроме того, было показано, что скорость снижения изменялась с возрастом, ускоряясь после 40 лет (58).Следовательно, было высказано предположение, что использование индивидуальных моделей снижения АМГ может улучшить прогноз возраста менопаузы. Однако повторный анализ данных 2432 женщин из когортного исследования Doetichem показал, что скорость снижения AMH сама по себе или в сочетании с возрастным AMH не имеет дополнительной ценности (59). Напротив, иранское исследование, в котором анализировались продольные данные 959 женщин за период наблюдения в течение 14 лет, из которых 55% достигли менопаузы, действительно показало, что серийные измерения АМГ улучшили прогноз возраста менопаузы, поскольку добавление скорости снижения АМГ к модель увеличила статистику C до 78% по сравнению с 70% для одного только AMH (60).В меньшей подгруппе этой когорты (n = 266) с более коротким периодом наблюдения (в среднем 6,5 лет с 3-летними интервалами) авторы ранее подтвердили, что скорость снижения AMH была специфической для каждой женщины (61). Важно отметить, что авторы также показали, что скорость снижения зависит от возраста, что поднимает вопрос о том, в каком возрастном интервале и как часто следует измерять АМГ, чтобы точно предсказать возраст менопаузы.
Хотя исследование Ramezani Tehrani et al (60) специально не анализировало прогнозирование ранней менопаузы, авторы показали, что прогнозирующая добавленная ценность скорости снижения АМГ была последовательной при анализе женщин моложе или старше 40 лет.Основываясь на их модели, женщины со значением АМГ 0,1 нг / мл в возрасте 30 лет имеют прогнозируемый средний возраст менопаузы 43,18 (37,56-46,33) лет с пятым процентилем снижения АМГ и 95 процентилем. , это прогнозируется на уровне 33,63 (29,25-36,08) года (60). Как и в случае с возрастом менопаузы, в статистических моделях de Kat et al (59) скорость снижения АМГ не улучшала прогноз ранней менопаузы. Фактически, у женщин моложе 30 лет уровни АМГ могут фактически недооценивать риск ранней менопаузы (59).Хотя этот результат, кажется, противоречит исследованиям, обсуждавшимся выше, при подтверждении он может иметь клинические последствия, поскольку, в частности, женщины этой возрастной категории могут решать, откладывать ли деторождение.
Исходя из текущих исследований, прогностическая ценность сывороточного АМГА возраста менопаузы остается спорной. В большинстве этих исследований анализировались различные возрастные диапазоны, продолжительность наблюдения и анализы AMH, что затрудняло прямое сравнение исследований. Также остается неясным, могут ли текущие результаты, полученные у женщин, регулярно курсирующих на велосипеде, быть перенесены на бесплодных женщин, у которых может быть нарушен яичниковый резерв.Потенциальное влияние этнической принадлежности на темпы снижения АМГ также подробно не анализировалось. Таким образом, требуются валидационные исследования, включающие дополнительные переменные, для определения конкретных пороговых значений АМГ при прогнозировании возраста наступления менопаузы.
Использование уровней АМГ для прогнозирования ответа на контролируемую стимуляцию яичников
Предыдущие исследования также показали, что уровни AMH могут помочь в прогнозировании ответа яичников на протоколы контролируемой гиперстимуляции яичников (COH).Низкие уровни АМГ коррелируют с низким ответом, определяемым как извлечение менее 5 ооцитов или отмена цикла. В настоящее время широко используются 2 различных подхода к стимуляции яичников: агонист гонадотропин-рилизинг-гормона или антагонист гонадотропин-рилизинг-гормона в сочетании с рекомбинантным или мочевым ФСГ (62). Чтобы улучшить реакцию на COH, используются алгоритмы для расчета индивидуальной дозировки FSH. Недавно измерение АМГ в сыворотке было добавлено к списку факторов, который включает возраст, ИМТ, продолжительность субфертильности, базальный уровень ФСГ и АФК.Алгоритмы, которые включают измерение ФСГ, AFC и AMH, называются тестами резерва яичников (ORT).
Точный и надежный расчет индивидуальной дозировки важен, поскольку как недостаточная, так и чрезмерная стимуляция могут привести к отмене цикла. Кроме того, чрезмерная реакция может привести к развитию синдрома гиперстимуляции яичников, потенциально опасного для жизни состояния. Однако неясно, улучшает ли использование этих клинических характеристик прогнозирование ответа яичников и клинических исходов.Broer et al. Провели 2 метаанализа, чтобы изучить добавленную стоимость ОРТ для характеристик пациентов, таких как возраст, ИМТ и продолжительность субфертильности (63, 64). Из этих 6 измеренных характеристик пациентов AMH и AFC имели самую высокую точность в прогнозировании чрезмерного ответа яичников, определяемого как выход более 15 ооцитов, и в прогнозировании плохого ответа яичников. Регрессионный анализ характеристик работы приемника для прогнозирования чрезмерного отклика показал, что площадь под кривой (AUC) равна 0.81 (95% ДИ, 0,76–0,87) для AMH и 0,79 (95% ДИ, 0,74–0,84) для AFC, соответственно. Объединение этих двух тестов немного улучшило модель (AUC 0,85). При прогнозировании плохого ответа яичников сопоставимые результаты были получены с AUC 0,78 (95% ДИ, 0,72–0,84) и 0,76 (95% ДИ, 0,70–0,82), соответственно (64). Основываясь на этих исследованиях, AMH и AFC являются лучшими параметрами для прогнозирования плохой или чрезмерной реакции яичников на COH.
Остается вопрос, улучшает ли индивидуализация лечения на основе этих параметров клинические исходы.Основываясь на исследованиях Broer et al, как AMH, так и AFC показали очень низкую прогностическую ценность для частоты наступления беременности после ЭКО, с AUC всего 0,50 и 0,55 соответственно (63, 64). В более позднем метаанализе этот вывод был дополнительно исследован путем повторной оценки 20 рандомизированных контролируемых испытаний (65). В согласии с исследованиями Broer et al (63, 64) авторы пришли к выводу, что изменение дозировки стимулирующих препаратов на основе индивидуальных ПРТ, включая АМГ, существенно не увеличивает шансы на беременность и живорождение.
Фрисс Петерсен и др. (66) исследовали влияние одного АМГ в индивидуальном алгоритме дозирования ФСГ на предполагаемый забор ооцитов (5–14 ооцитов) и клинические исходы пациентов, перенесших ЭКО. Сравнение дозировки ФСГ на основе АМГ со стандартной дозировкой показало, что процент непредвиденных ответов (<5 ооцитов или> 15 ооцитов) был сопоставим, как и клинические исходы с точки зрения частоты наступления беременности и рождения живого ребенка. Следовательно, хотя AMH является хорошим предиктором реакции яичников на COH, он не улучшает частоту наступления беременности и рождаемость.Однако важно отметить, что у женщин, у которых прогнозируется чрезмерный ответ, индивидуализированное лечение на основе ОРТ действительно привело к небольшому снижению вероятности развития синдрома гиперстимуляции яичников с OR 0,58 (95% ДИ, 0,34-1,00) на основе по 4 исследованиям (65).
Выводы, основанные на этих выводах, остаются сложными, поскольку в большинстве этих исследований использовались разные пороговые значения для ОРТ и различные анализы AMH. Таким образом, клиническое применение уровней АМГ для адаптации дозы на основе ОРТ еще предстоит продемонстрировать.
Оценка FOR при аутоиммунных заболеваниях
Женщины с аутоиммунными заболеваниями подвержены риску ранней менопаузы и, следовательно, повышенному риску бесплодия и заболеваний, связанных с менопаузой, таких как остеопороз и сердечно-сосудистые заболевания. Следовательно, в нескольких исследованиях анализировались уровни АМГ в сыворотке для оценки ФОР у женщин с аутоиммунными заболеваниями.
Недавний метаанализ 19 исследований, в которых анализировались пациенты с системной красной волчанкой, показал, что уровни АМГ в сыворотке крови были значительно ниже у пациентов с системной красной волчанкой по сравнению со здоровыми участниками контрольной группы (объединенные стандартизованные средние различия -0.79; 95% ДИ, от -1,41 до -0,18). Кроме того, уровни АМГ были дополнительно снижены иммунодепрессантом циклофосфамидом (объединенные стандартизованные средние различия -0,58; 95% ДИ, -0,87 до -0,30) (67).
У женщин с недавно начавшимся ревматоидным артритом (РА) уровни АМГ были сопоставимы со здоровыми участниками контрольной группы, и использование метотрексата не влияло на уровни АМГ (68). Однако в последующем исследовании более низкие уровни АМГ до зачатия наблюдались у женщин с РА, пытающихся забеременеть. Авторы предположили, что эту разницу можно объяснить продолжительностью заболевания.В согласии с этим, другие исследования также сообщили о снижении уровня АМГ в 1,3 раза у женщин с РА, имеющих продолжительность заболевания> 6 лет (69, 70). У пациентов с ювенильным идиопатическим артритом уровень АМГ был почти в 2 раза ниже (71).
У женщин с аутоиммунным заболеванием щитовидной железы (ATD) сообщалось о противоречивых результатах. Девочки-подростки, у которых впервые был поставлен диагноз АТД, имели нормальный или более высокий уровень АМГ по сравнению с контрольными участниками, соответствующими возрасту и ИМТ (72–74). У взрослых женщин в большинстве исследований сообщалось о скромных, но значительно более низких уровнях АМГ у женщин с дисфункцией щитовидной железы или подтвержденным АТД, хотя в одном исследовании наблюдалось повышение уровня АМГ (75).Однако прямая связь между измененными уровнями гормонов щитовидной железы и уровнями АМГ при ATD с добавлением левотироксина или без него остается неопределенной из-за противоречивых результатов (76-81). Если ATD влияет на FOR, степень в лучшем случае кажется скромной. Однако пока нельзя исключать влияние на исход COH. Хотя наличие ATD не ухудшало еще больше реакции на COH у женщин с низким уровнем AMH, оно действительно ухудшало реакцию COH у женщин с нормальным уровнем AMH (82).
Предполагается, что женщинам с диабетом 1 типа (СД1) наступит менопауза в более раннем возрасте (83), хотя в последнее время это ставится под сомнение.У женщин с СД1 старше 33 лет наблюдались в 2 раза более низкие уровни АМГ, а также процент наличия уровней АМГ в менопаузальном диапазоне был почти в 5 раз выше по сравнению с участниками контрольной группы (84). Напротив, хотя более низкие концентрации АМГ также наблюдались в большой когорте женщин с СД1 в общинах, это было только у женщин моложе 35 лет (85). Наконец, в поперечном исследовании с участием пациентов-контроля не наблюдалось никаких различий в уровнях АМГ, процентном соотношении уровней АМГ в менопаузальном диапазоне и возрасте менопаузы (86, 87).Эти противоречивые результаты можно частично объяснить тем фактом, что СД1 также характеризуется высокой распространенностью СПКЯ, что связано с повышенным уровнем АМГ. Таким образом, присутствие женщин с комбинированным СПКЯ и СД1 потенциально может оказывать скрытое влияние на уровень АМГ.
В целом, эти недавние исследования показывают, что связь между аутоиммунными заболеваниями и снижением FOR, по оценке AMH, остается противоречивой. Необходимы дополнительные хорошо контролируемые исследования для анализа влияния начала заболевания, продолжительности и терапии на уровни АМГ.
Оценка состояния после лечения рака
Известно, что химиотерапия оказывает неблагоприятное воздействие на функцию яичников и увеличивает риск развития первичной недостаточности яичников (ПНЯ) после лечения. В последние годы в ряде исследований анализировались уровни АМГ до и после лечения у пациентов с онкологическими заболеваниями, особенно с раком груди, который является наиболее распространенным раком у женщин во всем мире. Исследования сходятся во мнении, что после химиотерапии уровень АМГ быстро снижается до (почти) неопределяемого уровня (88, 89).Такое быстрое снижение можно объяснить немедленным устранением растущих фолликулов, производящих АМГ. Последующее восстановление функции яичников зависит от женщины. Чтобы улучшить консультирование пациентов с онкологическими заболеваниями относительно их будущей фертильности, были изучены уровни АМГ до и после лечения с целью выявления женщин с риском неудачного восстановления яичников. У пациентов с раком груди, у которых развился ПНЯ, уровень АМГ перед лечением был ниже, чем у тех, у кого возобновились менструации (89–91). Действительно, уровни АМГ перед лечением были прогностическими для ПНЯ, вызванного химиотерапией, у пациенток с раком груди в пременопаузе.В исследовании Anderson et al (89) пороговый уровень АМГ перед лечением <7,3 пмоль / л (1,022 нг / мл) давал AUC 0,77 с чувствительностью 95% и специфичностью 49%, в то время как в исследовании Xue et al., Пороговое значение AMH 0,965 нг / мл дало немного более высокую AUC 0,84 с чувствительностью 74% и специфичностью 82% (90, 91). Аналогичным образом, уровни AMH до лечения могут прогнозировать восстановление яичников, выраженное как уровень AMH ≥1 нг / мл через 12 месяцев после химиотерапии (скорректированный OR 1,659; CI 95%, 1,261-2.182), хотя обнаруженное значение было умеренным после 2 лет наблюдения (скорректированный OR 1,275; ДИ 95%, 1,141–1,426) (92). Однако индивидуальные различия в восстановлении яичников могут ограничивать прогностическую ценность AMH. Decantere et al. Показали, что молодые пациенты с раком груди, у которых менструация возобновилась через 6 месяцев после лечения, показали более раннее и более быстрое повышение уровня АМГ, чем у пациентов с медленным восстановлением, несмотря на то, что у них были аналогичные уровни АМГ до лечения и получался тот же протокол химиотерапии (93). Интересно, что в группе медленного восстановления уровни АМГ после лечения были ниже по сравнению с группой быстрого восстановления (93).Действительно, более низкие уровни АМГ после лечения также увеличивали риск ПНЯ, вызванного химиотерапией (89, 94). Хотя прогностическая ценность AMH не зависит от возраста, исследования согласны с тем, что у женщин моложе 40 лет уровень AMH после лечения выше (89, 94). У выживших онкологических больных скорость снижения АМГ такая же, как у женщин контрольной группы, несмотря на более низкие уровни АМГ после лечения (95). Это говорит о том, что у выживших после рака истощение FOR не ускоряется. Однако прогнозирование их репродуктивной продолжительности жизни остается сложной задачей и потребует дополнительных продольных исследований, контролируемых в зависимости от типа рака, возраста диагноза рака и схемы лечения.Недавнее исследование Су и др. (96), посвященное анализу выживших после рака груди, рака щитовидной железы и лимфомы, является одним из первых исследований, направленных на устранение этих ограничений. Траектории АМГ действительно различались в зависимости от гонадотоксического эффекта лечения. В то время как лечение в более молодом возрасте приводило к более высоким траекториям АМГ, этот защитный эффект был сведен на нет при лечении препаратами с высоким уровнем гонадотоксичности (96).
Предполагается, что у женщин, лечившихся от дифференцированного рака щитовидной железы, лечение радиоактивным йодом (RAI) вызывает раннюю менопаузу.Хотя влияние послеоперационного лечения RAI на уровни AMH кажется менее серьезным, чем химиотерапия, уровни AMH действительно снизились как минимум на 50% и показали лишь частичное восстановление (97–99). Кроме того, влияние лечения RAI на уровни АМГ было более выражено у пациентов в возрасте> 35 лет (97, 99). Таким образом, как и у пациентов с раком груди, яичниковый резерв может быть относительно защищен, если рак щитовидной железы диагностируется в более молодом возрасте. Однако, учитывая сильное снижение уровня АМГ у молодых женщин, в том числе при раке щитовидной железы, необходимы дополнительные проспективные исследования с достаточным последующим наблюдением.
Заключение
Улучшенная чувствительность и автоматизация анализов AMH усилили роль сывороточных уровней AMH как маркера FOR. Оценка уровней АМГ в сыворотке для прогнозирования ответа яичников на COH и возраста менопаузы, будь то естественная или ятрогенная, может быть полезной. Однако появились и ограничения. Для правильной интерпретации уровней АМГ необходимы дополнительные знания об эндогенных и экзогенных факторах, которые регулируют экспрессию АМГ.Исследования также предполагают, что существует неоднородность траекторий АМГ, что может препятствовать применению при индивидуальном консультировании пациентов. За последние годы увеличилось количество тестов для измерения АМГ. Однако между анализами существуют различия. Поэтому срочно необходим международный стандарт для AMH, чтобы установить пороговые значения, не зависящие от анализа.
Сокращения
aa
AFC
AMH
AMH C
25kDa C-terminal зрелый регион
AMH N
AMH N
ATD
аутоиммунное заболевание щитовидной железы
AUC
BMI
CI
COH
контролируемая гиперстимуляция яичников
- иммуноферментный анализ
ELISA
FOR
функциональный резерв яичников
FSH
фолликулостимулирующий гормон
HC
IVF
ORstic
polyT
polyT
polyT 9000 синдром 9 0005
POI
первичная недостаточность яичников
proAMH
Гомодимер с дисульфидной связью 140 кДа
RA
RAI
RNA
1VitD
Сокращения
0
Благодарности
Финансовая поддержка: Финансирование получено не было.
Дополнительная информация
Сводка раскрытия информации: L.M.E.M. не имеет конфликта интересов. J.A.V. получил гонорары за анализы AMH, выплаченные институту / лаборатории без личной финансовой выгоды.
Доступность данных
Совместное использование данных не применимо к этой статье, так как в ходе текущего исследования наборы данных не создавались и не анализировались.
Список литературы
1.Jeppesen
JV
,Anderson
RA
,Kelsey
TW
и др.Какие фолликулы вырабатывают у человека больше всего антимюллерова гормона? Доказательства резкого снижения выработки АМГ во время отбора фолликулов
.Mol Hum Reprod.
2013
;19
(8
):519
—527
.2.te Velde
ER
,Scheffer
GJ
,Dorland
M
,Broekmans
FJ
,Fauser
BC
.Аспекты развития и эндокринные аспекты нормального старения яичников
.Mol Cell Endocrinol.
1998
;145
(1-2
):67
—73
. 3.Dewailly
D
,Andersen
CY
,Balen
A
и др.Физиология и клиническое применение антимюллерова гормона у женщин
.Обновление Hum Reprod.
2014
;20
(3
):370
—385
.4.Gleicher
N
,Weghofer
A
,Barad
DH
.Определение овариального резерва для лучшего понимания старения яичников
.Репрод Биол Эндокринол.
2011
;9
:23
.5.Финдли
JK
,Hutt
KJ
,Hickey
M
,Андерсон
RA
.Что такое «яичниковый резерв»?
Fertil Steril.
2015
;103
(3
):628
—630
.6.Кевенаар
ME
,Meerasahib
MF
,Kramer
P
и др.Уровни антимюллерова гормона в сыворотке отражают размер пула примордиальных фолликулов у мышей
.Эндокринология.
2006
;147
(7
):3228
—3234
. 7.Hansen
KR
,Hodnett
GM
,Knowlton
N
,Craig
LB
.Корреляция тестов яичникового резерва с гистологически определенным номером примордиального фолликула
.Fertil Steril.
2011
;95
(1
):170
—175
. 8.von Wolff
M
,Roumet
M
,Stute
P
,Liebenthron
J
.Концентрация антимюллерова гормона (АМГ) в сыворотке крови имеет ограниченную прогностическую ценность для плотности примордиальных и первичных фолликулов, что ставит под сомнение ее как точный параметр для овариального резерва
.Maturitas.
2020
;134
:34
—40
.9.Liebenthron
J
,Reinsberg
J
,van der Ven
K
,Saenger
N
,Kruessel
JS
,von
,von
,von
Концентрация антимюллерова гормона в сыворотке и плотность фолликулов на протяжении репродуктивной жизни и при различных заболеваниях, влияющих на сохранение фертильности
.Hum Reprod.
2019
;34
(12
):2513
—2522
.10.Sermondade
N
,Sonigo
C
,Sifer
C
и др.Сывороточный антимуллеров гормон связан с количеством ооцитов, созревших in vitro, и с плотностью примордиальных фолликулов у кандидатов на сохранение фертильности
.Fertil Steril.
2019
;111
(2
):357
—362
.11.Kelsey
TW
,Wright
P
,Nelson
SM
,Anderson
RA
,Wallace
WH
.Проверенная модель сывороточного антимюллерова гормона от зачатия до менопаузы
.PLoS One.
2011
;6
(7
):e22024
.12.Ли Фонг
S
,Visser
JA
,Welt
CK
и др.Уровни антимюллерова гормона в сыворотке у здоровых женщин: номограмма от младенчества до зрелого возраста
.J Clin Endocrinol Metab.
2012
;97
(12
):4650
—4655
. 13.Уоллес
WH
,Келси
TW
.Резерв яичников человека от зачатия до менопаузы
.PLoS One.
2010
;5
(1
):e8772
.14.Du
X
,Ding
T
,Zhang
H
и др.Возрастной нормальный референсный диапазон сывороточного антимюллерова гормона у здоровых китайских ханьских женщин: общенациональное популяционное исследование
.Reprod Sci.
2016
;23
(8
):1019
—1027
. 15.Okunola
OT
,Ajenifuja
OK
,Loto
MO
и др.Возрастные номограммы для фолликулостимулирующего гормона и антимюллерова гормона: пилотное исследование в Иле-Ифе, Нигерия
.Int J Reprod Biomed (Йезд).
2016
;14
(12
):777
—782
. 16.Тегерани
FR
,Мансурния
MA
,Солаймани-Додаран
M
,Азизи
F
.Возрастные уровни антимюллерова гормона в сыворотке: оценки по большой выборке среди населения
.Климактерический.
2014
;17
(5
):591
—597
. 17.Nelson
SM
,Messow
MC
,McConnachie
A
и др.Внешнее подтверждение номограммы снижения уровня антимюллерова гормона в сыворотке крови у женщин: популяционное исследование 15 834 пациенток с бесплодием
.Reprod Biomed Online.
2011
;23
(2
):204
—206
.18.Nelson
SM
,Messow
MC
,Wallace
AM
,Fleming
R
,McConnachie
A
.Номограмма снижения уровня антимуллерного гормона в сыворотке: популяционное исследование 9601 пациента с бесплодием
.Fertil Steril.
2011
;95
:736
—741
. 19.Bozdag
G
,Calis
P
,Zengin
D
,Tanacan
A
,Karahan
S
.Возрастная нормограмма количества антральных фолликулов в общей популяции и сравнение с предыдущими исследованиями
.евро J Obstet Gynecol Reprod Biol.
2016
;206
:120
—124
.20.Loy
SL
,Cheung
YB
,Fortier
MV
и др.Возрастные номограммы для подсчета антральных фолликулов и антимюллерова гормона для субфертильных китайских женщин в Сингапуре
.PLoS One.
2017
;12
(12
):e0189830
. 21.Нельсон
SM
,Aijun
S
,Ling
Q
и др.Этническое несоответствие в сыворотке крови антимюллерова гормона у здоровых женщин: популяционное исследование из Китая и Европы
.Reprod Biomed Online.
2020
;40
(3
):461
—467
. 22.Bleil
ME
,Gregorich
SE
,Adler
NE
,Sternfeld
B
,Rosen
MIMP
,Кедры
.
Расовые / этнические различия в репродуктивном возрасте: исследование оценок резерва яичников в четырех расовых / этнических группах здоровых, регулярно ездящих на велосипеде женщин
.Fertil Steril.
2014
;101
(1
):199
—207
. 23.Schuh-Huerta
SM
,Johnson
NA
,Rosen
MP
,Sternfeld
B
,Cedars
MI
000RA
jo.Генетические варианты и факторы окружающей среды, связанные с гормональными маркерами овариального резерва у женщин европеоидной расы и афроамериканок
.Hum Reprod.
2012
;27
(2
):594
—608
. 24.Tsepelidis
S
,Devreker
F
,Demeestere
I
,Flahaut
A
,Gervy
Ch
, Engler EnglerСтабильные уровни антимюллерова гормона в сыворотке крови во время менструального цикла: проспективное исследование у нормоовуляторных женщин
.Hum Reprod.
2007
;22
(7
):1837
—1840
. 25.Горкем
У
,Тогрул
С
.Есть ли необходимость изменить время измерения антимюллерова гормона во время менструального цикла?
Geburtshilfe Frauenheilkd.
2019
;79
(7
):731
—737
. 26.Ламберт-Мессерлиан
G
,Plante
B
,Eklund
EE
,Raker
C
,Moore
RG
.Уровни антимуллеровых гормонов в сыворотке крови во время нормального менструального цикла
.Fertil Steril.
2016
;105
:208
—213 e201
.27.Melado
L
,Lawrenz
B
,Sibal
J
и др.Антимюллеров гормон во время естественного цикла имеет значительные вариации внутри цикла и между циклами при измерении с помощью полностью автоматизированного анализа
.Front Endocrinol (Лозанна).
2018
;9
:686
,28.Overbeek
A
,Broekmans
FJ
,Hehenkamp
WJ
и др.Внутрицикловые колебания антимюллерова гормона у здоровых женщин с регулярным циклом: повторный анализ
.Reprod Biomed Online.
2012
;24
(6
):664
—669
. 29.Bungum
L
,Tagevi
J
,Jokubkiene
L
и др.Влияние биологической изменчивости или эффективности анализа на измерения AMH: проспективное когортное исследование с AMH, протестированным на трех аналитических платформах
.Front Endocrinol (Лозанна).
2018
;9
:603
.30.Cate
RL
,Mattaliano
RJ
,Hession
C
и др.Выделение генов крупного рогатого скота и человека на вещество, ингибирующее мюллеров, и экспрессию человеческого гена в клетках животных
.Ячейка.
1986
;45
(5
):685
—698
. 31.Пепинский
РБ
,Sinclair
LK
,Чоу
EP
и др.Протеолитический процессинг вещества, ингибирующего мюллериан, дает бета-подобный фрагмент трансформирующего фактора роста
.J Biol Chem.
1988
;263
(35
):18961
—18964
. 32.Nachtigal
МВт
,Ingraham
HA
.Биоактивация вещества, ингибирующего мюллериан, во время развития гонад с помощью kex2 / субтилизин-подобной эндопротеазы
.Proc Natl Acad Sci U S A
1996
;93
:7711
—7716
.33.Донахью
ПК
.Вещество, ингибирующее Мюллера при репродукции и раке
.Mol Reprod Dev.
1992
;32
(2
):168
—172
. 34.Гасснер
D
,Юнг
R
.Первый полностью автоматизированный иммуноферментный анализ на антимюллеров гормон
.Clin Chem Lab Med.
2014
;52
(8
):1143
—1152
.35.Hyldgaard
J
,Bor
P
,Ingerslev
HJ
,Tørring
N
.Сравнение двух различных методов измерения антимюллерова гормона в клинической серии
.Репрод Биол Эндокринол.
2015
;13
:107
,36.Нельсон
SM
,Пастушек
E
,Клосс
G
и др.Два новых автоматизированных по сравнению с двумя иммуноферментными иммуноферментными анализами антимуллерных гормонов
.Fertil Steril
.2015
;104
:1016
—1021 e1016
.37.Pearson
K
,Long
M
,Prasad
J
,Wu
YY
,Bonifacio
M
.Оценка анализа Access AMH как автоматизированной высокопроизводительной замены ручного ELISA
AMH поколения II.Репрод Биол Эндокринол.
2016
;14
:8
,38.ван Хелден
J
,Weiskirchen
R
.Производительность двух новых полностью автоматизированных иммуноанализа на антимюллеровы гормоны по сравнению с клиническим стандартным анализом
.Hum Reprod.
2015
;30
(8
):1918
—1926
. 39.Pankhurst
MW
,McLennan
IS
.Кровь человека содержит как нерасщепленный предшественник антимюллеровского гормона, так и комплекс Nh3- и COOH-концевых пептидов
.Am J Physiol Endocrinol Metab.
2013
;305
(10
):E1241
—E1247
.40.di Clemente
N
,Jamin
SP
,Луговской
A
и др.Процессинг антимюллерова гормона регулирует активацию рецептора по механизму, отличному от TGF-бета
.Мол эндокринол.
2010
;24
(11
):2193
—2206
. 41.Wissing
ML
,Mikkelsen
AL
,Kumar
A
и др.Ассоциации различных молекулярных форм антимуллерного гормона и биомаркеров синдрома поликистозных яичников и нормальных женщин
.Fertil Steril
.2019
;112
:149
—155 e141
.42.Amer
SAKS
,James
C
,Al-Hussaini
TK
,Mohamed
AA
.Оценка циркулирующего антимюллерова гормона у женщин, использующих гормональные контрацептивы: систематический обзор
.J Womens Health (Larchmt).
2020
;29
(1
):100
—110
. 43.Landersoe
SK
,Forman
JL
,Береза Петерсен
K
и др.Маркеры резерва яичников у женщин, использующих различные гормональные контрацептивы
.евро J Contracept Reprod Health Care.
2020
;25
(1
):65
—71
. 44.Moslehi
N
,Shab-Bidar
S
,Ramezani Tehrani
F
,Mirmiran
P
,Azizi
F
.Связан ли овариальный резерв с индексом массы тела и ожирением у женщин репродуктивного возраста? Мета-анализ
.Менопауза.
2018
;25
(9
):1046
—1055
. 45.Merhi
Z
,Buyuk
E
,Berger
DS
и др.Лептин подавляет экспрессию гена антимюллерова гормона посредством пути JAK2 / STAT3 в лютеинизированных клетках гранулезы женщин, подвергающихся ЭКО
.Hum Reprod.
2013
;28
(6
):1661
—1669
.46. Ding
X
,Kou
X
,Zhang
Y
,Zhang
X
,Cheng
G
,T
9.Лептин siRNA способствует апоптозу клеток гранулезы яичников и влияет на стероидогенез, увеличивая экспрессию рецептора NPY2
.Gene.
2017
;633
:28
—34
. 47.Деннис
NA
,Houghton
LA
,Jones
GT
,van Rij
AM
,Morgan
K
,McLennan IS
.Уровень сывороточного антимюллерова гормона коррелирует со статусом витамина D у мужчин и женщин, но не у мальчиков
.J Clin Endocrinol Metab.
2012
;97
(7
):2450
—2455
. 48.Деннис
NA
,Houghton
LA
,Pankhurst
MW
,Harper
MJ
,McLennan
IS
.Острые добавки с высокими дозами витамина D3 повышают уровень антимюллерова гормона в сыворотке крови у молодых женщин
.Питательные вещества
.2017
;9
(7): 719,49.Xu
J
,Hennebold
JD
,Seifer
DB
.Прямое действие витамина D3 на фолликулы макаки-резус в трехмерной культуре: оценка выживаемости, роста фолликулов, выработка стероидов и антимуллерианских гормонов
.Fertil Steril
.2016
;106
:1815
—1820 e1811
.50.Xu
J
,Lawson
MS
,Xu
F
и др.Витамин D3 регулирует развитие фолликулов и внутрифолликулярный биосинтез витамина D и передачу сигналов в яичниках приматов
.Front Physiol.
2018
;9
:1600
.51.Merhi
Z
,Doswell
A
,Krebs
K
,Cipolla
M
.Витамин D изменяет гены, участвующие в развитии фолликулов и стероидогенезе в клетках гранулезных кумулюсов человека
.J Clin Endocrinol Metab.
2014
;99
(6
):E1137
—E1145
. 52.Кришнан
AV
,Морено
J
,Nonn
L
и др.Новые пути, которые способствуют антипролиферативной и химиопрофилактической активности кальцитриола при раке простаты
.J Стероид Biochem Mol Biol.
2007
;103
(3-5
):694
—702
. 53.Balasch
J
,Gratacós
E
.Задержка деторождения: влияние на фертильность и исход беременности
.Fetal Diagn Ther.
2011
;29
(4
):263
—273
. 54.Depmann
M
,Eijkemans
MJC
,Broer
SL
и др.Связан ли АМГ со сроком менопаузы? Результаты метаанализа индивидуальных данных пациента
.J Clin Endocrinol Metab.
2018
; 103: 3593-3600.55.Kim
C
,Slaughter
JC
,Wang
ET
и др.Антимюллеров гормон, фолликулостимулирующий гормон, количество антральных фолликулов и риск менопаузы в течение 5 лет
.Maturitas.
2017
;102
:18
—25
.56.Finkelstein
JS
,Lee
H
,Karlamangla
A
и др.Антимуллерный гормон и надвигающаяся менопауза в позднем репродуктивном возрасте: исследование здоровья женщин в стране
.Дж. Клин Эндокринол Метаб
.2020
;105
: 1862-1871. 57.Bertone-Johnson
ER
,Manson
JE
,Purdue-Smithe
AC
и др.Уровни антимюллерова гормона и частота ранней естественной менопаузы в проспективном исследовании
.Hum Reprod.
2018
;33
(6
):1175
—1182
. 58.de Kat
AC
,van der Schouw
YT
,Eijkemans
MJ
, et al.Назад к основам старения яичников: популяционное исследование продольного снижения уровня антимюллерова гормона
.BMC Med.
2016
;14
(1
):151
. 59.de Kat
AC
,van der Schouw
YT
,Eijkemans
MJC
,Broer
SL
,Verschuren
WMM
0004 WMM0005Можно ли улучшить прогнозирование менопаузы с помощью нескольких измерений AMH? Результаты проспективного когортного исследования Doetinchem
.J Clin Endocrinol Metab.
2019
;104
(11
):5024
—5031
.60.Рамезани Тегерани
F
,Бидхенди Яранди
R
,Солаймани-Додаран
M
,Тохиди
M
, 9000 9000 Firouzi 9000 9000 FirouziУлучшение предсказания возраста в период менопаузы с использованием множественных измерений антимюллерова гормона: Тегеранское липидно-глюкозное исследование
.Дж. Клин Эндокринол Метаб
.2020
;105
: 1589-1598.61.Gohari
MR
,Ramezani Tehrani
F
,Chenouri
S
,Solaymani-Dodaran
M
,Azizi
F
.Индивидуальные прогнозы времени до менопаузы с использованием нескольких измерений антимюллерова гормона
.Менопауза.
2016
;23
(8
):839
—845
.62.Alper
MM
,Fauser
BC
.Протоколы стимуляции яичников при ЭКО: лучше лучше, чем меньше?
Reprod Biomed Online.
2017
;34
(4
):345
—353
0,63.Broer
SL
,Dolleman
M
,van Disseldorp
J
и др.Прогнозирование чрезмерного ответа при экстракорпоральном оплодотворении на основе характеристик пациенток и тестов яичникового резерва и сравнение в подгруппах: метаанализ индивидуальных данных пациента
.Fertil Steril.
2013
;100
:420
—429 e427
.64.Broer
SL
,van Disseldorp
J
,Broeze
KA
и др. ;ИМПОРТ исследовательская группа
.Дополнительные преимущества тестирования яичникового резерва на характеристиках пациенток при прогнозировании ответа яичников и продолжающейся беременности: индивидуальный подход к данным пациента
.Обновление Hum Reprod.
2013
;19
(1
):26
—36
.65.Lensen
SF
,Wilkinson
J
,Leijdekkers
JA
, et al.Индивидуальный подбор дозы гонадотропина с использованием маркеров овариального резерва для женщин, подвергшихся экстракорпоральному оплодотворению плюс интрацитоплазматическая инъекция сперматозоидов (ЭКО / ИКСИ)
.Кокрановская база данных Syst Rev
.2018
;2
:CD012693
.66.Friis Petersen
J
,Lokkegaard
E
,Andersen
LF
и др.Рандомизированное контролируемое исследование индивидуализированного дозирования ФСГ на основе АМГ в протоколе антагонистов ГнРГ для ЭКО
.Hum Reprod Open
.2019
;2019
:hoz003
.67.Luo
W
,Mao
P
,Zhang
L
,Chen
X
,Yang
Z
.Оценка овариального резерва с помощью сывороточного антимюллерова гормона у пациентов с системной красной волчанкой: метаанализ
.Ann Palliat Med.
2020
;9
(2
):207
—215
0,68.Brouwer
J
,Laven
JS
,Hazes
JM
,Schipper
I
,Dolhain
RJ
.Уровни сывороточного антимюллерова гормона, маркера овариального резерва, у женщин с ревматоидным артритом
.Центр по уходу за артритом (Хобокен).
2013
;65
(9
):1534
—1538
.69.Henes
M
,Froeschlin
J
,Taran
FA
и др.Изменения резерва яичников у женщин в пременопаузе с хроническими воспалительными ревматическими заболеваниями: влияние ревматоидного артрита, болезни Бехчета и спондилоартрита на уровни антимюллерова гормона
.Ревматология (Оксфорд).
2015
;54
(9
):1709
—1712
.70.Eudy
AM
,McDaniel
G
,Hurd
WW
,Clowse
MEB
.Фертильность и яичниковый резерв у женщин с ревматоидным артритом
.J Rheumatol.
2019
;46
(5
):455
—459
. 71.Феррейра
GRV
,Tomioka
RB
,Aikawa
NE
и др.Яичниковый резерв у молодых пациентов с ювенильным идиопатическим артритом
.Mod Rheumatol.
2019
;29
(3
):447
—451
.72.Erol
O
,Parlak
M
,Ellidağ
HY
и др.Уровни антимюллерова гормона в сыворотке у эутиреоидных девочек-подростков с тиреоидитом Хашимото: взаимосвязь с антиоксидантным статусом
.евро J Obstet Gynecol Reprod Biol.
2016
;203
:204
—209
,73.Özalp Akın
E
,Aycan
Z
.Оценка овариального резерва у подростков с тиреоидитом Хашимото с использованием сывороточных уровней антимюллерова гормона
.J Clin Res Pediatr Endocrinol.
2018
;10
(4
):331
—335
0,74.Pirgon
O
,Sivrice
C
,Demirtas
H
,Dundar
B
.Оценка овариального резерва у эутиреоидных подростков с тиреоидитом Хашимото
.Gynecol Endocrinol.
2016
;32
(4
):306
—310
.75.Tuten
A
,Hatipoglu
E
,Oncul
M
и др.Оценка овариального резерва при тиреоидите Хашимото
.Gynecol Endocrinol.
2014
;30
(10
):708
—711
,76.Kuroda
K
,Uchida
T
,Nagai
S
и др.Повышенный уровень тиреотропного гормона в сыворотке крови связан со снижением уровня антимюллерова гормона у бесплодных женщин репродуктивного возраста
.J Assist Reprod Genet.
2015
;32
(2
):243
—247
0,77.Weghofer
A
,Barad
DH
,Darmon
S
,Kushnir
VA
,Gleicher
N
.Что влияет на функциональный резерв яичников, функцию щитовидной железы или аутоиммунитет щитовидной железы?
Репрод Биол Эндокринол.
2016
;14
(1
):26
.78.Bahri
S
,Tehrani
FR
,Amouzgar
A
и др.Сверхурочная динамика гормонов щитовидной железы и аутоиммунитета щитовидной железы и яичникового резерва: продольное популяционное исследование с 12-летним наблюдением
.BMC Endocr Disord.
2019
;19
(1
):47
0,79.Chen
CW
,Huang
YL
,Tzeng
CR
,Huang
RL
,Chen
CH
.Идиопатический низкий резерв яичников связан с более частыми положительными антителами к тироидной пероксидазе
.Щитовидная железа.
2017
;27
(9
):1194
—1200
.80.Rao
M
,Wang
H
,Zhao
S
и др.Субклинический гипотиреоз связан с более низким овариальным резервом у женщин в возрасте 35 лет и старше
.Щитовидная железа.
2020
;30
(1
):95
—105
.81.Kuroda
M
,Kuroda
K
,Segawa
T
и др.Добавка левотироксина улучшает сывороточные уровни антимюллерова гормона у бесплодных пациентов с тиреоидитом Хашимото
.J Obstet Gynaecol Res.
2018
;44
(4
):739
—746
.82.Magri
F
,Schena
L
,Capelli
V
и др.Антимюллеров гормон как прогностический фактор овариального резерва в протоколах ВРТ: скрытая роль аутоиммунитета щитовидной железы
.Репрод Биол Эндокринол.
2015
;13
(1
):106
,83.Dorman
JS
,Steenkiste
AR
,Foley
TP
и др.;Исследование семейных аутоиммунных заболеваний и диабета (FAD)
.Менопауза у женщин с диабетом 1 типа: она преждевременна?
Диабет.
2001
;50
(8
):1857
—1862
.84.Soto
N
,Iñiguez
G
,López
P
и др.Уровни антимюллерова гормона и ингибина B как маркеры преждевременного старения яичников и перехода к менопаузе при сахарном диабете 1 типа
.Hum Reprod.
2009
;24
(11
):2838
—2844
.85.Ким
C
,Karvonen-Gutierrez
C
,Kong
S
и др.Антимюллеровый гормон среди женщин с диабетом 1 типа и без него: исследование эпидемиологии вмешательств и осложнений диабета и исследование здоровья костей и метаболизма в Мичигане
.Fertil Steril.
2016
;106
(6
):1446
—1452
.86.Yarde
F
,Spiering
W
,Franx
A
и др. ;Исследовательская группа OVADIA
.Связь между здоровьем сосудов и старением яичников при сахарном диабете 1 типа
.Hum Reprod.
2016
;31
(6
):1354
—1362
. 87.Yarde
F
,van der Schouw
YT
,de Valk
HW
и др.;Исследовательская группа OVADIA
.Возраст наступления менопаузы у женщин с сахарным диабетом 1 типа: исследование OVADIA
.Hum Reprod.
2015
;30
(2
):441
—446
0,88.Чжун
Y
,Lin
Y
,Cheng
X
и др.GnRHa для защиты яичников и связь между AMH и функцией яичников во время адъювантной химиотерапии рака груди
.J Рак.
2019
;10
(18
):4278
—4285
. 89.Андерсон
RA
,Mansi
J
,Coleman
RE
,Адамсон
DJA
,Леонард
RCF
.Применение антимюллерова гормона в диагностике и прогнозировании потери функции яичников после химиотерапии при раннем раке груди
.евро J Рак.
2017
;87
:58
—64
.90.Xue
C
,Wei
W
,Sun
P
и др.Номограмма на основе антимюллерова гормона перед лечением позволяет прогнозировать менструальный статус после химиотерапии у женщин в пременопаузе с положительным по рецепторам гормона ранним раком молочной железы
.Лечение рака груди.
2019
;173
(3
):619
—628
.91.Passildas
J
,Collard
O
,Savoye
AM
и др.Влияние менопаузы, вызванной химиотерапией, у женщин детородного возраста с неметастатическим раком груди — предварительные результаты исследования MENOCOR
.Clin рака груди.
2019
;19
(1
):e74
—e84
.92.Lee
DY
,Park
YH
,Lee
JE
,Choi
D
.Прогнозирование восстановления функции яичников у молодых больных раком молочной железы после защиты агонистом гонадотропин-рилизинг гормона во время химиотерапии
.Лечение рака груди.
2018
;171
(3
):649
—656
0,93.Декантер
C
,Cloquet
M
,Dassonneville
A
,D’Orazio
E
,Mailliez
A
, P,Различные модели восстановления яичников после лечения рака предполагают различную индивидуальную восприимчивость яичников к химиотерапии
.Reprod Biomed Online.
2018
;36
(6
):711
—718
.94.Kim
HA
,Choi
J
,Park
CS
и др. ;Исследователи ASTRRA
.Уровень антимюллерова гормона в сыворотке после химиотерапии позволяет прогнозировать восстановление функции яичников
.Endocr Connect.
2018
;7
(8
):949
—956
0,95.Cameron
K
,Sammel
MD
,Prewitt
M
,Gracia
C
.Дифференциальная скорость изменения показателей овариального резерва у молодых выживших после рака в течение репродуктивной жизни
.J Clin Endocrinol Metab.
2019
;104
(5
):1813
—1822
.96.Su
HI
,Kwan
B
,Whitcomb
BW
и др.Моделирование вариаций продолжительности репродуктивной жизни у выживших после рака девочек-подростков и молодых взрослых с использованием AMH
.Дж. Клин Эндокринол Метаб
.2020
; 105 (8) .97.Yaish
I
,Azem
F
,Gutfeld
O
и др.Однократное лечение радиоактивным йодом оказывает пагубное влияние на резерв яичников у женщин с раком щитовидной железы: результаты проспективного пилотного исследования
.Щитовидная железа.
2018
;28
(4
):522
—527
0,98.Evranos
B
,Faki
S
,Polat
SB
,Bestepe
N
,Ersoy
R
,0004 Cakir0005.Влияние терапии радиоактивным йодом на овариальный резерв: проспективное пилотное исследование
.Щитовидная железа.
2018
;28
(12
):1702
—1707
.99.van Velsen
EFS
,Visser
WE
,van den Berg
SAA
и др.Продольный анализ влияния радиойодтерапии на овариальный резерв у женщин с дифференцированным раком щитовидной железы
.Щитовидная железа.
2020
;30
(4
):580
—587
.© Endocrine Society 2020.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 4.0 /), который разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.AMH | Тест на мюллеровский гормон и яичниковый резерв
Предпочтительное Местоположение не— Ни -Bondi Junction Рождаемость ClinicAlexandria Рождаемость ClinicBurwood Рождаемость ClinicCanberra Рождаемость ClinicCastle Hill Рождаемость ClinicDee Почему фертильность ClinicDubbo Рождаемость ClinicGosford Рождаемость ClinicHunter IVFRegional ConsultationGreenwich Рождаемость ClinicKogarah Рождаемость ClinicMiranda Рождаемость ClinicSydney CBD Рождаемость ClinicWahroonga Рождаемость ClinicWestmead рождаемости ClinicWollongong рождаемости ClinicCoffs HarbourOrangeWagga Wagga
Желаемый специалист— Нет -A / Проф. Христос ВенетисA / Проф. Дэвид ГриннингA / Проф.Гэвин Сакс А. / Проф. Питер IllingworthDr Алехандра IzurietaDr Эндрю HedgesDr Эндрю KanDr Bronwyn DevineDr Chandra KrishnanDr Дэвид O’RourkeDr Дебра KennedyDr Denise NesbittDr Элизабет MaxwellDr Фрэнк QuinnDr Iris WangDr Джеффри PerssonDr Карен KongDr Луиза FayDr Мэнни MangatDr Марсела MartinDr Майкл CostelloDr Мишель KwikDr Питер LeungDr Рабиа ShaikhDr Raewyn TeirneyDr Рауф FaragDr Рехана LulaniaDr Роберт Лахуд, д-р Сима Мохиуддин, д-р Шади Хашаба, д-р Стив Рэймонд, д-р Стивен Адэр, д-р Сьюзан Уинспир, д-р Тили Сиванантан, д-р Вафа Самен, д-р.Шеннон (Хи Гён) КимПроф. Майкл Чепмен
Антимюллеров гормон | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
2019 обзор выполнен Оладжумоке Оладипо, доктором медицины, DABCC, FAACC, доцентом кафедры патологии и лабораторной медицины Медицинского центра им. Милтона С. Херши штата Пенсильвания.
Anti Müllerian Hormone (AMH), Сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно на сайте https: // www.mayocliniclabs.com/test-catalog/Clinical+and+Interpretive/89711 через http://www.mayomedicallaboratories.com. По состоянию на январь 2019 г.
Мари Линдхардт Йохансен и др. Антимюллеров гормон и его клиническое использование в педиатрии с особым упором на нарушения полового развития. Международный журнал эндокринологии Том 2013, ID статьи 198698, 10 страниц. Доступно в Интернете по адресу http://dx.doi.org/10.1155/2013/198698. По состоянию на январь 2019 г.
Inthrani R. Indran et al.Упрощенные критерии из 4 пунктов для синдрома поликистозных яичников Слишком далеко? Clin Endocrinol. 2018; 89: 202-211. Доступно на сайте https://www.medscape.com/viewarticle/899873. Доступ онлайн, январь 2019 г.
Бесплодие. ARUP Консультации [Он-лайн информация]. Доступно в Интернете по адресу https://arupconsult.com/content/infertility. По состоянию на январь 2019 г.
Североамериканское общество менопаузы. Рекомендации по клинической помощи, Глава 1: Менопауза. Доступно в Интернете по адресу http: // www.menopause.org/publications/clinical-care-recommendations/chapter-1-menopause. По состоянию на январь 2019 г.
Международное научно обоснованное руководство по оценке и лечению синдрома поликистозных яичников, 2018 г. Доступно в Интернете по адресу https://www.pcoschallenge.org/pdf/PCOS-Evidence-Based-Guideline.pdf. По состоянию на январь 2019 г.
(24 октября 2018 г.) FDA разрешает маркетинг диагностического теста для определения статуса менопаузы. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно на сайте https: // www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm624284.htm. По состоянию на январь 2019 г.
Источники, использованные в предыдущих обзорах
Дуглас Д. (9 декабря 2010 г.). С возрастом у женщин количество антимюллеровских гормонов снижается. Medscape Today от Reuters Информация о здоровье [онлайн-информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/733995. По состоянию на май 2011 г.
Pasquali, R. et. al. (29 марта 2011 г.). Исследование синдрома поликистозных яичников сегодня и завтра. Medscape Today от Clin Endocrinol .2011; 74 (4): 424-433 [Он-лайн информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/739208. По состоянию на май 2011 г.
Форвик, Л. (Обновлено 3 сентября 2010 г.). Анорхия. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001185.htm. По состоянию на май 2011 г.
Байрак-Тойдемир, П. (обновлено в июле 2010 г.). Бесплодие. ARUP Консультации [Он-лайн информация]. Доступно в Интернете по адресу http://www.arupconsult.com/Topics/Infertility.html? client_ID = LTD # tabs = 0. По состоянию на май 2011 г.
(© 1995–2011). Код единицы 89711: Антимуллерианский гормон (АМГ), сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/89711. По состоянию на май 2011 г.
Sowers, M. et. al. (Сентябрь 2008 г.) Антимюллеров гормон и ингибин B в определении старения яичников и перехода к менопаузе. Журнал клинической эндокринологии и метаболизма Vol.93, № 9 3478-3483. [Он-лайн информация]. Доступно в Интернете по адресу http://jcem.endojournals.org/cgi/content/full/93/9/3478. По состоянию на май 2011 г.
Achermann, J. Editor et. al. (Март 2011 г.). Неопределенные гениталии. The Hormone Foundation [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://www.hormone.org/Resources/upload/Ambiguous-Genitalia-Bilingual-WEB.pdf. По состоянию на май 2011 г.
Возницки К. (28 июня 2010 г.). Анализ крови помогает предсказать менопаузу. Medscape Today от WebMD Health News [Он-лайн информация].Доступно в Интернете по адресу http://www.medscape.com/viewarticle/724256. По состоянию на май 2011 г.
Экман, А. (Обновлено 31 августа 2010 г.). Синдром нечувствительности к андрогенам. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001180.htm. По состоянию на май 2011 г.
Kronenberg, H. et. al. (© 2008). Учебник эндокринологии Уильямса, 11-е издание: Saunders Elsevier, Philadelphia, PA. ПП 793, 800, 828.
Visser JA, et.А1: Антимюллеров гормон: новый маркер функции яичников. Репродукция 131: 1-9, 2006.
Durlinger ALL, et. А1: Регуляция функции яичников: роль антимюллеровского гормона. Репродукция 124: 601-609, 2002.
La Marca A, Volpe A: Антимюллеров гормон (АМГ) в женской репродукции: полезно ли измерение циркулирующего АМГ? Clin Endrocrinol 64: 603-610, 2006.
La Marca A, Volpe A: антимюллеров гормон и рак яичников. Обновление репродукции человека 13: 265-273, 2007.
(обновлено 22 марта 2013 г.). Как диагностируется бесплодие? Юнис Кеннеди Шрайвер Национальный институт детского здоровья и развития человека [Он-лайн информация]. Доступно в Интернете по адресу http://www.nichd.nih.gov/health/topics/infertility/conditioninfo/Pages/diagnposed.aspx. По состоянию на январь 2015 г.
(2014). Что вы должны знать о продолжительности репродуктивного периода. Североамериканское общество менопаузы, Менопауза, v21 (1) [Он-лайн информация].Доступно в Интернете по адресу http://www.menopause.org/docs/default-source/for-women/what_you_should_know_about_your_reproductive_time-16.pdf. По состоянию на январь 2015 г.
Storck, S. (Обновлено 24 февраля 2014 г.). Бесплодие. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/001191.htm. По состоянию на январь 2015 г.
(обновлено 20 июня 2013 г.). Часто задаваемые вопросы о бесплодии. Центры по контролю и профилактике заболеваний, репродуктивному здоровью [Он-лайн информация].Доступно в Интернете по адресу http://www.cdc.gov/reproductivehealth/Infertility/. По состоянию на январь 2015 г.
Шифрен, Дж. И Гасс, М. (2014). Рекомендации Североамериканского общества менопаузы по клиническому уходу за женщинами среднего возраста. Менопауза . v21 (10): 1038-1062 [Он-лайн информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/832641. По состоянию на январь 2015 г.
Пушек, Э. и Вудард, Т. (обновлено 17 ноября 2014 г.). Бесплодие. Медицинские препараты и болезни [Он-лайн информация].Доступно в Интернете по адресу http://emedicine.medscape.com/article/274143-overview#showall. По состоянию на январь 2015 г.
(© 1995–2014). Anti Müllerian Hormone (AMH), Сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/89711. По состоянию на январь 2015 г.
Насколько сильно АМГ действительно меняется у нормальных женщин?
Антимюллеров гормон (АМГ) — это гормон яичников, экспрессирующийся в растущих фолликулах, которые были рекрутированы из пула примордиальных фолликулов, но еще не были выбраны для доминирования.Считается точным маркером овариального резерва, способным отражать размер фолликулярного пула яичников женщины репродуктивного возраста. По сравнению с другими гормональными биомаркерами, такими как сывороточный ФСГ, для AMH была предложена низкая вариабельность внутри- и межменструального цикла. В этом обзоре обобщены знания о вариабельности внутри субъектов, с особым вниманием к внутрицикловой вариабельности АМГ. Кроме того, будет рассмотрено влияние этнической принадлежности, индекса массы тела и курения на индивидуальную изменчивость AMH.Наконец, будут обсуждены изменения уровней АМГ в сыворотке при двух состояниях покоя яичников, а именно при использовании противозачаточных средств и при беременности. Настоящий обзор направлен на то, чтобы помочь исследователям и клиницистам интерпретировать значения и колебания АМГ в различных исследованиях и клинических сценариях.
1. Введение
Антимюллеров гормон (АМГ) секретируется в кровоток небольшими растущими фолликулами в яичнике, пока они не достигнут размера, при котором они могут быть выбраны для доминирования (6-8 мм) [1] .Поскольку когорта маленьких растущих фолликулов находится в равновесии с общим числом примордиальных фолликулов, уровни АМГ в сыворотке отражают пул фолликулов яичников [2]. Поэтому AMH считается точным маркером овариального резерва [3, 4]. Более того, уровни АМГ в разных менструальных циклах, а также в пределах одного менструального цикла различаются меньше по сравнению с другими биомаркерами активности яичников, такими как ФСГ, что имеет ряд очевидных клинических преимуществ [4–7]. Действительно, согласно различным исследованиям, измерение АМГ на случайной основе в течение менструального цикла связано с очень хорошей точностью при прогнозировании ответа яичников [8–10].
Однако в то время как в первых исследованиях сообщалось об очень низкой вариабельности в течение менструального цикла [11–14], ряд более поздних исследований [15–17] указывает на снижение циркулирующего АМГ в лютеиновой фазе, поэтому возникает вопрос, должен ли АМГ лучше измерять в фиксированный день менструального цикла, чтобы способствовать стандартизации и обеспечить лучшее перекрестное сравнение между отдельными оценками.
В этом обзоре мы пролили свет на частично противоречивую проблему вариабельности АМГ, с особым вниманием к внутрицикловой вариабельности АМГ, которая в последнее время широко обсуждалась.Кроме того, мы оцениваем влияние этнической принадлежности, ИМТ и курения на индивидуальную вариабельность АМГ. Наконец, мы обсудили изменения уровней АМГ в сыворотке крови при двух условиях подавления функции яичников, а именно при использовании противозачаточных средств и при беременности.
2. Межличностная изменчивость AMH
Говоря о гормональной стабильности, следует учитывать два различных типа вариабельности: индивидуальную и внутриличностную. Индивидуальная вариабельность АМГ относится к вариациям уровней АМГ у разных субъектов и, прежде всего, является вторичной по отношению к очень высокой вариабельности числа растущих фолликулов в группах женщин одного возраста [18–20].Высокая индивидуальная вариабельность АМГ неудивительна, учитывая широкую вариабельность овариального резерва у женщин. Как правило, высокая индивидуальная вариабельность является хорошей характеристикой гормона при использовании в качестве дискриминационного биомаркера в клинических условиях (рис. 1). Действительно, высокая индивидуальная вариабельность AMH делает его идеальным кандидатом в биомаркеры, с помощью которого можно различать пациентов для диагностических, прогностических и других клинических целей.
3. Влияние этнической принадлежности, ИМТ и курения на уровни АМГ
В одно- и многофакторном анализе у чернокожих [21, 22] и испаноязычных [21] женщин уровень АМГ в сыворотке крови на 25% ниже, чем у Кавказские женщины примерно того же возраста.Кроме того, неожиданно большое количество чернокожих женщин имеет неопределяемый уровень АМГ, несмотря на относительно молодой возраст и регулярные менструальные циклы, что указывает на потенциальное несоответствие между фактическим овариальным резервом и тем, на что указывают измерения АМГ в этой популяции (рис. 2). Совершенно очевидно, что срочно необходимы дополнительные исследования основных биологических явлений и последствий этого открытия. Однако это открытие указывает на то, что следует соблюдать осторожность при использовании референсных значений AMH для разных этнических групп.
Некоторые статьи, даже ограниченные небольшим числом пациентов, указали на отрицательную взаимосвязь между ИМТ и уровнями АМГ в сыворотке [23, 24]. Однако противоречивые результаты были получены другими [18, 25–28]. В недавнем крупном исследовании, проведенном среди здоровой женской популяции в целом, АМГ был отрицательно связан с ИМТ, но зависимость зависела от возраста [27]. Другими словами, у женщин с возрастом уровень АМГ снижался, а ИМТ увеличивался; следовательно, связь между АМГ и ИМТ была вторичной по отношению к более сильной связи двух переменных с возрастом.
Имеются явные доказательства того, что курение может напрямую ускорять истощение фолликулов яичников, тем самым снижая возраст наступления менопаузы [29, 30]. Более того, было показано, что курение изменяет метаболический путь некоторых гормонов, включая эстрадиол. Однако были получены противоречивые результаты о взаимосвязи между курением и AMH: некоторые авторы [31–33] сообщают о снижении уровней AMH у курильщиков по сравнению с некурящими, а другие [18, 27, 34–36] сообщают об аналогичных значениях в обеих группах женщин.В более позднем исследовании [27] были проанализированы уровни АМГ у 416 здоровых женщин, в том числе 99 курильщиков и 317 некурящих. Как показано на Рисунке 3, в любом возрасте распределение курильщиков было равномерным во всех квартилях распределения AMH (Рисунок 3). Другими словами, применительно к данному возрасту одинаковое количество курящих женщин имели соответственно высокий или низкий уровень АМГ. Соответственно, дебаты о влиянии курения на фолликулярный пул и уровни циркулирующего АМГ еще не урегулированы. В заключение, согласно опубликованным исследованиям, кажется, что вариабельность овариального резерва и, во-вторых, этническая принадлежность могут в значительной степени объяснить высокую степень межиндивидуальной вариабельности уровней АМГ.
4. Индивидуальная изменчивость AMH: долгосрочная, краткосрочная и ультракороткая
Внутрииндивидуальная изменчивость указывает на вариации уровней AMH у одного пациента и может быть вторичной по отношению к истинным биологическим вариациям уровней AMH в крови у женщин .
Мы предлагаем различать долгосрочную изменчивость, краткосрочную изменчивость и ультракороткую изменчивость. Первый относится к колебаниям в уровнях АМГ, которые происходят год за годом и указывают на снижение резерва яичников у одинокой женщины.Второй зависит от ежемесячной физиологической изменчивости функции яичников; следовательно, краткосрочная изменчивость может относиться к изменчивости межменструального цикла. Ультракороткая изменчивость указывает на изменчивость изо дня в день и относится к изменчивости внутрименструального цикла.
В недавнем проспективном продольном исследовании уровни АМГ в сыворотке крови измерялись у здоровых молодых девочек препубертатного возраста (от 6 до 13 лет) каждые 6 месяцев в течение 3 лет, а средний внутрииндивидуальный коэффициент вариации (CV) для АМГ составил 22 %.Это указывает на то, что циркулирующий АМГ показывает — в среднем — только незначительные колебания в течение ограниченного периода времени; таким образом, случайное измерение АМГ действительно может быть репрезентативным для данной девочки [37]. Долгосрочная изменчивость у взрослых женщин в основном изучалась в поперечных исследованиях, некоторые из которых включали до 10–15 тысяч пациентов [18, 27, 38–41]. В целом, исследования хорошо согласуются с тем, что АМГ снижается с возрастом по схеме, напоминающей экспоненциальный распад первичного фолликулярного пула [2, 42], который лучше всего описывается квадратным уравнением [38].
Вариабельность межменструального цикла была проанализирована в двух хорошо проведенных проспективных исследованиях [14, 43]. В обоих исследованиях был рассчитан аналогичный внутриклассовый коэффициент (ICC), который составил 0,89. ICC — это отношение индивидуальной изменчивости к общей изменчивости. Следовательно, чем выше ICC, тем ниже индивидуальная изменчивость. Оба исследования пришли к выводу, что 89% вариаций АМГ было связано с вариациями между участниками, в то время как только 11% вариабельности были вторичными по отношению к индивидуальным колебаниям уровней АМГ (рис. 4).Более того, недавнее проспективное исследование показало корреляцию 0,88 между измерениями АМГ, выполненными на 2 или 3 день цикла в двух последующих циклах у женщин с регулярными спонтанными циклами [44]. АМГ показал самую высокую корреляцию между циклами в пределах ряда оцениваемых гормонов, включая тестостерон, ФСГ, E2, ингибин B и ЛГ.
Крайне обсуждаемый вопрос касается того, значительно ли изменяется АМГ на протяжении менструального цикла. В нескольких исследованиях было высказано предположение, что уровни АМГ в сыворотке мало колеблются во время менструального цикла, как и следовало ожидать из свидетельств того, что АМГ не секретируется доминантным фолликулом или желтым телом [11–14] (рис. 5).АМГ является уникальным среди известных гормонов, продуцируемых антральными фолликулами, потому что на его секрецию, по-видимому, лишь незначительно влияют гонадотропины, и она резко снижается по мере того, как фолликулы достигают полной чувствительности к гонадотропинам. Как следствие, уровни АМГ во время фолликулярной фазы не отражают активность развивающегося большого доминантного фолликула месяца, и, наоборот, в любой временной точке менструального цикла уровни АМГ предоставляют информацию о количестве небольших антральных фолликулов, присутствующих в яичнике. которые доступны для циклического набора фолликулов.
Для изучения внутриличностной вариабельности АМГ Van Disseldorp et al. [14] рассчитали внутриличностное CV в результате повторного анализа ранее опубликованной статьи [11]. Авторы сообщили, что внутрииндивидуальная вариабельность АМГ составляла всего 13% и, что наиболее важно, при разделении пациентов на квинтили в соответствии с базовыми уровнями АМГ было показано, что внутрииндивидуальные колебания попадают в тот же квинтиль в 72% случаев и пересекают два квинтили только в 1% случаев [14].
Напротив, некоторые авторы отмечают значительные колебания в пределах одного менструального цикла [15–17].Совсем недавно проведенное исследование показало, что уровни АМГ в сыворотке крови в лютеиновой фазе значительно ниже, чем в фолликулярной, при этом характер вариаций аналогичен гипофизарному ФСГ, а внутрииндивидуальная вариабельность АМГ достигает 80% [17]. Однако исследование было основано на очень небольшой группе субъектов (), и у некоторых из них было всего пять образцов крови на протяжении всего менструального цикла. Более того, при анализе значений для одиноких пациентов предполагаемое снижение АМГ в лютеиновой фазе не было очевидным у 25% пациентов (Рисунок 6), поэтому возникают вопросы, может ли наблюдаемое снижение АМГ в лютеиновой фазе быть просто случайным, а не из-за действительно по биологической причине.
В другом проспективном исследовании с участием 20 женщин было показано, что уровни АМГ в сыворотке крови колеблются на протяжении менструального цикла [16]. В этом случае наблюдаемые колебания были абсолютно случайными в течение всего цикла и не были связаны с типичными характеристиками гонадотропинов или стероидов яичников. Более того, амплитуда была пропорциональна базальным уровням АМГ: у женщин с низким уровнем АМГ наблюдались лишь незначительные колебания, тогда как у женщин с высокими базальными уровнями АМГ колебания были относительно выше.Автор предположил, что паттерн AMH можно разделить на «паттерн старения яичников» и «паттерн более молодых яичников» [16]. Несмотря на хорошее качество исследования, в котором образцы крови отбирались у каждой женщины ежедневно на протяжении всего менструального цикла, статья Робертса [45] подверглась критике за отсутствие расчета внутриличностного коэффициента вариации, который считается оптимальным анализом на гормональную изменчивость. Тем не менее, в конечном итоге исследование Sowers et al. [16] четко и убедительно указывает на то, что уровни АМГ в сыворотке крови меняются на протяжении менструального цикла, что колебания могут иметь значение у женщин с высокими базальными уровнями, и, что наиболее важно, колебания распределены случайным образом в течение цикла.Случайные и нециклические колебания АМГ показывают, что измерение гормона в фиксированный день менструального цикла не даст никаких преимуществ случайной оценки, например, в любой день менструального цикла.
Чтобы проверить влияние возраста женщин на степень колебаний АМГ, недавнее исследование в третий раз повторно оценило данные, ранее описанные Hehenkamp et al. [11] и Ван Дисселдорп и др. [14]. Было обнаружено, что в группе из 44 женщин в возрасте от 25 до 46 лет абсолютная индивидуальная вариация АМГ (дельтаАМГ), то есть разница между максимальным и минимальным уровнем сыворотки крови в течение одного цикла, была значительно и отрицательно связана с возрастом.Другими словами, у молодых женщин колебания уровня АМГ были значительно выше, чем у женщин старшего возраста [28]. Можно сделать вывод, что у пациенток с низким овариальным резервом (обычно это женщины пожилого возраста) колебания АМГ имеют мало клинического значения, в то время как у молодых пациентов с обычно высоким овариальным резервом колебания АМГ действительно могут влиять на дискриминационную способность диагностических и прогностических тестов. соответственно [28].
Наблюдаемая вариабельность уровней АМГ может иметь ограничивающий эффект на основное текущее применение АМГ в качестве прогностического теста в практике ЭКО.АМГ широко используется для прогнозирования ответа яичников и индивидуализации лечения в соответствии с этим прогнозом [5, 9, 46, 47]. Если значения AMH пересекают пороговые значения, предложенные для категорий ответа яичников из-за истинной биологической изменчивости AMH, это может привести к неправильной классификации и ошибочному лечению пациентов. Следовательно, влияние документированной вариабельности АМГ необходимо протестировать в клинических условиях на типичной целевой популяции, проходящей клинически значимый сценарий прогностического тестирования.
Как подробно описано в нескольких обзорах и метанализе [5, 48–50], АМГ является лучшим гормональным маркером для прогнозирования ответа яичников при ЭКО. При использовании случайного измерения АМГ для проспективного прогнозирования ответа яичников на экзогенный ФСГ потенциально можно получить правильную категоризацию 75% пациенток по трем категориям: плохой, нормальный или гиперреагирующий [9]. Соответственно, хотя и не так стабильно, как считалось ранее, АМГ по-прежнему остается наиболее «надежным» гормоном яичников и лучшим гормональным предиктором ответа яичников на стимуляцию при ЭКО, с важным преимуществом возможности случайного измерения.
5. Уровни АМГ в сыворотке при покое яичников, вызванное приемом ОК и беременностью
Поскольку производство АМГ антральными фолликулами считалось в значительной степени независимым от гонадотропина, логическим следствием этого является подавление гипофиза, как это происходит с оральными контрацептивами (ОК) или физиологически во время беременности не должно быть связано с соответствующими изменениями уровня в сыворотке крови.
Был опубликован ряд исследований о влиянии ОК на уровни АМГ [24, 44, 51–57], и большинство доступных оценок не являются перспективными.К сожалению, очень немногочисленные проспективные исследования ограничили анализ несколькими месяцами наблюдения (от 1 до 4 месяцев) лечения ОК и, таким образом, потенциально и недостаточно информативны. Сообщалось, что использование ОК либо незначительно влияет на концентрацию АМГ [44, 51, 52, 54, 55], либо значительно снижает ее [53, 56–58].
В крупном перекрестном исследовании сравнивали 180 и 76 двадцатилетних пользователей ОК и тех, кто не употреблял ОК, соответственно, и было обнаружено, что длительное использование ОК было связано со значительным средним снижением уровня АМГ на 13% [53] . Недавно когортное исследование, основанное на 863 здоровых женщинах (228 пользователей ОК и 504 не употребляющих), показало, что уровни АМГ в сыворотке у пользователей ОК были на 29,8% ниже, чем у тех, кто не принимал ОК. Снижение АМГ было более выраженным с увеличением продолжительности гормональной контрацепции. Однако не было обнаружено зависимости между дозой этинилэстрадиола и влиянием на концентрацию АМГ в сыворотке крови [58].
В хорошо проведенном проспективном исследовании оценивались уровни AMH во время приема таблеток ОК у лиц, длительно принимавших ОК (), и через 2 месяца после прекращения приема ОК.Интересно отметить, что после прекращения приема ОК было обнаружено среднее увеличение уровней АМГ на 30% (от среднего 2,0 нг / мл во время ОК до среднего 2,6 нг / мл через два месяца после приема последней таблетки) [56].
Наконец, небольшое рандомизированное исследование недавно в значительной степени подтвердило эти результаты [57]. Исследуемая популяция состояла из 42 здоровых женщин, рандомизированных для использования в течение 9 недель ОК в форме пероральных таблеток (), трансдермального пластыря () или вагинального кольца (). После 9 недель использования противозачаточных средств уровень АМГ в сыворотке крови значительно снизился почти на 50% по сравнению с исходным уровнем во всех группах лечения (рис. 7) [57].
Это свидетельство свидетельствует о подавляющем эффекте гормональной контрацепции на уровень циркулирующего АМГ, по крайней мере, при рассмотрении возможности длительного использования. Таким образом, сывороточная концентрация АМГ может не сохранять свою точность в качестве предикторов овариального резерва у женщин, длительное время использующих гормональные контрацептивы.
Беременность — это физиологическое состояние, связанное с подавлением функции яичников из-за подавления высвобождения эндогенного гонадотропина. Согласно концепции, согласно которой АМГ отражает непрерывный ФСГ-независимый нециклический рост мелких фолликулов в яичнике, можно ожидать, что во время беременности не будет обнаружено значимого изменения его уровней.Действительно, в раннем небольшом поперечном исследовании сообщалось о неизменных уровнях АМГ на протяжении всей беременности [59]. Последующие исследования показали противоречивые результаты, некоторые из которых подтвердили этот вывод [60, 61], а другие описали снижение уровня АМГ во время беременности [62, 63]. Также сообщалось, что снижение АМГ во время беременности очевидно при использовании теста Beckman Coulter, но не теста DSL [63]. Однако в единственном доступном лонгитюдном исследовании () авторы обнаружили значительное снижение уровня АМГ во 2-м и 3-м триместрах по сравнению с 1-м триместром, а среднее снижение в конце беременности составило около 50% [64].Это исследование показало, что во время беременности наблюдается относительное покой яичников и сниженное созревание фолликулов с последующим уменьшением популяции фолликулов, секретирующих АМГ. В то же время, по крайней мере, часть наблюдаемого снижения уровня АМГ во время беременности также можно объяснить связанной с беременностью гемодилюцией и повышенным связыванием с белками плазмы.
6. Выводы
В заключение, помимо возрастного снижения АМГ, были зарегистрированы значительные колебания для ряда состояний, и это необходимо учитывать при интерпретации значений в клинической практике.
 08 – 8.9
08 – 8.9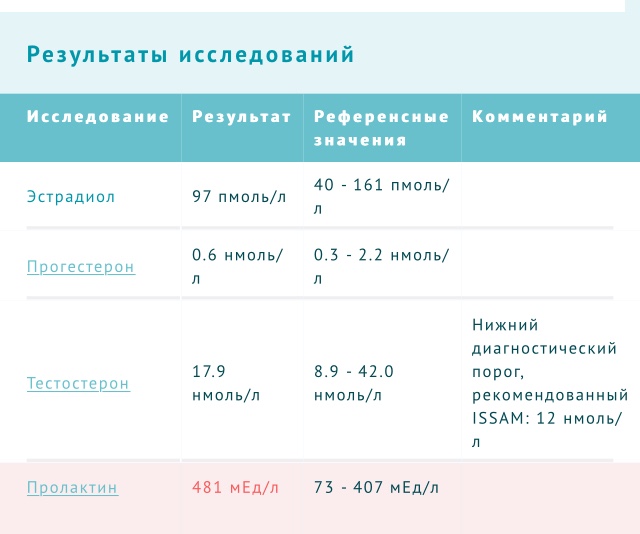 50
50 2
2