УЗИ, анализы в ФНКЦ ФМБА России
Овариальный резерв представляет собой запас яйцеклеток в организме. Он отвечает за репродуктивную функцию женщины. Определение овариального резерва выполняется с помощью комплекса диагностических процедур, что дает возможность оценить количество, характер, стадию зрелости яйцеклеток, предположить возможность успешного оплодотворения, а также выявить отклонения от нормы.
Для кого подходит программа
Программа предназначена для тех, кто в будущем планирует стать родителями, чтобы определить возможность успешного зачатия, а также для пар, которые уже столкнулись с репродуктивными проблемами.
Оценка овариального резерва в этом случае — один из этапов диагностического поиска проблемы.
Что входит в программу и как она проходит
Программа включает сдачу крови на ключевые половые гормоны, выполнение ультразвукового исследования, консультацию врача-гинеколога-эндокринолога.
Анализы на овариальный резерв
Сначала вы сдаёте лабораторные анализы. Взятие крови проводится натощак.
Цель исследования – определить содержание следующих гормонов в крови:
- Исследование уровня фолликулостимулирующего гормона (ФСГ). Этот гормон координирует работу всех половых желез, изменение его содержания незамедлительно отражается на состоянии половой системы.
- Исследование уровня лютеинизирующего гормона (ЛГ). Наравне с ФСГ, ЛГ необходим для оптимальной работы репродуктивной системы.
- Исследование антимюллерова гормона. Антимюллеров гормон вырабатывается фолликулами яичников, дает прямое представление об овариальном резерве.
- Исследование уровня общего эстрадиола. По содержанию этого гормона можно судить о работе яичников.
УЗИ овариального резерва
Далее выполняется УЗИ органов малого таза. Данный метод позволяет оценить состояние органов половой системы, врожденные особенности, патологические изменения, которые характерны для того или иного заболевания.
Данный метод позволяет оценить состояние органов половой системы, врожденные особенности, патологические изменения, которые характерны для того или иного заболевания.
С результатами исследований Вы отправляетесь на консультацию врача-гинеколога-эндокринолога. Врач проведет опрос, осмотр, оценит результаты лабораторных и инструментальных исследований.
В зависимости от цели сдачи анализов, врач даст общие рекомендации в случае хороших результатов, ответит на интересующие вопросы. В случае выявления отклонений по результатам анализов врач определит индивидуальный план лечения.Стоимость программы
7000 ₽

Анализ крови на антимюллеров гормон в Нижнем-Новгороде
Анализ крови на антимюллеров гормон
Антимюллеров гормон (АМГ) – является гормоном, относящимся к факторам роста, обеспечивающих правильное развитие тканей растущего организма. Изначально действие АМГ направленно на Мюллеров проток – эмбриональный предшественник матки, маточных труб и верхней трети влагалища.
Общая информация об исследовании
У мужчин:
В физиологических условиях АМГ продуцируется в яичках клетками Сертоли и отвечает за правильное и своевременное развитие органов мужской репродуктивной системы. В частности он отвечает за своевременное «заращение» Мюллеровых протоков, являющихся зачатками женского репродуктивного тракта, что способствует дальнейшему развитию половой системы по мужскому типу.
В дальнейшем вырабатывающиеся в мужском организме андрогены и вновь образующиеся сперматоциты тормозят выделение АМГ. Но при патологических состояниях сопровождающихся снижением выработки андрогенов, а так же при различных нарушениях сперматогенеза (процесс образования спермы), сдерживающее действие на АМГ прекращается, что приводит к его повышенному содержанию в крови, влекущее за собой в конечном итоге мужское бесплодие.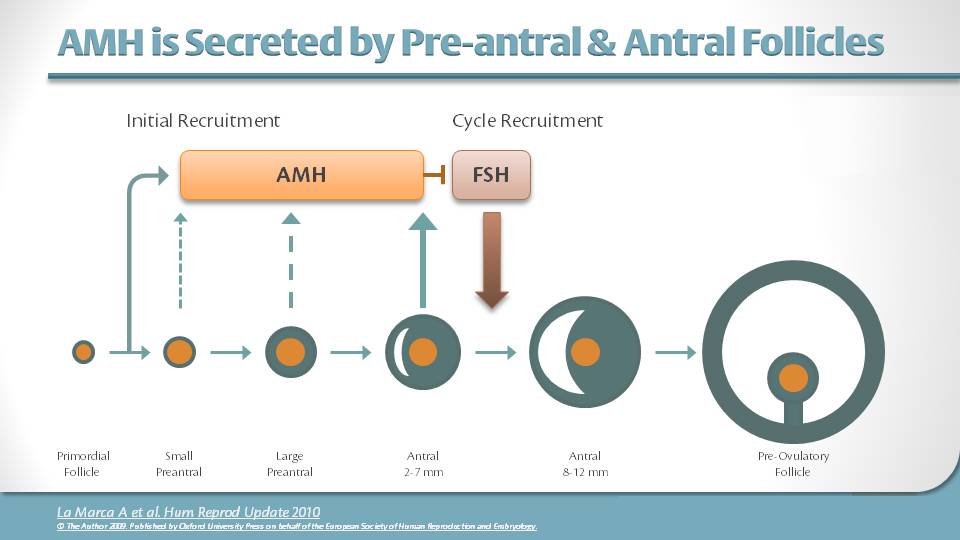
У женщин:
В норме АМГ продуцируется гранулезными клетками, которые находятся в яичниках. На протяжении всей жизни в нормальных условиях уровень АМГ в крови практически не меняется вплоть до менопаузы, когда его уровень резко снижается и в крови он практически не определяется. Как и в мужском организме, в организме женщины АМГ отвечает за нормальный рост и развитие различных клеточных структур и тканей, входящих в общий пул репродуктивной системы.
Концентрация гормона в крови четко коррелирует с количеством функционально активных фолликулов, то есть, чем меньше активных фолликулов, тем меньшее содержание АМГ мы наблюдаем в крови. Соответственно по уровню АМГ можно судить о репродуктивном резерве женского организма. Помимо этого повышение концентрации АМГ может свидетельствовать о развитии гранулематозной опухоли яичников, так как сама опухоль становится источников дополнительного высвобождения АМГ в кровь.
Показания для назначения данного анализа
- бесплодие неясного генеза;
- оценка овариального резерва женского организма;
- оценка пременопаузальных изменений у женщин;
- повышенные значения ФСГ, при отсутствии других причин этому;
- преждевременное или позднее половое развитие;
- при оценке эффективности антиандрогенной терапии;
- как дополнительный метод диагностики крипторхизма и анорхизма;
- тест-диагностика при подозрении на гранулёзоклеточный рак яичника.

Литература:
- Кишкун А.А. Клиническая лабораторная диагностика. — М.: ГЭОТАР — Медиа, 2015.
- Камышников В.С., Алехнович Л.И., Василиу-Светлицкая С.Г. Клиническая лабораторная диагностика. Методы и трактовка лабораторных исследований. — М.: МЕД-пресс-информ, 2015.
Антимюллеров гормон: норма у женщин
Гормоны играют важную роль в организме. Они участвуют в работе всех систем и органов человека. Особенно это касается репродуктивной функции женщины, ведь от гормонального фона зависит ее способность к зачатию. Во время планирования беременности или при наличии проблем с ее возникновением врач назначает специальный анализ. Исследование выявляет уровень определенных гормонов, среди которых присутствует АМГ (антимюллеров гормон). За что он отвечает и каковы его нормы у женщины, рассмотрим в статье.
Определение
Антимюллеров гормон (АМГ) — это вещество (белковая молекула), продуцируемое у женщин клетками яичников. Участвует в регулировке образования зрелых репродуктивных структур.
Участвует в регулировке образования зрелых репродуктивных структур.
Данный инкрет назван в честь ученого Мюллера, который установил, что развитие женских и мужских органов на раннем этапе эмбрионального периода протекает по схожим принципам. У зародышей имеется особая трубка, называемая мюллеровым протоком, которая у эмбриона сильного пола примерно на 10 неделе рассасывается. У девочек же из данного протока происходит формирование части влагалища и матки. С 32 недели развития плода начинает вырабатываться антимюллеровый гормон, концентрация которого остается низкой вплоть до полового созревания девочки. У мальчиков его уровень в крови значительно ниже.
Функции
Антимюллеров гормон участвует в формировании полноценных яйцеклеток. Это происходит следующим образом: на протяжении репродуктивного периода созревшие структуры в начале располагаются в неактивных фолликулах; во время менструального цикла некоторые из них начинают расти, что сопровождается созреванием яйцеклетки. При нормальной периодичности месячных выделений стимулирующее вещество (ФСГ), которое вырабатывается гипофизом, оказывает воздействие на один из таких фолликулов, превращая его в доминантный, в котором в дальнейшим происходит овуляция. После этого антимюллеров гормон блокирует действия ФСГ, чтобы неактивные фолликулы не перешли в фазу роста, что может привести к истощению яичников. Своевременное исследование этого активного вещества помогает предотвратить нежелательные проблемы в репродуктивной системе женщины.
При нормальной периодичности месячных выделений стимулирующее вещество (ФСГ), которое вырабатывается гипофизом, оказывает воздействие на один из таких фолликулов, превращая его в доминантный, в котором в дальнейшим происходит овуляция. После этого антимюллеров гормон блокирует действия ФСГ, чтобы неактивные фолликулы не перешли в фазу роста, что может привести к истощению яичников. Своевременное исследование этого активного вещества помогает предотвратить нежелательные проблемы в репродуктивной системе женщины.
Для чего измеряют АМГ
Уровень антимюллерова гормона может указывать на нарушения репродуктивной функции женщины. С помощью анализа крови можно выявить следующее состояния:
- Способность к естественному деторождению.
- Шансы на зачатие.
- Целесообразность применения процедуры ЭКО.
- Период наступления климакса (можно выявить за 4 года до наступления менопаузы).
- Причины позднего вступления в пубертатный период.
- Наличие рака или же поликистоза яичников.

- Причины повышения ФСГ.
Как и в любом методе диагностирования, перед сдачей анализа требуется определенная подготовка.
Подготовка к анализу
Для исследования антимюллерова гормона используется венозная кровь. Нужно помнить, что для получения наиболее точного результата необходимо соблюдать ряд правил. К ним относятся следующие рекомендации:
- Кровь сдается натощак. Последнее употребление еды должно быть не позднее, чем за 8 часов до анализа.
- За 2 дня исключают из рациона жирные, острые, соленые, копченые блюда.
- За двое суток до анализа необходимо ограничить физические нагрузки.
- Курение и алкоголь способны снизить результаты, поэтому следует воздержаться от этого.
- Обязательным условием является избежание стрессовых ситуаций, так как они могут значительно исказить полученный результат.
- Не сдавать кровь во время или сразу после перенесенных заболеваний.
Нормы
Нормы антимюллерова гормона у женщины несколько отличаются. Это зависит от того, какое количество яйцеклеток было заложено в организме изначально. По этой причине бывают ситуации, когда женщина в 40 лет беременеет без особых проблем, а у некоторых пациенток в 25 возникают проблемы с зачатием.
Это зависит от того, какое количество яйцеклеток было заложено в организме изначально. По этой причине бывают ситуации, когда женщина в 40 лет беременеет без особых проблем, а у некоторых пациенток в 25 возникают проблемы с зачатием.
В настоящее время выделяют усредненные нормы антимюллерова гормона у женщин. Это связано с отличием первоначального количества яйцеклеток у разных пациенток. Ниже представлена таблица антимюллерова гормона, в которой указаны нормальные значения. В ней можно увидеть, а каких пределах могут происходить колебания в уровне гормона.
АМГ принято считать в рамках нормы при следующих показателях:
| Возраст | Уровень АМГ, нг/мл |
| До начало полового созревания девочки (до 10 лет) | 1,8—3,4 |
| Начало пубертатного периода (10—20 лет) | 2,1—6,8 |
| 20—30 лет (расцвет репродуктивного возраста) | 13,2—7,3 |
| 35—38 лет | 6,8—2,6 |
| В 39-45 лет и в период предменопаузы | 2,6—1,1 |
| После 55 лет | 1,1—0 |
Вышеуказанная таблица указывает на различие нормы антимюллерова гормона по возрастам.
Динамика изменения уровня АМГ
На протяжении репродуктивного возраста уровень гормона в организме неодинаков. Наблюдается следующая закономерность:
- До начала пубертатного периода уровень АМГ достаточно низок.
- К 12—14 годам он начинает расти.
- Своего максимума антимюллеров гормон в организме женщины достигает в возрасте от 20 до 30 лет.
- После 30 и вплоть до наступления менопаузы содержание АМГ постепенно понижается.
- В период наступления менопаузы производство гормона сходит на нет.
Отличительной особенностью данного вещества является то, что на его уровень не влияют ни внешние факторы, ни изменения, происходящие в период беременности, ни прием лекарственных средств. Его содержание в организме женщины зависит только лишь от запасов полноценных яйцеклеток, находящихся в яичниках.
Повышенная концентрация гормона
Если антимюллеров гормон повышен, этому может способствовать ряд патологических состояний. Рассмотрим наиболее распространенные из них:
Рассмотрим наиболее распространенные из них:
- Поликистоз яичников.
- Задержка полового созревания. Повышение АМГ в этом случае может указывать на недоразвитость половой системы девочки.
- Опухоли яичников.
- Рак женских органов.
- Повышение инкрета бывает после перенесенных инфекционных заболеваний.
- Прием гормональных препаратов, которые назначают для нормализации овуляции, могут вызвать гиперстимуляцию яичников. Это не только может повлиять на увеличение уровня АМГ в крови женщины, но и спровоцировать нарушения нервной и дыхательной систем, а также поражения сердца и почек.
При повышенных значениях антимюллерова гормона требуется дополнительная диагностика.
Пониженные значения
Пониженные показатели АМГ могут быть следствием как некоторых заболеваний, так и других причин, которые не являются патологическими. Рассмотрим часто встречаемые состояния:
- Преждевременное половое развитие девочки. К моменту оптимального для зачатия времени запас яйцеклеток значительно уменьшен.

- Истощение яичников.
- Ожирение.
- Врожденные патологии яичников.
- Травмы женских органов.
- Предклимактерический период. Это естественная причина понижения уровня. Об этом свидетельствует таблица с нормами антимюллерова гормона у женщин по возрасту. Организм готовится к менопаузе, постепенно понижая содержание АМГ.
- Менопауза. Выработка активного вещества практически полностью приостанавливается, организм перестает быть способным к деторождению.
К непатологическим причинам понижения уровня атимюллерова гормона можно отнести курение, употребление алкоголя, стрессы. Рекомендуется исключить эти факторы и пересдать анализ в той же лаборатории, что и в первый раз.
Лечение
Так как АМГ не способен напрямую влиять на репродуктивную функцию женщины, при отклонениях от норм необходимо выявить причину данного состояния и исключить ее.
Важно знать, что при повышенных значениях нельзя принимать препараты для стимуляции яичников, так как это может спровоцировать усугубление патологии. Пониженные показатели в некоторых случаях возможно нормализовать с помощью гормональной терапии.
Пониженные показатели в некоторых случаях возможно нормализовать с помощью гормональной терапии.
Среди методов народной медицины в качестве поддерживающего средства может выступать маточное молочко, мед, морепродукты и препарат с витамином D3.
Исключение провоцирующего фактора зачастую помогает остановить процесс повышения или понижение уровня гормона в организме женщины.
АМГ и беременность
При определении вероятности естественного зачатия при отклонениях уровня антимюллерова гормона необходимо получить консультацию врача и пройти дополнительные диагностические мероприятия. По их итогам специалист рассматривает возможности, при которых может произойти наступление беременности.
При низком уровне АМГ имеются следующие варианты:
- Если указанный гормон понижен не критично, врач рассматривает вероятность восстановления его уровня с помощью гормональной терапии.
- Если при низких значениях АМГ фолликулостимулирующее вещество находится в пределах от 10 до 15 МЕ, то шансы на успешное зачатие и вынашивание ребенка довольно велики.

- Если же при пониженном уровне антимюллерова гормона значение ФСГ находится на высших отметках, шансы забеременеть очень низки.
В случаях с повышенным уровнем АМГ для его нормализации нужно выявить первопричину и пройти необходимое лечение.
При подготовке в искусственному оплодотворению анализ на уровень АМГ в крови является обязательным. По его итогам принимается решение о методе выполнения процедуры.
- Если уровень гормона слишком низок, может рекомендоваться использование донорских яйцеклеток.
- Если же при недостатке АМГ показатель ФСГ находится в пределах нормы, то шансы на успешное ЭКО значительно возрастают. Процедура будет проходит в два этапа, одним из которых является стимуляция яичников гормональными препаратами.
На протяжении всего времени подготовки к искусственному оплодотворению женщина находится под строгим контролем врача. Все назначения проводятся только после обследования пациентки.
Заключение
Так как гормоны играют очень значимую роль в организме женщины, необходимо систематически контролировать их уровень в организме. При имеющихся отклонениях от норм следует обратиться к врачу, который назначит дополнительную диагностику и эффективное для каждого конкретного случая лечение.
При имеющихся отклонениях от норм следует обратиться к врачу, который назначит дополнительную диагностику и эффективное для каждого конкретного случая лечение.
Антимюллеров гормон помогает указать на наличие проблемы в репродуктивной системе женщины, поэтому рекомендуется периодически проверять его уровень в организме. Особенно это касается пациенток, входящих в пубертатный или климактерический период.
Сдать анализ на Антимюллеров гормон в Пермь быстро и дешево в
Если вы в текущем или трех предшествующих годах оплачивали медицинские услуги в ООО «МедЛабЭкспресс»
за себя и/или ближайших родственников (супругу (а), родителей, детей (в том числе усыновленных и/или подопечных)
в возрасте до 18 лет), и при этом, в этих периодах у вас были доходы, с которых был удержан НДФЛ по ставке 13%,
то у вас есть право вернуть из бюджета 13% от суммы, оплаченной за наши медицинские услуги. Данный вычет предусмотрен пп.3 п.1 ст.
Для того чтобы заказать документы, подтверждающие ваше право на получение такого вычета, вам необходимо обратиться в любой удобный для вас пункт ООО «МедЛабЭкспресс» с заявлением, бланк которого прилагается. Бланк заявления также может предоставить регистратор пункта. Вы можете заполнить его заранее или прямо на пункте.
При этом, к заявлению желательно приложить копии документов, подтверждающие оплату (касс.чеки, бланки строгой отчетности).
Вы также можете направить файл заполненного заявления на электронную почту [email protected]
Внимательно заполняйте все необходимые поля заявления:
- налоговый период (год), в котором оплачены услуги
- Ф.И.О. (полностью), ИНН, дата рождения плательщика (получателя вычета), то есть лица, которое планирует обратиться в налоговую инспекцию за вычетом.
- Ф.И.О. (полностью), ИНН, дата рождения родственника, если услуги оплачивались за супругов, родителей, детей (до 18 лет).

В течение 3 (трех) рабочих дней после обращения вам будут подготовлены следующие документы:
- Справка об оплате медицинских услуг для представления в налоговые органы РФ по форме, установленной Приказом Минздрава РФ N 289, МНС РФ N БГ-3-04/256 от 25.07.2001
- Копия договора с указанием информации о лицензии на мед.деятельность
- Копия лицензии (при условии получения запроса на ее предоставление).
Внимание:
- Для получения готового пакета документов необходимо иметь при себе документ, удостоверяющий личность (паспорт гр.РФ)
- Справки не выдаются на услуги, оплаченные за прочих родственников, не перечисленных выше.
- О необходимости получения копии лицензии предупреждайте регистратора заранее
когда сдавать, на какой день цикла, что это такое, АМГ за что отвечает и как повысить
Антимюллеров гормон норма которого имеет большое значение, влияет на детородную функцию. Уровень данного вещества является важным критерием репродуктивного здоровья. Причем содержится данный гормон как в женском, так и в мужском организме, однако выполняет разные функции. Специфическая особенность заключается в том, что антимюллеровский гормон не контролируется гонадотропинами и не зависит от менструального цикла.
Причем содержится данный гормон как в женском, так и в мужском организме, однако выполняет разные функции. Специфическая особенность заключается в том, что антимюллеровский гормон не контролируется гонадотропинами и не зависит от менструального цикла.
Что это такое
Антимюллеров гормон (сокращенно АМГ гормон) вырабатывается у женщин и мужчин. В мужском организме этот вид гормонов оказывает воздействие на процесс формирования органов половой системы, активно выделяясь до момента полового созревания. У женщины данное вещество образуется в половых железах с момента рождения до периода менопаузы. Достижение АМГ гормоном определенного уровня говорит о том, что можно выносить и родить ребенка (то есть сформирована фертильность). Причем женский возраст не влияет на содержание данного вещества.
Главная особенность АМГ — это отсутствие регулирования головным мозгом. Он является местным гормоном, то есть зависимым от функционирования яичников. Следует отметить, что не все образующиеся в женском организме фолликулы формируют зрелую яйцеклетку. Именно антимюллеров гормон определяет, сколько фолликулов будут полноценными.
Именно антимюллеров гормон определяет, сколько фолликулов будут полноценными.
Когда необходимо сдавать анализ
Существует перечень показаний, определяющих кому следует сдавать анализ крови на АМГ. К ним относятся следующие моменты:
- необходимость обследования на причину нарушений на этапе полового созревания;
- необходимо подтвердить принадлежность к полу при наличии ложного гермафродизма;
- контроль развития раковой опухоли, когда возможно было затронуто функционирование половых желез женщины;
- выявление причины неудавшейся попытки экстракорпорального оплодотворения.
Анализ на антимюллеров гормон позволяет помимо прочего узнать овариальный резерв яичников и определить возможности женского организма для зачатия. Это дает врачу информацию о том, почему возникают проблемы с выполнением детородной функции.
Особенности сдачи анализа
Любая девушка может сдать анализ в клинической лаборатории. Для проведения исследования берется венозная кровь. Через два — три дня результаты будут готовы. Накануне проведения исследования необходимо соблюдать определенные рекомендации:
Через два — три дня результаты будут готовы. Накануне проведения исследования необходимо соблюдать определенные рекомендации:
- ограничить физическую активность;
- исключить стрессовый фактор;
- лучше отложить проведения анализа после недавно перенесенного простудного заболевания;
- исключить употребление алкогольных напитков, ограничить курение.
Часто у женщин возникает вопрос не только, что такое антимюллеров гормон, но и когда сдавать его лучше всего.
Наиболее верные результаты будут получены при исследовании крови на 2–5 день менструального цикла.
Это связано с тем, что в этот период уровень вещества не меняется. При проведении анализа мужчиной строгих ограничений по дням нет. Кровь нужно сдавать на голодный желудок утром. При необходимости разрешается выпить немного воды.
Нормальные величины
Исследование на АМГ позволяет определить количество фолликулов у женщины в определенный момент времени. Нормальные величины вещества находятся в пределах от 2,2 до 6,8 нг/мл. Эти показатели являются нормальными при достижении совершеннолетнего возраста. В некоторых случаях антимюллеров гормон повышен, иногда показатель бывает понижен. Конкретные причины данных явлений может выяснить только врач на основании дополнительных диагностических мероприятий.
Нормальные величины вещества находятся в пределах от 2,2 до 6,8 нг/мл. Эти показатели являются нормальными при достижении совершеннолетнего возраста. В некоторых случаях антимюллеров гормон повышен, иногда показатель бывает понижен. Конкретные причины данных явлений может выяснить только врач на основании дополнительных диагностических мероприятий.
Если показатели понижены
Не всегда гормональный фон женщины стабилен. Иногда антимюллеров гормон у женщин бывает ниже нормы. Это встречается при:
- наступлении климактерического периода, когда истощается овариальный резерв по естественным причинам;
- снижении овариального резерва, когда становится меньше фолликулов, способных выработать полноценную яйцеклетку;
- раннем половом созревании;
- наличии чрезмерной массы тела женщины на репродуктивном этапе.
Если показатели выше нормальных величин
В некоторых ситуациях уровень АМГ гормона может повышаться. Это бывает при наличии у женщины:
- поликистоза яичников, когда нарушено функционирование половых желез;
- нарушении нормального полового развития;
- появлении такого новообразования, как гранулезоклеточная опухоль.

Что делать
Норма антимюллерова гормона у женщин очень важна, так как определяет полноценную репродуктивную функцию. Поэтому его высокий или низкий уровень требует проведения определенных действий. Не следует паниковать. Ведь стресс оказывает негативное воздействие на нормальный гормональный фон женщины. Необходимо обратится к специалисту и строго выполнять назначения врача.
При выявлении низких показателей женщину волнует: можно ли повысить антимюллеров гормон? Методов, которые помогли бы естественным образом поднять концентрацию гормона нет. На помощь приходит экстракорпоральное оплодотворение.
Для ЭКО необходимо соблюдение определенных требований.
Врач может назначить прием некоторых добавок, соблюдение диеты. Эти мероприятия немного повышают содержание важного вещества, облегчая подготовку к процедуре искусственного зачатия. Помимо этого, для выполнения ЭКО необходимо проведение полного обследования женщины. Это позволит наиболее точно определить причину бесплодия.
Как влияет антимюллеров гормон на беременность
Низкая концентрация гормона снижает возможность женщины забеременеть и родить ребенка. Огромное значение играет то, насколько низко опустился или поднялся уровень. Поможет определиться в этом следующая таблица:
| Возможный уровень | Норма |
|---|---|
| Высокий уровень | более 6,8 нг/мл. |
| Нормальный уровень | 4,0-6,8 нг/мл. |
| Нормальный низкий | 2,2-4,0 нг/мл. |
| Низкий | 0,3-2,2 нг/мл. |
| Очень низкий | менее 0,3 нг/мл. |
Оптимальное количество для зачатия соответствует нормальному показателю. В некоторых случаях у женщин с низким уровнем гормона происходили выкидыши. Однако реальная медицинская практика показала, что концентрация гормона мало влияет на возможность самопроизвольного аборта.
Иногда женщины, узнав о нарушении детородной функции без рекомендаций врача пытаются самостоятельно назначить себе лекарственные препараты. Однако самолечением можно только нанести себе вред. Необходимо обратиться к специалисту, который и определит направление лечения. Ведь необходимо бороться не с последствиями, а искать причину изменения уровня гормона. Следует вовремя проходить профилактические осмотры. Даже незначительные отклонения показателей от нормы требуют дополнительного обследования.
Однако самолечением можно только нанести себе вред. Необходимо обратиться к специалисту, который и определит направление лечения. Ведь необходимо бороться не с последствиями, а искать причину изменения уровня гормона. Следует вовремя проходить профилактические осмотры. Даже незначительные отклонения показателей от нормы требуют дополнительного обследования.
Вопросы о том, что такое антимюллеров гормон и норма у женщин, должны интересовать любую представительницу прекрасного пола, решившую стать мамой. Ведь выполнение детородной функции и возможность иметь детей напрямую зависят от концентрации данного вещества. О том, как повысить антимюллеров гормон, может ответить только специалист на основании полученных данных после поведения дополнительной диагностики. Не следует опускать руки, если показатель будет понижен. Соблюдение врачебных рекомендаций, забота о своем здоровье поможет женщине насладиться счастьем материнства.
Вконтакте
Google+
Одноклассники
Антимюллеров гормон и беременность: как повысить АМГ с помощью иглоукалывания
Объясняем, почему вопросы про АМГ так актуальны и что нужно знать женщине об антимюллеровом гормоне.
Антимюллеров гормон (anti-Mullerian hormone ― АМГ, АМН) ― это особое вещество в организме, которое влияет на рост и формирование тканей, активно участвует в половой функции и оказывает влияние на репродуктивные способности.
АМГ ― маркер овариального резерва, показатель запаса яйцеклеток, их количества.
Тамара Хестанова
врач-рефлексотерапевт, диетолог, гирудотерапевт, основатель медицинского центра «СлимКлиник»
Антимюллеров гормон вырабатывается и в женском, и мужском организме.
Но его функции у мужчин и у женщин совершенно различны. Сегодня мы говорим о том, что такое АМГ в гинекологии у женщин и за что отвечает АМГ, но для общего понимания кратко отметим значение АМГ для обоих полов.
Роль АМГ для женщин и мужчин
До 5-6 недели плод имеет зачатки обоих полов: женский зачаток ― Мюллеров проток и мужской ― Вольфов проток. Синтез антимюллерова гормона у мальчиков начинается на 5-6 неделе и обеспечивает ингибирование женских зачатков и развитие мужских (отсюда и название ― антимюллеров гормон). Максимальные показатели этого гормона у мужчин отмечаются в пубертатном периоде. Если у плода мужского пола имеются мутации гена АМГ, в будущем это может быть маркером нарушений сперматогенеза и причиной мужского бесплодия.
Синтез антимюллерова гормона у мальчиков начинается на 5-6 неделе и обеспечивает ингибирование женских зачатков и развитие мужских (отсюда и название ― антимюллеров гормон). Максимальные показатели этого гормона у мужчин отмечаются в пубертатном периоде. Если у плода мужского пола имеются мутации гена АМГ, в будущем это может быть маркером нарушений сперматогенеза и причиной мужского бесплодия.
.
У плодов женского пола АМГ не синтезируется. Этим определяются половые различия при рождении: у новорождённых мальчиков уровень АМГ высокий, у девочек ― не определяется. Однако далее динамика диаметрально противоположна: к периоду полового созревания у мальчиков уровень антимюллерова гормона снижается, а у девочек начинает расти, достигая пика на этапе полового созревания, во время формирования фолликулов.
Гормон АМГ: что это такое у женщин
При рождении у каждой девочки есть определенный запас фолликулов, которые находятся в спящем режиме. Они еще очень маленькие, и их не видно на УЗИ ― это так называемые примордиальные фолликулы.
Далее в течение жизни женщина только тратит свои фолликулы. Новые не образуются. Антральные фолликулы (те, которые мы видим на УЗИ) вырастают из спящих. Какие из фолликулов станут доминантными, а какие погибнут, запрограммировано генетикой. Этот процесс неизменный и необратимый.
У каждой девочки есть определенный запас яйцеклеток. К концу 2 месяца внутриутробного развития у нее около 600 предшественников яйцеклеток. К моменту рождения в яичниках девочки 300-400 тыс. примордиальных фолликулов.
К 8 годам их остается 25 тыс.,
к 10 годам ― 20 тыс.,
к 14 годам ― 16 тыс.,
к 18 годам ― 5-7 тыс.
Тамара Хестанова
врач-рефлексотерапевт, диетолог, гирудотерапевт, основатель медицинского центра «СлимКлиник»
Особо важную роль антимюллеров гормон у женщин играет в репродуктивном возрасте. Уровень АМГ характеризует репродуктивную функцию: показывает, может ли женщина забеременеть. Этот гормон регулирует созревание фолликулов и формирование доминантного фолликула. Зачастую его нарушенное образование препятствует наступлению или развитию беременности.
Уровень АМГ характеризует репродуктивную функцию: показывает, может ли женщина забеременеть. Этот гормон регулирует созревание фолликулов и формирование доминантного фолликула. Зачастую его нарушенное образование препятствует наступлению или развитию беременности.
АМГ ― это оптимальный тест оценки овариального резерва и предиктор менопаузы. Это зеркало овариального/фолликулярного резерва женщины.
Тамара Хестанова
врач-рефлексотерапевт, диетолог, гирудотерапевт, основатель медицинского центра «СлимКлиник»
Роль АМГ при планировании беременности
При дефиците АМГ яйцеклетки не могут нормально вызревать. Сниженный уровень антимюллерова гормона у женщин приводит к нарушению репродуктивной функции и созревания фолликулов, а это ведет к бесплодию.
Сказать, какой уровень АМГ ― норма у женщин, можно лишь условно. В том смысле, что антимюллеров гормон не указывает точно на качество клеток ― цифра приблизительна. Но она позволяет провести аналогию со временем: сколько времени осталось у женщины для возможной беременности. Чем ниже АМГ, тем меньше времени у женщины есть для зачатия.
В том смысле, что антимюллеров гормон не указывает точно на качество клеток ― цифра приблизительна. Но она позволяет провести аналогию со временем: сколько времени осталось у женщины для возможной беременности. Чем ниже АМГ, тем меньше времени у женщины есть для зачатия.
Таблица с нормами АМГ по возрастам
У женщин репродуктивного возраста нормой считается уровень показателя АМГ в пределах 2-4 нг/мл. Это свидетельствует о хорошем овариальном резерве и нормальной работе яичников.
С возрастом, когда запас фолликулов уменьшается, уровень АМГ снижается и период в период менопаузы уже не определяется.
Приводим таблицу «АМГ норма у женщин по возрасту»:
| Возраст | Показатели нормы, нг/мл |
| Девочки до 9-10 | 1,8-3,4 |
| 10-20 (начало репродуктивного возраста) | 2,1-6,8 |
| 20-30 (максимальная фертильность) | 3,2-7,3 |
| 30-45-50 (начало снижения способности к зачатию) | 2,6-6,8 |
| 50-55 (подготовка к менопаузе) | 1,1-2,6 |
| Старше 55 (климакс) | До 1,1 |
| Постменопауза | АМГ в пределах нулевой отметки |
АМГ, норма у женщин ― таблица 1
Однако нужно иметь в виду, что как таковой нормы у АМГ для зачатия нет. Приведенные в таблице цифровые критерии ― это возможность приблизительно оценить, сколько времени у женщины до наступления менопаузы.
Приведенные в таблице цифровые критерии ― это возможность приблизительно оценить, сколько времени у женщины до наступления менопаузы.
К тому же по одному АМГ однозначный прогноз сделать нельзя. На способность зачатия влияет совокупность факторов. Так, у молодой женщины с низким АМГ шансы забеременеть выше, чем у женщины старше 40 лет с высоким АМГ.
Влияние низкого АМГ на беременность
При снижении показателя АМГ до 1 нг/мл можно говорить о плохой функциональности фолликулов и их недостаточном запасе, истощении половых желез. Низкий АМГ точно отражает состояние овариального резерва женщины, показывает количество яйцеклеток в яичниках, необходимых для зачатия и наступления беременности.
Можно ли забеременеть при низком АМГ? Вероятность самостоятельной беременности при очень низких показателях антимюллерова гормона мала, поскольку мала вероятность созревания полноценной, пригодной к оплодотворению яйцеклетки.
Если показатель АМГ ниже 1 нг/мл еще оставляет женщине шанс забеременеть, то при результатах менее 0,2 нг/мл шанс успешной самостоятельной беременности крайне низок. Вместе с тем, такие случаи есть.
Вместе с тем, такие случаи есть.
Нужно понимать, что планирование беременности при низком АМГ затягивать нельзя, так как с течением времени этот показатель будет только падать.
Влияние повышенного АМГ на беременность
Высоким считается показатель АМГ свыше 6,8 нг/мл. Причиной повышения уровня антимюллерова гормона у женщин могут стать синдромом поликистозных яичников, гормонотерапия, химио- или лучевая терапия, тяжелые инфекции, удаление яичников, длительный прием антидепрессантов, хронические заболевания, а также стресс, интенсивные спортивные нагрузки, лишний вес.
Повышенное содержание антимюллерового гормона сигналит о наличии патологий в организме женщины. Это может быть поликистоз яичников или, например, отсутствие овуляции, задержки в половом развитии. Увеличенная концентрация гормона AMH в период менопаузы часто свидетельствует о развитии опухоли.
Для женщин репродуктивного возраста повышение антимюллерова гормона чревато различными негативными последствиями. Многократное увеличение уровня АМГ способно привести к нарушению функции репродуктивных органов, наступлению бесплодия.
Многократное увеличение уровня АМГ способно привести к нарушению функции репродуктивных органов, наступлению бесплодия.
Вместе с тем нужно знать, что повышенные показатели антимюллерова гормона не всегда являются признаком наличия патологий в организме. Иногда временный выход за пределы нормы обусловлен психологическими потрясениями, стрессовыми состояниями, интенсивными физическими нагрузками.
На какой день цикла сдавать анализ на АМГ
Выработка антимюллерова гормона не зависит от дня менструального цикла. Даже при нормальном цикле уровень АМГ может быть низким. Поэтому анализ на АМГ можно сдавать в любой день менструального цикла. Однако чаще его назначают на 2-4 день, поскольку эти дни подходят для исследования других показателей, важных для зачатия, и удобно провести эти анализы на одном заборе крови.
К слову, АМГ не зависит и от приема комбинированных оральных контрацептивов (КОК) ― они не «экономят» овариальный резерв. Да, овуляция не происходит, но те фолликулы, которые должны были уйти, уйдут и с КОК. Многие этого не знают и полагают, что при приеме таблеток резерв сохраняется. Нет!
Да, овуляция не происходит, но те фолликулы, которые должны были уйти, уйдут и с КОК. Многие этого не знают и полагают, что при приеме таблеток резерв сохраняется. Нет!
Тамара Хестанова
врач-рефлексотерапевт, диетолог, гирудотерапевт, основатель медицинского центра «СлимКлиник»
Как правильно сдавать анализ на АМГ
Кровь на анализ АМГ нельзя сдавать во время ОРВИ и других инфекций. Подготовка к сдаче анализа включает следующие рекомендации:
- за несколько дней (минимум три) исключить физические нагрузки (в том числе спортивные тренировки), стрессовые ситуации и алкоголь;
- за двое суток прекратить прием гормонов, предварительно проконсультировавшись с врачом;
- за 12 часов до процедуры не есть;
- за три часа не пить и не курить.
АМГ с позиции китайской медицины
В Китайской медицине запас яйцеклеток, уровень антимюллерова гормона соответствует Цзин (Эссенции) Почек. В частности, Под-Небесной ― той, которую мы наследуем от родителей при зачатии. Есть мнение, что ее количество фиксировано, конечно, и возможности ее восполнить нет.
В частности, Под-Небесной ― той, которую мы наследуем от родителей при зачатии. Есть мнение, что ее количество фиксировано, конечно, и возможности ее восполнить нет.
Увеличение уровня АМГ в анализах пациенток медицинского центра «СлимКлиник» и наступившие беременности подтверждают возможность изменять Цзин Почек.
Количество Цзин Почек снижают:
- возраст,
- чрезмерные физические и эмоциональные нагрузки,
- психологическое напряжение и страх (женщина, у которой не получается забеременеть, испытывает чувство тревожности, боится остаться без детей, что приводит к еще большей потере Цзин ― получается замкнутый круг),
- недосып, засыпание позднее 23:00, бессонные ночи, ночная работа,
- ранняя половая жизнь у девочек,
- аборты,
- выкидыши,
- беременности,
- неадекватное, несбалансированное питание и жесткие диеты,
- стимуляции.

Мне хочется кричать, чтобы меня услышали! Женщины, борющиеся за рождение ребенка, крайне нуждаются в восполнении Ци, Цзин. Каждая стимуляция приводит к быстрому расходу Цзин. Это как израсходовать годовой запас за 1 месяц! А Цзин крайне необходима во время беременности для роста и развития плода. Если у мамы Цзин будет в недостатке, то ребенок родится с врожденным недостатком. Недостаток Цзин Почек может сочетаться с недостатком Крови, недостатком Инь Ци Почек, застоем Ци и или Крови, дисбалансом на Чудесных каналах.
Тамара Хестанова
врач-рефлексотерапевт, диетолог, гирудотерапевт, основатель медицинского центра «СлимКлиник»
Как поднять АМГ гормон у женщин
Итак, что делать с пониженным антимюллеровым гормоном? Можно ли повысить АМГ у женщин? Как поднять АМГ для самостоятельной беременности? Как поднять АМГ после 40 лет?
По возможности, исключите все факторы, снижающие количество Цзин Почек. Вы действительно можете повлиять на уровень стресса и тревожности в вашей жизни, на питание, на ваш вес! При необходимости стабилизировать нервную систему и уровень жизненной энергии в целом вам может иглоукалывании и индивидуально подобранные препараты из трав.
Вы действительно можете повлиять на уровень стресса и тревожности в вашей жизни, на питание, на ваш вес! При необходимости стабилизировать нервную систему и уровень жизненной энергии в целом вам может иглоукалывании и индивидуально подобранные препараты из трав.
И конечно, методы Китайской медицины дают ответ на главный вопрос ― как повысить АМГ. Иглоукалывание работает с АМГ через точки, восполняющие Цзин Почек. Покажем на примере нескольких точек.
Точки для повышения АМГ
CV 4 ГУАНЬ ЮАНЬ
Точка Переднесрединного меридиана, расположена на 3 цуня ниже пупка.
Одна из точек для воздействия на матку, особенно в сочетании с Чудесными каналами.
Показана для успокоения Духа при тревожности.
При лечении низкого уровня АМН эта точна важна, так как тонизирует Цзин (Эссенцию) Почек.
KID 3 Тай Си
Третья точка на канале Почек. Точка восполняющая все недостатки Почек ― Ян, Инь, Эссенцию. Именно это важно для увеличения уровня АМГ.
Точка восполняющая все недостатки Почек ― Ян, Инь, Эссенцию. Именно это важно для увеличения уровня АМГ.
Также можно использовать для успокоения разума и духа при бессоннице, беспокойных сновидениях, снижении памяти.
BL 23 и BL 52
Две точки канала Мочевого пузыря.
Тонизируют Почки, и в частности Эссенцию Почек.
Прогревайте, клейте на них перцовый пластырь. И конечно же, делайте массаж Гуа ша.
К этому списку можно добавить:
- KID 4 ― успокаивает разум;
- KID 6 ― тонизирует Инь Почек и Эссенцию;
- KID 13 ― тонизирует Эссенцию, в сочетании с Чудесными каналами;
- E 27 ― укрепляет эссенцию и рассасывает Сырость.
Как понизить АМГ для самостоятельной беременности
Повышенный уровень АМГ требует такого же комплексного подхода: через нормализацию жизненной энергии Ци можно влиять на Эссенцию Почек. Если высокий уровень АМГ у женщин вызван психологическими потрясениями, стрессами, активными тренировками, хроническими заболеваниями, важно в первую очередь нейтрализовать эту причину, чтобы борьба за снижение АМГ не превратилась в бег по кругу.
Если высокий уровень АМГ у женщин вызван психологическими потрясениями, стрессами, активными тренировками, хроническими заболеваниями, важно в первую очередь нейтрализовать эту причину, чтобы борьба за снижение АМГ не превратилась в бег по кругу.
Индивидуальный подход Китайской медицины позволяет понять, почему АМГ выше нормы у женщин, и добиться положительного результата.
Особенности работы с АМГ в медицинском центре «СлимКлиник»
Специалисты «СлимКлиник» используют для лечения репродуктивной системы и, в частности, нормализации уровня АМГ у женщин эффективные методы Китайской медицины. В частности, мы применяем древнюю методику WU YUN LIN QI (небесные стволы и земные ветви), которая излечивает человека в целом, а не отдельно взятую болезнь. В сочетании с другими методами Китайской медицины и строго индивидуальным подходом это дает стабильно отличные результаты.
Вместо того, чтобы временно маскировать симптомы, мы идем в корень проблемы, комплексно занимаясь восстановлением здоровья женщины и ее способностью к зачатию.
У нас много случаев повышения уровня АМГ при помощи иглоукалывания, наступление беременности и рождение здоровых детей.
Знаете ли Вы, что есть специальная точка, укалывание которой во время беременности на определенном сроке увеличивает шансы родить здорового и счастливого ребенка? Это точка KID 9 ЧЖУ БИН. Подробнее об иглоукалывании для беременных здесь.
Антимюллеров гормон — рассмотрим таблицу его нормы в организме у женщин. Повышение и понижение уровня.
В теле женщины с самого ее непосредственного рождения находится жизненно необходимый антимюллеров гормон, который на протяжении все ее жизни держит определенную планку своего количества, и только когда ее организм переходит в так называемый период менопаузы, его норма иссякает, запомните это.
Основным направлением его деятельности является контроль яйцеклеток.
Стоит отметить, что не у всех женщин можно определить количество гормона, но об этом и многом другом, вы узнаете с данной статьи. Также в статье вы сможете узнать отчего наблюдается понижение или повышение уровня гормона, и как с этим бороться. Итак, приступим к рассмотрению вопросов.
Также в статье вы сможете узнать отчего наблюдается понижение или повышение уровня гормона, и как с этим бороться. Итак, приступим к рассмотрению вопросов.
За что отвечает гормон у женщин?
Как мы уже говорили, что в женском организме он отвечает за количество яйцеклеток. К тому же он производит непосредственное воздействие на определенного рода факторы, которые отвечают за правильное развитие роста.
Так же немаловажным является то, что нормальную норму этих клеток невозможно определить именно в тот период, когда происходит непосредственное созревание подростка в половом отношении, а также во время его развития.
Его количество подвергается значительному увеличению именно в период репродуктивный, а именно в середине его развития.
Так же антимюллеров гормон практически не меняет своих показателей, в то время когда у женщины наблюдается менструальный цикл. Более того нормативные показатели гормона указывают на возможный спад фертильности у женщин, за достаточно долгий период как нерегулярными становятся месячные.
Именно по этой причине женщины, которые не могут долгое время забеременеть либо выносить малыша просто обязаны сдать соответствующие анализы на непосредственное определение количества этого гормона в организме.
Так как такого рода проблемы напрямую связаны со сбоем функциональности данных клеток, стоит иметь это в виду.
Норма Антимюллерового гормона у женщин
| Мкг/л | Нмоль/л | |
| Фаза фолликулиновая | 0.31-1.52 | 0.98-4.83 |
| Овуляция | 0.75-3.0 | 2.39-9.54 |
| Фаза лютеиновая | 5.1-27 | 16.2-85.9 |
| Постменопауза | 0.1-079 | 0.32-2.51 |
| Первый триместр беременности | 4.7-34 | 14.9-108.1 |
| Второй триместр беременности | 19. 4-50 4-50 | 61.7-159 |
| Третий триместр беременности | 5.45-160 | 17.3-508.8 |
Когда наблюдается повышение его уровня?
В первую очередь, на чем бы хотелось поставить акцент так это на том, что значительный рост уровня данного гормона именно у женщин является причиной таких заболеваний как поликистоз яичников и опухоль в области яичников, у которой нормонадотропный характер.
Более того такого рода отклонения качающиеся нормы гормона могут свидетельствовать о бесплодии, а именно эндокринном нормогонадотропном, либо задержке непосредственного развития полового характера.
Но стоит отметить, что повышение клеток не во всех случаях указывает непосредственно на наличие каких-то заболеваний. Так как во время сдачи анализов немаловажное значение имеет именно общее состояние человека.
Потому что если он в данный период находится в стрессовом состоянии, обладает какими-то заболеваниями острой формы, непосредственно перед манипуляцией подвергал свой организм физическим нагрузкам, то в таких случаях достаточно частым явлением являются ошибочные данные.
Стоит запомнить это и в случае чего иметь в виду этот вариант. Но всегда стоит учитывать, что только хороший специалист определит точный диагноз и скажет, что предпринимать дальше.
Как понизить гормон в организме женщины?
Несомненно когда женщина узнает о том что норма гормона не находится в необходимом количестве, а достаточно низка. То естественно она занимается поиском путей, посредством которых можно такого рода уровень повысить.
Но не стоит забывать, что данные клетки являются своеобразным показателем того в каком состоянии находятся фолликулы. Именно они и представляют собой «недуг», который необходимо вылечить.
Так как посредством максимальной нормализации их количества и качества достаточно просто поднять уровень гормона. Сделать это можно принимая витамин D3 и DHEA. Так же немаловажным является то, что степень нормализации клеток в летний период на восемнадцать процентов выше, нежели в зимнее время года.
Данная особенность наблюдается благодаря воздействию на организм витамина D3.
Посредством его непосредственного воздействия клетки (гранулезные) стремительно начинают процесс выработки антимюллерового гормона, тем самым провоцируя значительное повышение в крови его количества.
Причины понижения уровня
Если у человека в значительной степени пониженный показатель антимюллерового гормона, в таком случае это может говорить только о том, что в его организме происходит развитие заболеваний.
Это может быть спад резерва (овариального), менопауза, половое развитие, которое началось раньше срока, ожирение, в особенности в репродуктивном возрасте, недостаточность в области яичников.
Так же немаловажным является то, что такого рода сбои являются свидетельством того, что женщина не может иметь детей, то есть у нее бесплодие.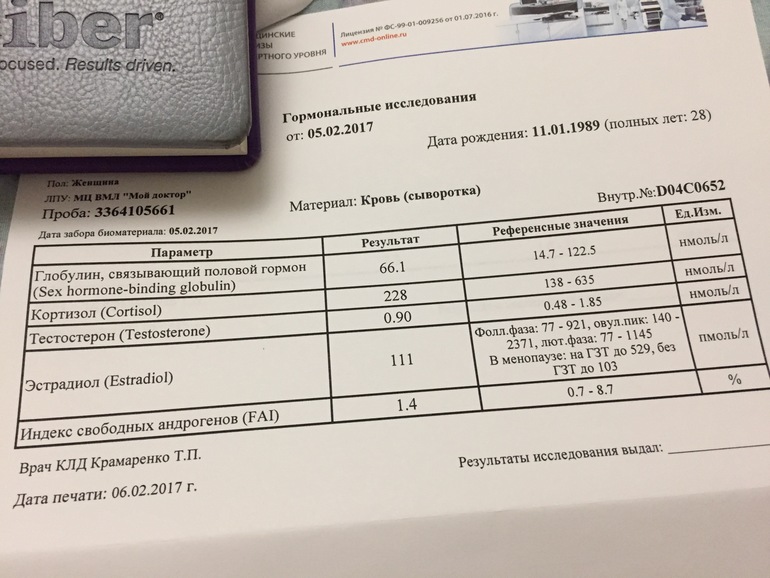
Но стоит отметить, что не нужно опускать руки и отчаиваться таким женщинам, так как низкий уровень данных клеток обязан быть в сочетании с высоким уровнем ФСГ. Поэтому если такого рода показатели отсутствуют, тогда проблема сбоя в другом.
Как повысить низкий показатель гормона?
Самое главное чтобы вы понимали, что непосредственный тест на определение количества гормона в вашей крови является попросту своеобразным маркером, который в полной степени показывает то, в каком состоянии находятся ваши яичники.
Учитывая тот факт, что степень клеток в жизненный период женщины происходят изменения количества гормонов исключительно вниз.
То даже низкие показатели АМГ вы должны воспринимать как своеобразное пробуждение непосредственно к тому или иному действию. Но, тем не менее, вы должны смириться с низким уровнем гормонов в вашем организме, так как на сегодняшний день медицина не может его повысить.
Как правильно подготовиться к сдаче анализов?
Стоит отметить, что такого рода анализ сдается исключительно на третий или пятый день менструального цикла.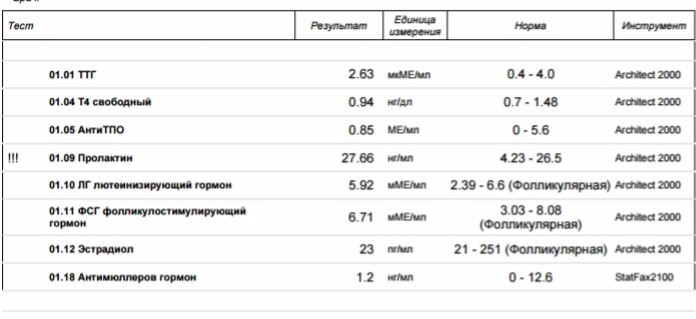 К тому же непосредственно перед манипуляцией, а именно за три часа нельзя принимать еду, а за два дня перед сдачей анализов прекратить применения гормонов тиреоидного и стероидного характера.
К тому же непосредственно перед манипуляцией, а именно за три часа нельзя принимать еду, а за два дня перед сдачей анализов прекратить применения гормонов тиреоидного и стероидного характера.
Более того нужно избегать нервозности, а непосредственно перед сдачей анализа не пить напитки содержащие алкоголь и не курить. К тому же не желательно в ближайшее время после вашей какой-либо болезни или существенных физических нагрузок проводить такого рода манипуляцию.
К качестве материала проверки у вас непосредственно из вены возьмут кровь, посредством которой определят степень гормона в организме.
Роль антимюллерова гормона в патофизиологии, диагностике и лечении синдрома поликистоза яичников: обзор женского населения [42, 43]. СПКЯ является диагнозом исключения и определяется по Роттердамской классификации (2003 г.) [44], требующим как минимум 2 из 3 следующих характеристик: (i) нарушение цикла, (ii) клиническая или биологическая гиперандрогения, (iii) избыток антральных фолликулов на УЗИ при ≥ 12 фолликулах от 2 до 9 мм в яичнике и/или объеме яичника ≥ 10 мл.
 Метаболические нарушения часто связаны с СПКЯ (до 50 %), включая повышенный уровень инсулинорезистентности, независимо от ожирения [45]. Таким образом, СПКЯ ложится значительным экономическим бременем на национальные системы здравоохранения [46]. СПКЯ почти наверняка является генетическим заболеванием, но точные причины гиперандрогении и ановуляции, которые не всегда связаны, все еще находятся в стадии изучения [47, 48].
Метаболические нарушения часто связаны с СПКЯ (до 50 %), включая повышенный уровень инсулинорезистентности, независимо от ожирения [45]. Таким образом, СПКЯ ложится значительным экономическим бременем на национальные системы здравоохранения [46]. СПКЯ почти наверняка является генетическим заболеванием, но точные причины гиперандрогении и ановуляции, которые не всегда связаны, все еще находятся в стадии изучения [47, 48].Патофизиология
СПКЯ характеризуется увеличением числа фолликулов на всех стадиях роста [49–51].Это увеличение особенно заметно в преантральных и малых антральных фолликулах, которые в первую очередь продуцируют АМГ [52, 53]. Таким образом, повышенный уровень АМГ в сыворотке, отражающий запас преантральных и малых антральных фолликулов, у женщин с СПКЯ в 2–4 раза выше, чем у здоровых женщин [54–57], и обнаруживается во всех популяциях с СПКЯ [21, 22]. ].
Первоначально считалось, что это увеличение уровня АМГ в сыворотке связано только с большим количеством преантральных и мелких антральных фолликулов. Однако было обнаружено, что продукция АМГ гранулезными клетками in vitro в 75 раз выше при ановуляторном СПКЯ и в 20 раз выше при нормоовуляторном СПКЯ, чем в нормальных яичниках [55].Это предполагает, что повышенные уровни АМГ в сыворотке при СПКЯ также будут отражать внутреннюю дисрегуляцию клеток гранулезы, в которую может быть вовлечен сам АМГ, поскольку также была продемонстрирована избыточная экспрессия рецептора АМГ II типа (AMHRII) [58, 59]. .
Однако было обнаружено, что продукция АМГ гранулезными клетками in vitro в 75 раз выше при ановуляторном СПКЯ и в 20 раз выше при нормоовуляторном СПКЯ, чем в нормальных яичниках [55].Это предполагает, что повышенные уровни АМГ в сыворотке при СПКЯ также будут отражать внутреннюю дисрегуляцию клеток гранулезы, в которую может быть вовлечен сам АМГ, поскольку также была продемонстрирована избыточная экспрессия рецептора АМГ II типа (AMHRII) [58, 59]. .
Причина такой высокой продукции АМГ в антральных фолликулах при поликистозном яичнике в настоящее время неизвестна, но есть данные, подтверждающие роль андрогенов. Действительно, сообщалось о положительной корреляции между уровнями андрогенов в сыворотке и уровнями АМГ, и избыточная продукция андрогенов может быть внутренним дефектом тека-клеток при СПКЯ [21, 22, 60-62].
Исследования продемонстрировали противоречивые результаты относительно регуляции АМГ гонадотропинами. По мнению некоторых авторов, гонадотропины (особенно ФСГ) ингибируют продукцию АМГ в сыворотке in vivo в нормальных яичниках [63, 64]. Пеллат и др. [55] также продемонстрировали снижение продукции АМГ в клетках гранулезы у женщин с СПКЯ, стимулированных ФСГ, но у «нормальных» женщин такого эффекта не обнаружено. Напротив, другие продемонстрировали стимулирующий эффект ФСГ на экспрессию АМГ в нормальных яичниках, а также при СПКЯ [65].Недавнее открытие, что Е2 ингибирует экспрессию АМГ, может привести к примирению этих разных результатов [66]: ФСГ может напрямую стимулировать АМГ в небольших антральных фолликулах, если они не экспрессируют ароматазу. Но в более крупных фолликулах за счет увеличения продукции Е2 с рекрутированием доминантного фолликула ФСГ будет оказывать косвенное ингибирующее действие на экспрессию АМГ посредством отрицательной обратной связи Е2 (рис. ).
Пеллат и др. [55] также продемонстрировали снижение продукции АМГ в клетках гранулезы у женщин с СПКЯ, стимулированных ФСГ, но у «нормальных» женщин такого эффекта не обнаружено. Напротив, другие продемонстрировали стимулирующий эффект ФСГ на экспрессию АМГ в нормальных яичниках, а также при СПКЯ [65].Недавнее открытие, что Е2 ингибирует экспрессию АМГ, может привести к примирению этих разных результатов [66]: ФСГ может напрямую стимулировать АМГ в небольших антральных фолликулах, если они не экспрессируют ароматазу. Но в более крупных фолликулах за счет увеличения продукции Е2 с рекрутированием доминантного фолликула ФСГ будет оказывать косвенное ингибирующее действие на экспрессию АМГ посредством отрицательной обратной связи Е2 (рис. ).
Схематическая диаграмма регуляции АМГ ФСГ и Е2 при РЖ малых и больших антральных фолликулов.Адаптировано из Grynberg M et al. JCEM, 2012 [65]. До стадии малого антрального отдела секреция АМГ стимулируется различными факторами, такими как ФСГ.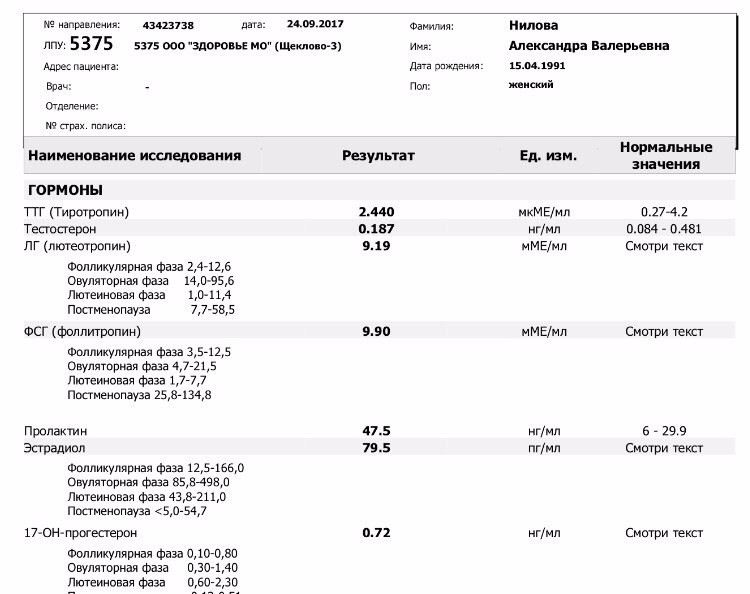 Продукция эстрадиола (Е2) под влиянием ФСГ нарушается ингибирующим действием АМГ на ароматазу. Когда концентрация эстрадиола достигает определенного порога в крупных антральных фолликулах, он способен полностью ингибировать экспрессию АМГ через ERβ, который преобладает в растущих фолликулах, тем самым преодолевая стимуляцию ФСГ. В крупных фолликулах при поликистозных яичниках отсутствие индуцированной ФСГ продукции Е2 и высокий уровень АМГ нарушают сдвиг формы АМГ в тон Е2, что приводит к остановке фолликулов
Продукция эстрадиола (Е2) под влиянием ФСГ нарушается ингибирующим действием АМГ на ароматазу. Когда концентрация эстрадиола достигает определенного порога в крупных антральных фолликулах, он способен полностью ингибировать экспрессию АМГ через ERβ, который преобладает в растущих фолликулах, тем самым преодолевая стимуляцию ФСГ. В крупных фолликулах при поликистозных яичниках отсутствие индуцированной ФСГ продукции Е2 и высокий уровень АМГ нарушают сдвиг формы АМГ в тон Е2, что приводит к остановке фолликулов
Также было продемонстрировано, что АМГ значительно снижает не только экспрессию рецептора ФСГ, а также экспрессию овариальной ароматазы [18].Это позволяет защитить маленькие фолликулы от преждевременной экспрессии ароматазы. Однако, когда этот защитный эффект превышает его физиологическую роль из-за избытка АМГ и/или из-за того, что он длится дольше, чем должен в более крупных фолликулах, это может привести к дефекту выбора доминантного фолликула, вызывая, таким образом, так называемую «анемию».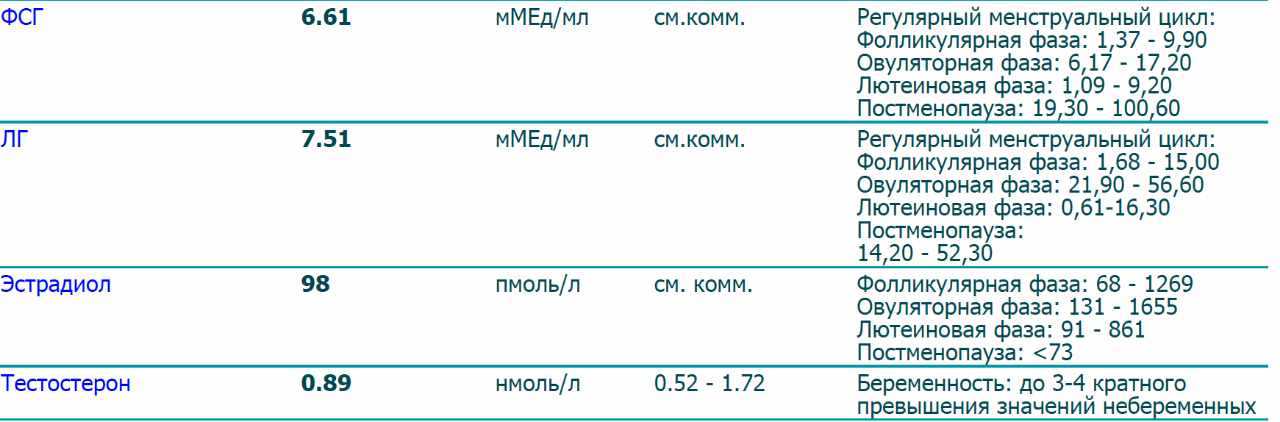 фолликулярная остановка». Тот факт, что АМГ ингибирует ФСГ-зависимые факторы, необходимые для доминирования фолликулов, придает большое значение высокой экспрессии АМГ в сыворотке крови, обнаруживаемой при СПКЯ, и делает АМГ предполагаемым центральным действующим лицом «фолликулярной остановки».В целом, клинические исследования показали взаимосвязь между высоким уровнем АМГ и нарушением овуляции [55]. Аналогичным образом ЛГ, по-видимому, стимулирует выработку АМГ гранулезными клетками у женщин с СПКЯ [55]. Приобретение рецепторов ЛГ клетками гранулезы происходит раньше при СПКЯ [67]. Кроме того, некоторые авторы продемонстрировали, что ЛГ снижает экспрессию AMHRII в лютеиновых клетках гранулезы в нормальных яичниках и у женщин с нормоовуляторным СПКЯ, тогда как у женщин с ановуляторным СПКЯ этого не происходит [65, 68].Помимо стимулирующего действия ЛГ на экспрессию АМГ, это отсутствие вызываемой ЛГ понижающей регуляции экспрессии AMHRII у женщин с ановуляторным СПКЯ может способствовать ановуляции.
фолликулярная остановка». Тот факт, что АМГ ингибирует ФСГ-зависимые факторы, необходимые для доминирования фолликулов, придает большое значение высокой экспрессии АМГ в сыворотке крови, обнаруживаемой при СПКЯ, и делает АМГ предполагаемым центральным действующим лицом «фолликулярной остановки».В целом, клинические исследования показали взаимосвязь между высоким уровнем АМГ и нарушением овуляции [55]. Аналогичным образом ЛГ, по-видимому, стимулирует выработку АМГ гранулезными клетками у женщин с СПКЯ [55]. Приобретение рецепторов ЛГ клетками гранулезы происходит раньше при СПКЯ [67]. Кроме того, некоторые авторы продемонстрировали, что ЛГ снижает экспрессию AMHRII в лютеиновых клетках гранулезы в нормальных яичниках и у женщин с нормоовуляторным СПКЯ, тогда как у женщин с ановуляторным СПКЯ этого не происходит [65, 68].Помимо стимулирующего действия ЛГ на экспрессию АМГ, это отсутствие вызываемой ЛГ понижающей регуляции экспрессии AMHRII у женщин с ановуляторным СПКЯ может способствовать ановуляции. Следовательно, преждевременное действие ЛГ может также способствовать «остановке фолликулов» через механизм, включающий систему АМГ [67, 69].
Следовательно, преждевременное действие ЛГ может также способствовать «остановке фолликулов» через механизм, включающий систему АМГ [67, 69].
Подводя итог, можно сказать, что при СПКЯ наблюдается множество аномалий фолликулогенеза: (i) повышенное количество мелких растущих фолликулов [50], (ii) ингибирование терминального фолликулярного роста [51], что приводит к отсутствию селекции доминантного фолликула, так называемая «остановка фолликула» [70] и (iii) дефект фолликулярного апоптоза, усугубляющий избыток растущих фолликулов [71, 72].
АМГ в сыворотке в диагностике СПКЯ
Учитывая большое значение АМГ в патофизиологии СПКЯ, АМГ в сыворотке можно считать «золотым стандартом» в диагностике СПКЯ. Несмотря на то, что АМГ в сыворотке теоретически был бы более точным, чем АФК, поскольку он также отражает избыток мелких фолликулов, невидимых на УЗИ [25, 6, 73] (рис. ), все же считается преждевременным делать этот диагностический переход.
Обоснование использования анализа АМГ в сыворотке в качестве зонда для PCOM. Dewailly, D., et al., Hum Reprod Update, 2014 [24]. a Все растущие фолликулы секретируют АМГ, но АМГ в сыворотке отражает только секрецию более крупных фолликулов, контактирующих с сосудистым руслом. Поскольку количество фолликулов на всех стадиях роста тесно связано друг с другом, считается, что АМГ в сыворотке отражает количество растущих фолликулов, а не количество примордиальных фолликулов, которые не секретируют АМГ. b При поликистозных яичниках увеличивается число всех растущих фолликулов, что приводит к заметному повышению уровня АМГ в сыворотке.АМГ можно рассматривать как более глубокий и чувствительный метод для определения избытка фолликулов, чем подсчет фолликулов с помощью УЗИ (УЗИ), поскольку он оценивает больше классов фолликулов (синие стрелки)
Dewailly, D., et al., Hum Reprod Update, 2014 [24]. a Все растущие фолликулы секретируют АМГ, но АМГ в сыворотке отражает только секрецию более крупных фолликулов, контактирующих с сосудистым руслом. Поскольку количество фолликулов на всех стадиях роста тесно связано друг с другом, считается, что АМГ в сыворотке отражает количество растущих фолликулов, а не количество примордиальных фолликулов, которые не секретируют АМГ. b При поликистозных яичниках увеличивается число всех растущих фолликулов, что приводит к заметному повышению уровня АМГ в сыворотке.АМГ можно рассматривать как более глубокий и чувствительный метод для определения избытка фолликулов, чем подсчет фолликулов с помощью УЗИ (УЗИ), поскольку он оценивает больше классов фолликулов (синие стрелки)
Надежная связь между АМГ и АФК привела некоторых авторов к сравните их эффективность в диагностике СПКЯ [74]. Однако результаты современной литературы неоднородны [11]. Часть этой неоднородности связана с отсутствием четко определенного населения. В частности, некоторые авторы использовали определение СПКЯ, установленное в 2003 г. на конференции в Роттердаме, с использованием 12 фолликулов диаметром 2–9 мм на яичник для морфологии поликистозных яичников (PCOM) [75].Это отсечение сильно зависит от ультразвукового оборудования и навыков оператора, как показано Dewailly et al. [76]. Таким образом, с последним поколением УЗИ порог изменился и в настоящее время составляет 19 или 25 [73, 77, 78]. Этот порог, вероятно, будет продолжать увеличиваться по мере разработки новых ультразвуковых технологий и оборудования. Кроме того, существуют критические вопросы, касающиеся того, какие популяции включаются в нормативную популяцию, а какие исключаются. Наконец, существуют технические проблемы, связанные с анализом АМГ в сыворотке, что приводит к дальнейшей неоднородности результатов в литературе.
В частности, некоторые авторы использовали определение СПКЯ, установленное в 2003 г. на конференции в Роттердаме, с использованием 12 фолликулов диаметром 2–9 мм на яичник для морфологии поликистозных яичников (PCOM) [75].Это отсечение сильно зависит от ультразвукового оборудования и навыков оператора, как показано Dewailly et al. [76]. Таким образом, с последним поколением УЗИ порог изменился и в настоящее время составляет 19 или 25 [73, 77, 78]. Этот порог, вероятно, будет продолжать увеличиваться по мере разработки новых ультразвуковых технологий и оборудования. Кроме того, существуют критические вопросы, касающиеся того, какие популяции включаются в нормативную популяцию, а какие исключаются. Наконец, существуют технические проблемы, связанные с анализом АМГ в сыворотке, что приводит к дальнейшей неоднородности результатов в литературе.
Таким образом, пока невозможно предложить согласованный и универсальный диагностический порог для АГМ в сыворотке для прогнозирования СПКЯ. Однако, по нашему опыту, пороговое значение 35 пмоль/л (4,9 нг/мл) с помощью иммуноферментного анализа AMH-EIA (набор для ИФА AMH/MIS) («Immunotech», ref A16507), предоставленного Beckman Coulter (Франция), имело хорошая специфичность (97 %) и лучшая чувствительность, чем AFC (92 %), чтобы отличить женщин с СПКЯ от нормальных женщин [73]. Этот результат был получен после исключения женщин с бессимптомным поликистозом яичников из контрольной группы с помощью кластерного анализа, математической процедуры, которая позволяет избежать использования предопределенных пороговых значений для АМГ и АФК.Этот подход был воспроизведен в другом месте [77]. Пигни и др. (неопубликованные данные) также сравнили пять анализов АМГ в сыворотке (как описано выше) для диагностики СПКЯ. Они предложили для ручных анализов ELISA более высокое пороговое значение на уровне 5,6 нг/мл (40 пмоль/л) в качестве биологических критериев, указывающих на PCOM, что соответствует 95 процентилю «чистых» контролей.
Однако, по нашему опыту, пороговое значение 35 пмоль/л (4,9 нг/мл) с помощью иммуноферментного анализа AMH-EIA (набор для ИФА AMH/MIS) («Immunotech», ref A16507), предоставленного Beckman Coulter (Франция), имело хорошая специфичность (97 %) и лучшая чувствительность, чем AFC (92 %), чтобы отличить женщин с СПКЯ от нормальных женщин [73]. Этот результат был получен после исключения женщин с бессимптомным поликистозом яичников из контрольной группы с помощью кластерного анализа, математической процедуры, которая позволяет избежать использования предопределенных пороговых значений для АМГ и АФК.Этот подход был воспроизведен в другом месте [77]. Пигни и др. (неопубликованные данные) также сравнили пять анализов АМГ в сыворотке (как описано выше) для диагностики СПКЯ. Они предложили для ручных анализов ELISA более высокое пороговое значение на уровне 5,6 нг/мл (40 пмоль/л) в качестве биологических критериев, указывающих на PCOM, что соответствует 95 процентилю «чистых» контролей. Они также предложили пороговое значение 4,2 нг/мл (30 пмоль/л) для автоматических анализов (неопубликованные данные). В случае подтверждения с помощью новых автоматизированных анализов АМГ в сыворотке или сверхчувствительного анализа высокий уровень АМГ в сыворотке может стать надежным и точным маркером PCOM и, в конечном итоге, заменить AFC, который также вызывает большие споры в литературе.Поскольку «повышенный АМГ в сыворотке» не относится к морфологии яичников, аббревиатура «PCOM» не подходит, и поэтому мы предложили термин «PCO-подобная аномалия» (т.е. PCOM и/или повышенный АМГ в сыворотке) в качестве третьего признака. пункт Роттердамской классификации, а не «PCOM» [79, 74].
Они также предложили пороговое значение 4,2 нг/мл (30 пмоль/л) для автоматических анализов (неопубликованные данные). В случае подтверждения с помощью новых автоматизированных анализов АМГ в сыворотке или сверхчувствительного анализа высокий уровень АМГ в сыворотке может стать надежным и точным маркером PCOM и, в конечном итоге, заменить AFC, который также вызывает большие споры в литературе.Поскольку «повышенный АМГ в сыворотке» не относится к морфологии яичников, аббревиатура «PCOM» не подходит, и поэтому мы предложили термин «PCO-подобная аномалия» (т.е. PCOM и/или повышенный АМГ в сыворотке) в качестве третьего признака. пункт Роттердамской классификации, а не «PCOM» [79, 74].
Уровень АМГ в сыворотке также коррелирует с тяжестью симптомов СПКЯ [68] и выше при наличии гиперандрогении [62, 80] или олигоановуляции [21, 55, 81]. С помощью анализа основных компонентов было показано, что высокий уровень АМГ в сыворотке крови может рассматриваться как маркер гиперандрогении, а также может использоваться в качестве замены этого пункта в Роттердамской классификации [82].
Это позволит согласовать различные классификации, доступные в настоящее время для СПКЯ, поскольку некоторые из них требуют гиперандрогении в качестве необходимого критерия [56]. Таким образом, мы предлагаем следующую стратегию: для диагностики СПКЯ следует сначала искать гиперандрогению и олигоановуляцию после исключения всех альтернативных диагнозов. Если один из них отсутствует, вместо него можно использовать высокий уровень AFC и/или AMH.
У подростков и молодых женщин с СПКЯ иногда трудно оценить яичники на УЗИ.Также бывает сложно оценить долю физиологических и патологических, касающихся акне и нарушений цикла. Таким образом, анализ сывороточного АМГ является реальной альтернативой, рекомендованной Американской ассоциацией клинических эндокринологов [83]. Подростки с СПКЯ имеют более высокие уровни АМГ в сыворотке с порогом, установленным на уровне 30 пмоль/л [84], что находится в диапазоне значений, найденных в литературе для пожилых женщин с СПКЯ [85, 86].
Однако следует отметить, что пороговые значения для избыточной AFC или высокого уровня АМГ в сыворотке должны быть пересмотрены и утверждены во всем мире, поскольку последние технические разработки в области УЗИ и анализов могут привести к их модификации. Тем временем рекомендуется, чтобы каждый центр устанавливал свои собственные пороговые значения.
Тем временем рекомендуется, чтобы каждый центр устанавливал свои собственные пороговые значения.
Уровень антимюллерова гормона в сыворотке здоровых женщин: номограмма в период от младенчества до взрослой жизни | Журнал клинической эндокринологии и метаболизма
Контекст:
Антимюллеровский гормон (АМГ) является точным маркером овариального резерва. Однако достаточно большие наборы нормативных данных от младенчества до конца репродуктивной жизни немногочисленны.
Цель:
Это исследование представляло собой оценку уровня АМГ в сыворотке здоровых женщин.
Субъекты:
У 804 здоровых женщин в возрасте от младенчества до конца репродуктивного периода уровни АМГ в сыворотке измеряли с помощью твердофазного иммунометрического анализа. У всех взрослых были регулярные менструальные циклы. У большинства была доказана фертильность, и ни один из них не использовал оральные контрацептивы до включения в исследование.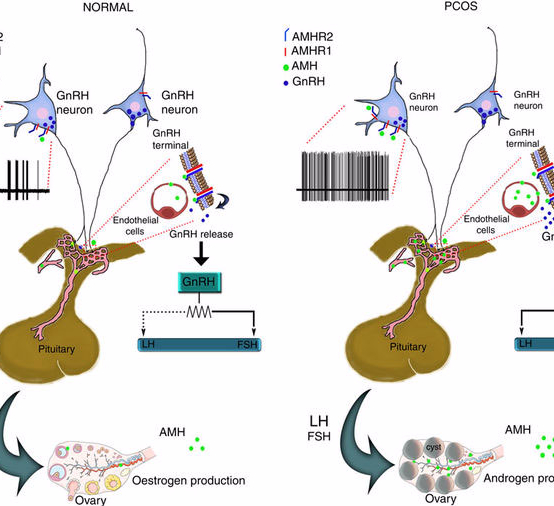
Результаты:
В общей когорте АМГ обратно коррелировал с возрастом ( r = -0,24; P < 0,001). Возраст, в котором было достигнуто максимальное значение АМГ, был в 15 лет.8 лет. У девочек моложе 15,8 лет сывороточный АМГ и возраст положительно коррелировали ( r = +0,18; P = 0,007). После этого уровни АМГ оставались стабильными ( r = -0,33; P = 0,66), тогда как с 25,0 лет и далее наблюдается обратная корреляция между АМГ и возрастом ( r = -0,47; P <0,001). наблюдалось. В любом возрасте наблюдались значительные межиндивидуальные различия в уровнях АМГ в сыворотке.
Заключение:
В младенчестве уровень АМГ повышается, тогда как в подростковом возрасте наблюдается плато до 25 лет.Начиная с 25-летнего возраста уровни АМГ в сыворотке обратно коррелируют с возрастом, что означает, что АМГ применим в качестве маркера овариального резерва только у женщин в возрасте 25 лет и старше. Наша номограмма может облегчить консультирование женщин по вопросам их репродуктивного потенциала.
Сывороточный антимюллеров гормон (АМГ) вырабатывается исключительно в яичниках человека гранулезными клетками (1). Экспрессия АМГ начинается в первичных фолликулах, как только начинается рекрутирование из пула первичных фолликулов, до ранней антральной стадии, во время которой экспрессия наиболее сильна (1–3).Экспрессия прекращается в фолликулах диаметром от 8 до 10 мм (1). На основании этого паттерна экспрессии было высказано предположение, что АМГ в сыворотке отражает количество рано растущих фолликулов (1). Действительно, у мышей уровни АМГ в сыворотке сильно коррелировали с количеством мелких растущих фолликулов и, что более важно, с количеством примордиальных фолликулов (4). Хотя непосредственная оценка пула примордиальных фолликулов у женщин затруднена, одно исследование с использованием овариэктомии по доброкачественным гинекологическим показаниям подтвердило корреляцию между АМГ в сыворотке и числом примордиальных фолликулов у женщин (5).Кроме того, несколько клинических исследований подтвердили сильную корреляцию между АМГ в сыворотке и количеством антральных фолликулов (АФК) (6–8). АМГ в сыворотке отражает когорту небольших растущих фолликулов и, следовательно, представляет собой показатель размера пула примордиальных фолликулов (6). Кроме того, было показано, что АМГ можно использовать в качестве маркера сниженного овариального резерва (6, 8, 9). Как и в случае с AFC, было показано, что АМГ является лучшим предиктором плохого ответа на контролируемую гиперстимуляцию яичников, чем возраст, сывороточный ФСГ или концентрация ингибина B в сыворотке (10–12).
АМГ в сыворотке отражает когорту небольших растущих фолликулов и, следовательно, представляет собой показатель размера пула примордиальных фолликулов (6). Кроме того, было показано, что АМГ можно использовать в качестве маркера сниженного овариального резерва (6, 8, 9). Как и в случае с AFC, было показано, что АМГ является лучшим предиктором плохого ответа на контролируемую гиперстимуляцию яичников, чем возраст, сывороточный ФСГ или концентрация ингибина B в сыворотке (10–12).
Помимо того, что он является маркером овариального резерва, АМГ также был описан как маркер избыточного роста фолликулов при нормогонадотропном нормоэстрогенном ановуляторном бесплодии и синдроме поликистозных яичников (СПКЯ). По сравнению с женщинами с регулярными менструальными циклами у женщин с СПКЯ наблюдались в 2–3 раза более высокие уровни АМГ (13, 14). Хотя АМГ в сыворотке используется в качестве маркера функции яичников в клинической практике, данных о диапазоне уровней АМГ в нормальной популяции недостаточно, и, таким образом, информация о пороговых уровнях нормального диапазона все еще отсутствует. В последнее время несколько исследований были направлены на восполнение этого пробела в знаниях (5, 12, 15–20). Несмотря на то, что были изучены большие когорты, подавляющее большинство женщин, включенных в эти исследования, были набраны в клиниках по лечению бесплодия (12, 15, 17, 18, 20) и, следовательно, могут не представлять женщин с нормоовуляцией. Настоящее исследование уникально тем, что в одной лаборатории измеряются уровни АМГ в сыворотке у большой когорты здоровых женщин, начиная с младенчества и до конца репродуктивного периода. Кроме того, большинство описанных женщин репродуктивного возраста оказались фертильными.
В последнее время несколько исследований были направлены на восполнение этого пробела в знаниях (5, 12, 15–20). Несмотря на то, что были изучены большие когорты, подавляющее большинство женщин, включенных в эти исследования, были набраны в клиниках по лечению бесплодия (12, 15, 17, 18, 20) и, следовательно, могут не представлять женщин с нормоовуляцией. Настоящее исследование уникально тем, что в одной лаборатории измеряются уровни АМГ в сыворотке у большой когорты здоровых женщин, начиная с младенчества и до конца репродуктивного периода. Кроме того, большинство описанных женщин репродуктивного возраста оказались фертильными.
Материалы и методы
Субъекты
Было включено здоровых детей, подростков и взрослых женщин. Большинство испытуемых участвовали в более ранних исследованиях в качестве здоровых контрольных субъектов. Для получения подробной информации о стратегии набора и исследуемых популяциях мы ссылаемся на оригинальные статьи (6, 8, 21–25). Все исследования были предварительно одобрены различными местными советами по этике. Все субъекты дали письменное информированное согласие.Здоровых девочек в возрасте до 18 лет набирали в местные начальные и средние школы или в Софийскую детскую больницу перед малой операцией. Взрослые (в возрасте 18 лет и старше) имели регулярные менструальные циклы от 25 до 35 дней или были признаны фертильными. Взрослые не принимали никаких гормонов или оральных контрацептивов в течение последних 3 месяцев до участия. Женщины с доказанной фертильностью родили как минимум на 6 месяцев раньше (24). Сыворотку отбирали случайным образом в течение менструального цикла. У тех взрослых женщин, которые проходили скрининг в раннюю фолликулярную фазу, также измеряли сывороточный ФСГ.У взрослых трансвагинальное УЗИ проводилось на 3, 4 или 5 цикле для оценки АФК.
Все исследования были предварительно одобрены различными местными советами по этике. Все субъекты дали письменное информированное согласие.Здоровых девочек в возрасте до 18 лет набирали в местные начальные и средние школы или в Софийскую детскую больницу перед малой операцией. Взрослые (в возрасте 18 лет и старше) имели регулярные менструальные циклы от 25 до 35 дней или были признаны фертильными. Взрослые не принимали никаких гормонов или оральных контрацептивов в течение последних 3 месяцев до участия. Женщины с доказанной фертильностью родили как минимум на 6 месяцев раньше (24). Сыворотку отбирали случайным образом в течение менструального цикла. У тех взрослых женщин, которые проходили скрининг в раннюю фолликулярную фазу, также измеряли сывороточный ФСГ.У взрослых трансвагинальное УЗИ проводилось на 3, 4 или 5 цикле для оценки АФК.
Анализы на гормоны
Все измерения сыворотки проводились в диагностической эндокринной лаборатории в Медицинском центре Эразма (Роттердам, Нидерланды) (F. H.d.J., Y.B.d.R.). Все образцы хранились при температуре -20°C до анализа. Иммунореактивность АМГ в образцах сыворотки оставалась стабильной после повторных циклов замораживания-оттаивания (4). В более старших когортах (6, 8, 25) АМГ измеряли с помощью ИФА (Immunotech-Coulter, Марсель, Франция) (6) и собственного ИФА (коммерчески доступного как GenII Beckman Coulter, Beckman Coulter, Inc., Webster, TX) использовали у испытуемых, у которых сыворотка была взята совсем недавно (4). Стандартная кривая анализа Immunotech-Coulter находилась в диапазоне от 0,7 до 175 пмоль/л (0,1–24,5 нг/мл). Диапазон стандартов АМГ, использованных во внутреннем анализе, составлял от 0,037 до 5 нг/мл. Чтобы построить номограмму нормальных уровней АМГ, значения, полученные в обоих анализах, должны быть сопоставимы. Следовательно, значения, полученные с помощью анализа Immunotech, были скорректированы с коэффициентом 1,564, чтобы быть сопоставимыми со значениями, измеренными с помощью используемого в настоящее время ELISA.
H.d.J., Y.B.d.R.). Все образцы хранились при температуре -20°C до анализа. Иммунореактивность АМГ в образцах сыворотки оставалась стабильной после повторных циклов замораживания-оттаивания (4). В более старших когортах (6, 8, 25) АМГ измеряли с помощью ИФА (Immunotech-Coulter, Марсель, Франция) (6) и собственного ИФА (коммерчески доступного как GenII Beckman Coulter, Beckman Coulter, Inc., Webster, TX) использовали у испытуемых, у которых сыворотка была взята совсем недавно (4). Стандартная кривая анализа Immunotech-Coulter находилась в диапазоне от 0,7 до 175 пмоль/л (0,1–24,5 нг/мл). Диапазон стандартов АМГ, использованных во внутреннем анализе, составлял от 0,037 до 5 нг/мл. Чтобы построить номограмму нормальных уровней АМГ, значения, полученные в обоих анализах, должны быть сопоставимы. Следовательно, значения, полученные с помощью анализа Immunotech, были скорректированы с коэффициентом 1,564, чтобы быть сопоставимыми со значениями, измеренными с помощью используемого в настоящее время ELISA. Внутри- и межтестовые коэффициенты вариации в анализе Immunotech-Coulter были менее 5% и 8% и менее 5% и менее 10% в собственном ИФА. Предел обнаружения используемого в настоящее время ELISA, определяемый как среднее значение оптической плотности пустых повторов +2 sd, составлял 6,3 пг/мл. Для анализа уровни АМГ в сыворотке ниже 0,1 мкг/л оценивались как 0,0 мкг/л. ФСГ измеряли с помощью иммунометрического анализа на основе хемолюминесценции (Immulite 2000; Siemens, Лос-Анджелес, Калифорния) с коэффициентами дисперсии внутри и между анализами менее 3% и 8%.
Внутри- и межтестовые коэффициенты вариации в анализе Immunotech-Coulter были менее 5% и 8% и менее 5% и менее 10% в собственном ИФА. Предел обнаружения используемого в настоящее время ELISA, определяемый как среднее значение оптической плотности пустых повторов +2 sd, составлял 6,3 пг/мл. Для анализа уровни АМГ в сыворотке ниже 0,1 мкг/л оценивались как 0,0 мкг/л. ФСГ измеряли с помощью иммунометрического анализа на основе хемолюминесценции (Immulite 2000; Siemens, Лос-Анджелес, Калифорния) с коэффициентами дисперсии внутри и между анализами менее 3% и 8%.
Анализ данных
Поскольку образцы были получены от субъектов, участвовавших в разных исследованиях, уровни АМГ сравнивали между включенными в исследование когортами с помощью одномерного ковариационного анализа с поправкой на возраст. Поскольку сыворотку брали в течение фолликулярной и лютеиновой фаз менструального цикла, аналогичный тест использовали для сравнения уровней АМГ, полученных во время фолликулярной фазы, с уровнями, полученными во время лютеиновой фазы.
Референтные кривые для уровней АМГ в сыворотке в зависимости от возраста были рассчитаны на основе модели линейной регрессии с использованием натурального кубического сплайна, аппроксимированного на логарифмически преобразованных значениях АМГ.На основе подобранной кривой была рассчитана кусочно-линейная функция, описывающая изменение уровней АМГ с возрастом. Кроме того, мы определили возраст, в котором значения АМГ достигают своего максимального значения, и 95% доверительный интервал этого возраста был определен путем бутстрэппинга 5000 раз. Следовательно, можно выделить две подгруппы: одну с повышенным уровнем АМГ и подгруппу со сниженным уровнем АМГ. В общей когорте, а также в подгруппах были выполнены двумерные корреляции между АМГ в сыворотке и возрастом.Кроме того, была проведена двумерная корреляция между уровнями АМГ в сыворотке и количеством фолликулов. Эта корреляция также проводилась между уровнями АМГ в сыворотке и уровнями ФСГ в образцах, взятых во время ранней фолликулярной фазы.
Результаты
Всего было включено 804 здоровых младенца, ребенка, подростка и взрослой женщины. Средний возраст составил 24,6 года. Самому младшему испытуемому было 3,1 месяца, а самому старшему — 46,8 года. Измерение концентраций АМГ с использованием двух ИФА АМГ не привело к значительным различиям [медиана 1.6 (диапазон 0,0–15,5) по сравнению с 3,3 (диапазон 0,0–18,3) мкг/л; P = 0,11] (6). Не было различий в уровнях АМГ, полученных во время фолликулярной фазы, и уровней, измеренных во время лютеиновой фазы после поправки на возрастные различия (медиана 1,9 против 3,3 мкг/л соответственно; P = 0,08).
В общей когорте уровни АМГ в сыворотке обратно коррелировали с возрастом ( r = -0,24; P < 0,001). Естественная функция кубического сплайна объяснила 41% дисперсии log(AMH), указывая на то, что дисперсия AMH на 41% определялась возрастом.Подогнанная кривая показала, что с момента рождения уровни АМГ в сыворотке немного увеличивались до конца полового созревания и, по-видимому, оставались довольно постоянными до тех пор, пока уровни не снизились в возрасте 25,0 лет и далее (рис. 1 и 2). Используя кусочно-линейную функцию, повышение уровня АМГ в детстве и ослабление АМГ в подростковом возрасте не достигло статистической значимости (данные не показаны). Возраст, в котором было достигнуто максимальное значение АМГ, был оценен как 15,8 года (95% доверительный интервал 13.5–20.3). До 15,8 лет сывороточный АМГ и возраст положительно коррелировали ( r = +0,18; P = 0,007). После этого уровни АМГ оставались стабильными, и, следовательно, корреляция между АМГ и возрастом не достигала статистической значимости ( r = -0,33; P = 0,66). С 25,0 лет наблюдается обратная корреляция между АМГ и возрастом ( r = -0,47; P < 0,001) (рис. 2).
1 и 2). Используя кусочно-линейную функцию, повышение уровня АМГ в детстве и ослабление АМГ в подростковом возрасте не достигло статистической значимости (данные не показаны). Возраст, в котором было достигнуто максимальное значение АМГ, был оценен как 15,8 года (95% доверительный интервал 13.5–20.3). До 15,8 лет сывороточный АМГ и возраст положительно коррелировали ( r = +0,18; P = 0,007). После этого уровни АМГ оставались стабильными, и, следовательно, корреляция между АМГ и возрастом не достигала статистической значимости ( r = -0,33; P = 0,66). С 25,0 лет наблюдается обратная корреляция между АМГ и возрастом ( r = -0,47; P < 0,001) (рис. 2).
Рис. 1.
Номограмма АМГ на основе естественной линейной сплайн-интерполяции.Контрольные линии сывороточного АМГ для 10-го, 50-го и 90-го процентилей прогнозируемых значений АМГ 90 064 по сравнению с возрастом 90 065.
Рис. 1.
Номограмма АМГ на основе естественной линейной сплайн-интерполяции. Контрольные линии сывороточного АМГ для 10-го, 50-го и 90-го процентилей прогнозируемых значений АМГ 90 064 по сравнению с возрастом 90 065.
Контрольные линии сывороточного АМГ для 10-го, 50-го и 90-го процентилей прогнозируемых значений АМГ 90 064 по сравнению с возрастом 90 065.
Рис. 2.
Уровни АМГ в сыворотке (микрограммы на литр) по подгруппам в зависимости от возраста. Контрольные линии сывороточного АМГ для 10-го, 50-го и 90-го процентилей прогнозируемых значений АМГ по сравнению с возраст в подгруппе 0–15,8 лет ( левая панель ), 16–25 лет ( средняя панель ) и у женщин старше 25 лет ( правая панель ).
Рис. 2.
Уровни АМГ в сыворотке (микрограммы на литр) по подгруппам в зависимости от возраста. Контрольные линии сывороточного АМГ для 10-го, 50-го и 90-го процентилей прогнозируемых значений АМГ по сравнению с возрастом в подгруппе 0–15,8 лет ( левая панель ), 16–25 лет ( средняя панель ) и у женщин старше 25 лет ( правая панель ).
Подсчет антральных фолликулов у девочек моложе 18 лет не проводился. У 465 женщин в возрасте 18 лет и старше было доступно количество антральных фолликулов. Среднее количество антральных фолликулов составило 13 (диапазон 0–48). АМГ в сыворотке и количество антральных фолликулов положительно коррелировали ( r = +0,67; P <0,001). У 253 взрослых сыворотка была взята в раннюю фолликулярную фазу, и медиана ФСГ составила 6,4 МЕ/л (диапазон 2,0–35,9 МЕ/л). Уровни АМГ и ФСГ в сыворотке отрицательно коррелировали ( r = -0.29; P < 0,001).
Среднее количество антральных фолликулов составило 13 (диапазон 0–48). АМГ в сыворотке и количество антральных фолликулов положительно коррелировали ( r = +0,67; P <0,001). У 253 взрослых сыворотка была взята в раннюю фолликулярную фазу, и медиана ФСГ составила 6,4 МЕ/л (диапазон 2,0–35,9 МЕ/л). Уровни АМГ и ФСГ в сыворотке отрицательно коррелировали ( r = -0.29; P < 0,001).
Обсуждение
В этом исследовании уровни АМГ в сыворотке оценивались у здоровых женщин от рождения до конца репродуктивной жизни в одной лаборатории. Наши данные ясно показывают, что корреляция между уровнями АМГ в сыворотке и возрастом в детстве отличается от корреляции в течение репродуктивной жизни. Уровни АМГ в сыворотке немного повышались в детстве до подросткового возраста и достигали максимума в возрасте 15,8 лет. После этого уровни АМГ оставались стабильными до 20 лет, а с 25 лет уровни АМГ снижались с возрастом.Недавнее исследование на здоровых детях показало повышение уровня АМГ в раннем детстве и затем стабильные концентрации АМГ до раннего взросления (16). Эти результаты были подтверждены номограммой, основанной на ранее описанных уровнях АМГ у детей и взрослых (19). Кроме того, авторы пришли к выводу, что изменение концентрации АМГ в основном определяется факторами, отличными от возраста (19). Действительно, в наших данных дисперсия АМГ на 41% определялась возрастом, и, следовательно, вариации концентраций АМГ также могут определяться вариациями числа продуцирующих АМГ фолликулов или генетической предрасположенностью.
Эти результаты были подтверждены номограммой, основанной на ранее описанных уровнях АМГ у детей и взрослых (19). Кроме того, авторы пришли к выводу, что изменение концентрации АМГ в основном определяется факторами, отличными от возраста (19). Действительно, в наших данных дисперсия АМГ на 41% определялась возрастом, и, следовательно, вариации концентраций АМГ также могут определяться вариациями числа продуцирующих АМГ фолликулов или генетической предрасположенностью.
Наши данные подтверждают ранее описанную корреляцию между уровнями АМГ в сыворотке и уменьшением числа антральных фолликулов у женщин и грызунов (4, 6). В более раннем исследовании было показано, что квадратное уравнение является лучшей моделью для описания снижения значений АМГ в сыворотке с возрастом (17). В наших данных квадратичная модель не могла соответствовать результатам нашей общей когорты. Однако, когда квадратное уравнение было применено к уровням АМГ у женщин в возрасте 25 лет и старше, была получена кривая, аналогичная полученной с помощью модели естественной линейной сплайн-интерполяции (данные не показаны). Следовательно, наши результаты показывают, что АМГ применим только в качестве маркера снижения овариального резерва у женщин после 25 лет.
Следовательно, наши результаты показывают, что АМГ применим только в качестве маркера снижения овариального резерва у женщин после 25 лет.
Как описано в ранее упомянутых исследованиях (16, 19), мы наблюдали большие межиндивидуальные различия в уровнях АМГ. В общей популяции до 10% женщин репродуктивного возраста страдают СПКЯ (26, 27), который характеризуется повышенным уровнем АМГ (13, 14). В настоящее исследование были включены только женщины с регулярными циклами, что исключило женщин с олигоановуляцией, одной из основных характеристик СПКЯ (27).Кроме того, большинство женщин зачали спонтанно. Тем не менее, женщины с гиперандрогенией и морфологией поликистозных яичников и, следовательно, с СПКЯ в соответствии с критериями Роттердамского консенсуса, также могли быть включены и могли вызывать некоторые колебания уровней АМГ на верхней границе нормальных значений. Тем не менее, частота случаев СПКЯ у женщин с гиперандрогенией и морфологией поликистозных яичников в нашей когорте исследования оценивалась менее чем в 3% (27–29) и поэтому считалась слишком низкой, чтобы объяснить наблюдаемый диапазон уровней АМГ. Кроме того, аналогичные диапазоны уровней АМГ были описаны у большой популяции бесплодных женщин с нормальной морфологией яичников и подтвержденной овуляцией (30, 31), а также у здоровых добровольцев с регулярными менструальными циклами и без бесплодия или гиперандрогении в анамнезе (5). .
Кроме того, аналогичные диапазоны уровней АМГ были описаны у большой популяции бесплодных женщин с нормальной морфологией яичников и подтвержденной овуляцией (30, 31), а также у здоровых добровольцев с регулярными менструальными циклами и без бесплодия или гиперандрогении в анамнезе (5). .
Вероятнее всего, колебания уровня АМГ могут отражать диапазон репродуктивной способности и возраст наступления менопаузы, который демонстрирует аналогичные большие различия у нормальных женщин в диапазоне от 40 до 60 лет (32). Действительно, было показано, что возраст наступления менопаузы более точно предсказывался по концентрации АМГ в сыворотке, чем по хронологическому возрасту (33).Недавние лонгитюдные когортные исследования показали, что уровни АМГ в сыворотке крови, полученные примерно 10 лет назад, в высокой степени предсказывали возраст перехода в менопаузу (34, 35), предполагая, что АМГ способен предсказывать возраст наступления менопаузы для данной женщины. Следовательно, можно предположить, что в любом возрасте женщины с АМГ на верхней границе нормы вступают в менопаузу в более позднем возрасте по сравнению с женщинами с уровнем АМГ на нижней границе нормы. Однако средний возраст женщин, включенных в эти когортные исследования, составлял 35 и 41 год, при этом межиндивидуальная вариация АМГ меньше, чем в более молодом возрасте, как показывают наши данные.Следовательно, прогноз возраста наступления менопаузы на основе уровней АМГ, измеренных в молодом возрасте, следует интерпретировать с осторожностью, поскольку такой прогноз может быть менее точным. Кроме того, остается неизвестным, происходит ли потеря фолликулов с одинаковой скоростью у всех женщин и одинаково ли исходное количество примордиальных фолликулов, заложенных в течение ранней внутриутробной жизни, у всех женщин. Необходимы дополнительные исследования с длительным наблюдением за часто измеряемыми уровнями АМГ у молодых женщин, чтобы подтвердить, действительно ли АМГ может предсказывать возраст перехода в менопаузу.
Однако средний возраст женщин, включенных в эти когортные исследования, составлял 35 и 41 год, при этом межиндивидуальная вариация АМГ меньше, чем в более молодом возрасте, как показывают наши данные.Следовательно, прогноз возраста наступления менопаузы на основе уровней АМГ, измеренных в молодом возрасте, следует интерпретировать с осторожностью, поскольку такой прогноз может быть менее точным. Кроме того, остается неизвестным, происходит ли потеря фолликулов с одинаковой скоростью у всех женщин и одинаково ли исходное количество примордиальных фолликулов, заложенных в течение ранней внутриутробной жизни, у всех женщин. Необходимы дополнительные исследования с длительным наблюдением за часто измеряемыми уровнями АМГ у молодых женщин, чтобы подтвердить, действительно ли АМГ может предсказывать возраст перехода в менопаузу.
Недавние исследования женщин с регулярной ездой на велосипеде не дали окончательных результатов относительно связи между уровнями АМГ в сыворотке и уровнями ФСГ (6, 36–38).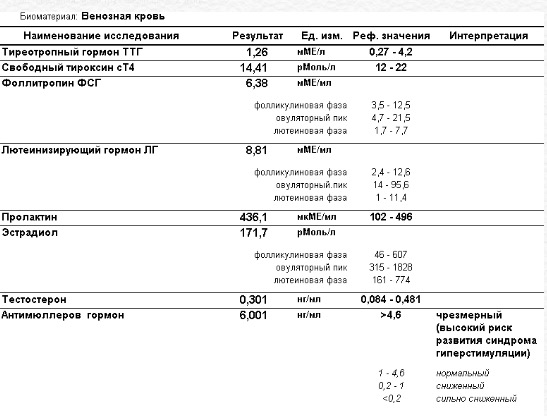 В наших результатах уровни АМГ и ФСГ в сыворотке у женщин старше 25 лет имели отрицательную корреляцию, несмотря на большие межиндивидуальные различия обоих гормонов. Кроме того, обратная корреляция между АМГ и возрастом была сильнее, чем между ФСГ и возрастом, что свидетельствует о том, что АМГ является более точным маркером старения яичников, чем ФСГ (6).
В наших результатах уровни АМГ и ФСГ в сыворотке у женщин старше 25 лет имели отрицательную корреляцию, несмотря на большие межиндивидуальные различия обоих гормонов. Кроме того, обратная корреляция между АМГ и возрастом была сильнее, чем между ФСГ и возрастом, что свидетельствует о том, что АМГ является более точным маркером старения яичников, чем ФСГ (6).
В заключение, наши результаты подтверждают и расширяют ранее полученные данные об уровнях АМГ на протяжении всей репродуктивной жизни.Мы продемонстрировали повышение уровня АМГ в детстве до достижения максимума в возрасте 15,8 лет. После этого наблюдалось плато до 25 лет. Начиная с 25-летнего возраста уровни АМГ в сыворотке обратно коррелируют с возрастом, что означает, что АМГ применим в качестве маркера овариального резерва только у женщин в возрасте 25 лет и старше. Таким образом, наши данные свидетельствуют о том, что фолликулярная динамика в детском возрасте может отличаться от таковой во взрослом возрасте. Номограмма, построенная по нашим данным, может облегчить консультирование женщин по вопросам их репродуктивного потенциала.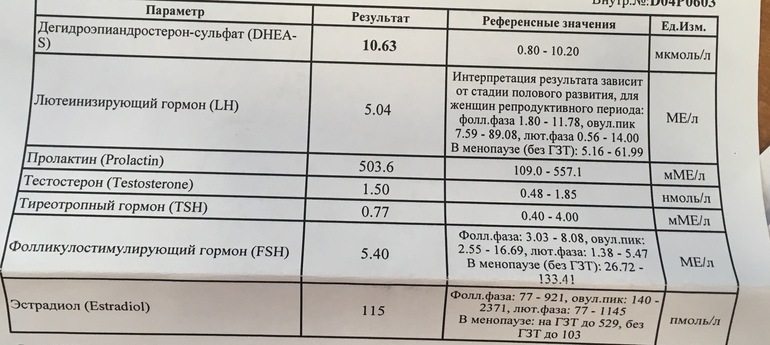
Благодарности
При написании данного отчета авторы выполняли следующие функции: S.L.F. отвечает за дизайн исследования, анализ и составление рукописи; J.A.V., I.S. и J.S.E.L. несут ответственность за дизайн исследования, сбор данных, составление рукописи, критическое обсуждение и обзор; C.K.W., A.C.S.H.-K., E.M.R., W.H.M.P., FJB и B.C.J.M.F. несут ответственность за сбор данных, критическое обсуждение и обзор; А.П.Н.Т., Ю.Б.д.Р. и Ф.Х.Д.Дж. отвечают за измерения гормонов, техническую поддержку и критический обзор; и M.J.C.E. отвечает за статистический анализ.
Краткое изложение раскрытия информации: A.C.S.H.-K. получает финансовую поддержку от Pfizer и Novo Nordisk для проведения клинических испытаний, инициированных исследователями; B.C.J.M.F. получил гонорары и грантовую поддержку от следующих компаний: Andromed, Ardana, Ferring, Merck Serono, Organon, Pantharei Bioscience, PregLem, Schering Plough, Schering, Serono и Wyeth; А. П.Н.Т. консультирует для ANSHlabs; и J.S.E.L. получил гонорары и грантовую поддержку от следующих компаний: Ferring, Genovum, Merck-Serono, MSD, Organon, Schering-Plough и Serono.
П.Н.Т. консультирует для ANSHlabs; и J.S.E.L. получил гонорары и грантовую поддержку от следующих компаний: Ferring, Genovum, Merck-Serono, MSD, Organon, Schering-Plough и Serono.
Сокращения
AFC
AMH
СПКЯ
синдром поликистозных яичников.
Каталожные номера
1.Weenen
C
,C
,Laven
JS
,VON Bergh
AR
,Cranfield
M
,Groome
NP
,Visser
JA
,Kramer
P
,Fauser
BC
,Themmen
AP
2004
Паттерн экспрессии антимюллерова гормона в яичниках человека: потенциальные последствия для начального и циклического набора фолликулов.
MOL CUM REPROD
10
:77
—83
2.770005 2.
Andersen
CY
,Byskov
AG
2006
2006
Estradiol и регулирование антимольреренного гормона, ингибин и секреция ингибина-В: анализ жидкости малых антральных и преовуляторных фолликулов человека.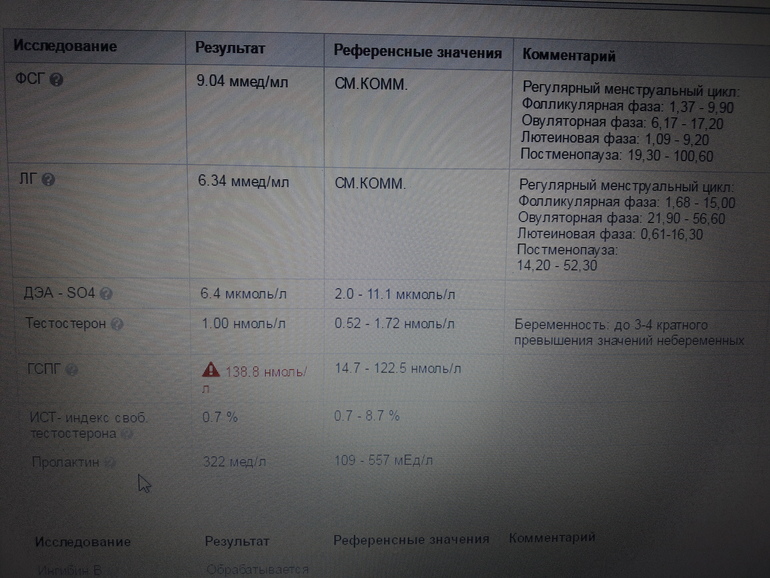
J Clin Endxrinol Metab
91
:4064
—4064
—4069
—4069
—4069
3. 3.AL
,Visser
JA
,Themenmen
AP
2002
Регуляция функции яичников : роль антимюллерова гормона.
Воспроизведение
124
:601
—601
—609
4.Kevenaar
ME
,Meerasahib
MF
,Kramer
P
,Van de Lang-Born
BM
,de Jong
FH
,GROME
NP
,NP
,,Visser
,Visser
JA
2006
2006
Уровни гормонального гормона в сыворотке, отражают размер изначального фолликула в мышах.
эндокринологии
147
:3228
—3228
—3234
5.La Marca
A
,SPADA
E
,GRISENDI
V
,Argento
C
,Papaleo
E
,Milani
S
,Volpe
A
2012
Нормальный уровень антимюллерова гормона в сыворотке у женщин в целом и связь с репродуктивным анамнезом.
EUR J Obstet Gynecol Refrod Biol
163
:180
—184
6.de Vet
A
,Laven
JS
,De Jong
FH
,Themen
AP
,Fauser
BC
2002
Уровни антимюллерова гормона в сыворотке: предполагаемый маркер старения яичников.
Fertil Steril
77
:357
–362
7.Pigny
Pigny
p
,JONARD
S
,S
,Robert
Y
,y
,D
2006
2006
Сывороточный антимольререйский гормон в качестве суррогата для подсчета антрил-фолликула для определения поликистоза яичниковый синдром.
J Clin Endcrinol Metab
91
:941
—941
—945
—945
8.Van Rooij
IA
,BROEKMANS
FJ
,TE Velde
ER
,Fauser
BC
,Bancsi
LF
,de Jong
FH
,Themmen
AP
2002
Уровень сывороточного гормона анти-Муллариана.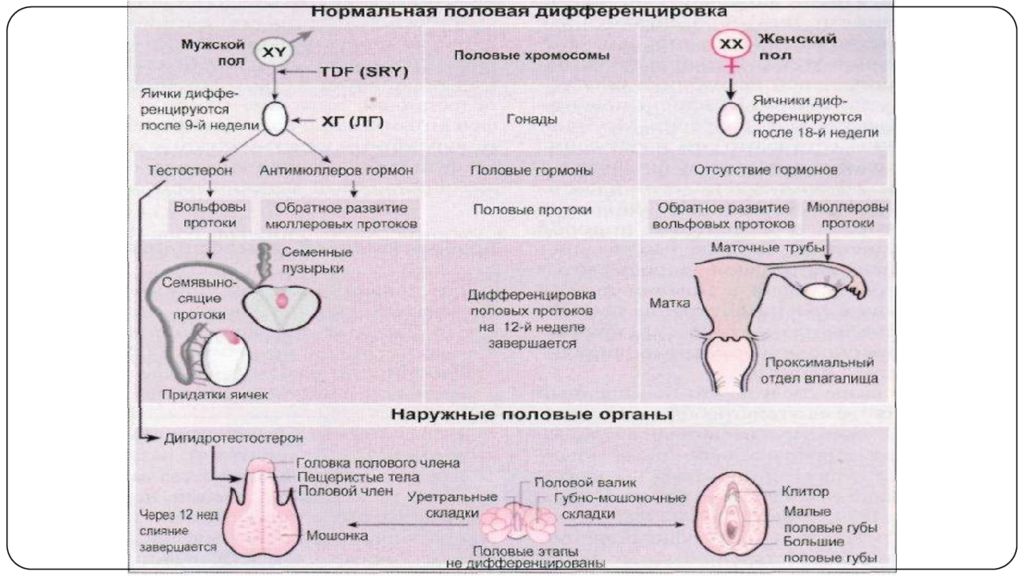
HUM REPROD
17
:3065
—3071
9.3071
S
,Baart
EB
,Martini
E
,Schipper
I
,Visser
JA
,Themen
,AP
,De Jong
FH
,FH
,FAUSER
BJ
,Laven
JS
2008
2008
Anti-Mullerian Hormone: маркер для OCOCYTE, OOCYTE качество и качество эмбриона?
Reprod Biomed Online
16
:664
–670
10.Fanchin
R
,Schonäuer
LM
,Righini
C
,Guibourdenche
J
,Frydman
R
,Taieb
J
J
2003
Serum Гормон Мюллера более тесно связан с фолликулярным статусом яичников, чем сывороточный ингибин В, эстрадиол, ФСГ и ЛГ на 3-й день.
VAN ROOIJ
IA
,IA
,BROEKMANS
FJ
,Scheffer
GJ
,Looman
CW
,Habbemema
JD
,de Jong
FH
,Fauser
BJ
,Themmen
AP
,te Velde
ER
2005
Уровни антимюллерова гормона в сыворотке лучше всего отражают снижение репродуктивной функции с возрастом у нормальных женщин с доказанной фертильностью: продольное исследование.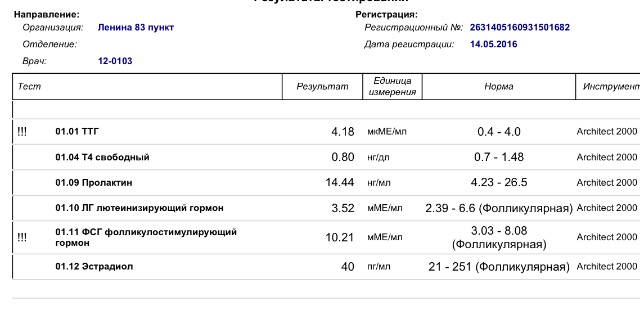
Fertiler STERIL
83
:979
— 12. 12.Brouer
SL
,DLLEMAN
M
,OPMEER
BC
,Fauser
BC
,MOL
BW
,Broekmans
FJ
2011
АМГ и АФК как предикторы чрезмерного ответа при контролируемой гиперстимуляции яичников: метаанализ.
Обновление Hum Reprod
17
:46
–54
13.Laven
JS
,MULDERS
AG
,,
JA
,,
AP
,de Jong
FH
,Fauser
BC
2004
Концентрация мюллерова гормона в сыворотке крови у нормоовуляторных и ановуляторных женщин репродуктивного возраста.
J Clin Endxrinol Metab
89
:318
—318
—323
14.Pigny
Pigny
P
,Merlen
E
,Robert
Y
,Cortet-Rudelli
C
,Decanter
C
,C
,JONARD
S
,S
,D
2003
2003
2003
повышенная сыворотка Уровень антимольреровского гормона у пациентов с поликистовым яичником Синдром: отношение к превышению яичников фолликула и фолликулярная остановка.
J Clin EndCrinol Metab
88
:5957
—5957
—5962
—5962
15.ALMOG
B
,Shehata
F
,Suissa
S
,Holzer
H
,Shalom-PAZ
E
,La Marca
A
,A
,,S
,Blazar
A
,A
,Hackett
R
,Nelson
SM
,Cunha-Filho
JS
,ELDAR-GEVA
T
,T
,Margalioth
EJ
,Raine-Feenning
N
,jayaprakasan
K
,Mcilveen
M
,WUNDER
D
,Freour
T
,Nardo
LG
,Balasch
J
,Peñarrubia
J
,SMEENK
J
,GNOTH
C
,C
,Godehardt
E
,Lee
,
,
Lee
MS
,Levin
I
,Gamzu
R
,Tulandi
T
2011
Возрастные нормограммы уровня антимюллерова гормона в сыворотке крови у женщин с бесплодием: многоцентровое исследование.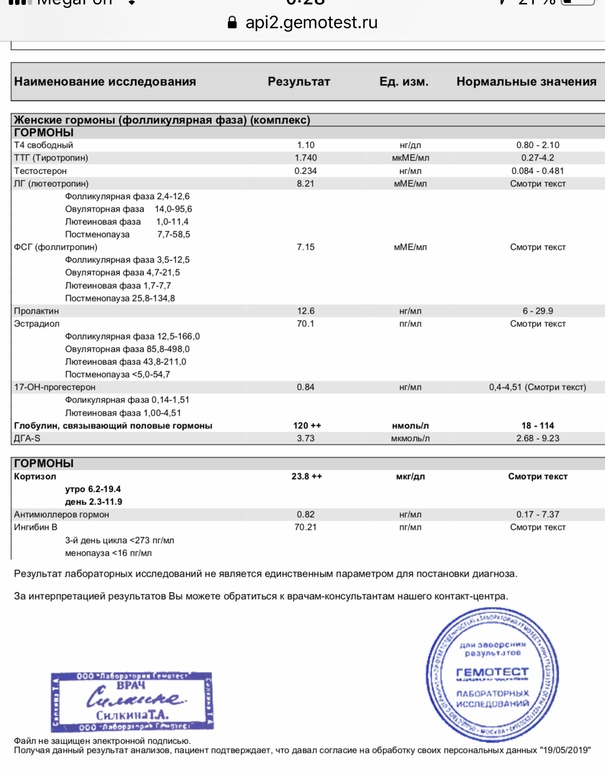
Fertither Steril
95
:2359
—2359
, 16., 16.Hagen
CP
,Aksglaede
L
,Sørensen
K
,Главная
км
,BOA
м
,Cleemann
,Cleemann
L
,Holm
K
,K
,,CH
,Andersson
AND
,PADERSEN
AT
,PETERSEN
JH
,LINNEBERG
A
,Kjaergaard
S
,Juul
A
2010
Уровни антимюллерова гормона в сыворотке как маркер функции яичников у здоровых женщин при рождении и у 92 взрослых женщин2.
J Clin Endxrinol Metab
95
:5003
—5010
17.5010
17.BROEKMANS
FJ
,Visser
JA
,Laven
JS
,BROER
SL
,Themmen
AP
,Fauser
BC
2008
Антимюллеров гормон и дисфункция яичников.
Trends Endocrinol Metab
19
:340
–347
18.Brouer
SL
,,
,
,
BW
,,
D
,D
,BROEKMANS
FJ
2009
2009
Роль антималреровского гормона в прогнозировании результата после IVF: сравнение с антральным фолликулом считать.
Fertil Steril
91
:705
—714
19.Kelsey
TW
,REAGE
P
,Nelson
SM
,Anderson
RA
,Wallace
WH
2011
Утвержденная модель сывороточного антимюллерова гормона от зачатия до менопаузы.
plos One
6
:E22024
:E22024
20.Lee
JY
,Jee
,
,
BC
,Lee
JR
,KIM
CH
,Park
T
,yeon
BR
,SEO
SY
,,WD
,WD
,SUH
CS
,KIM
SH
SH
2012
Возрастные распределения уровня бормонального уровня и Модели антимюллерова гормона.
ACTA Obstet Gynecol Scand
970
:970
—975
— 21.ADAMS
JM
,Taylor
AE
,CORELEY
WF
,HOLE
JE
2004
Морфология поликистозных яичников с регулярными овуляторными циклами: понимание патофизиологии синдрома поликистозных яичников.
J Clin Endocrinol Metab
89
:4343
–4350
22.LeUnissen
RW
,Kerkhof
,
Kerkhof
GF
,GF
,stijnen
t
,hokken-koelega
AC
AC
2008
Жирная масса и аполипопротеин E Генотип влияют на уровень липопротеина в сыворотке в раннем возрасте, тогда как размер при рождении нет.
J Clin Endxrinol Metab
93
:4307
—4307
—4307
—4314
23.Murphy
MK
,,
JE
,ADAMS
JM
,Lee
H
,Welt
CK
2006
Морфология поликистозных яичников у нормальных женщин не является предиктором развития синдрома поликистозных яичников.
J Clin Endxrinol Metab
91
:3878
—3878
—3878
—3874
—384
ROES
EM
,Sieben
R
,Raijmakers
MT
,Peters
WH
,Steegers
EA
2005
Тяжелая преэклампсия связана с положительным семейным анамнезом гипертонии и гиперхолестеринемии.
Гипертония Беременность
24
:259
–271
25.Scheffer
GJ
,BROEKMANS
,BROEKMANS
FJ
,LOOMAN
CW
,BLACKENSEIN
M
,FAUSER
BC
,TEJONG
FH
,TEVELDE
ER
2003
Количество антральных фолликулов у здоровых женщин с доказанной фертильностью лучше всего отражает репродуктивный возраст.
Hum Reprod
18
:700
–706
26.azziz
R
, CARMINAE
,E
,D
,D
,Eamananti-Kandarakis
E
,Escobar-Morreale
HF
,Futterweit
W
,Janssen
OE
,Legro
RS
,RS
,Norman
RJ
,RJ
,Taylor
AE
,Witchel
SF
2009
2009
Андроген Избыток и критерии общества PCOS для синдрома поликистового яичка: полный отчет оперативной группы.
Fertil Steril
91
:456
—488
27. 27.Brokekmans
FJ
,Knauff
EA
,Valkenburg
O
,Laven
JS
,Eijkemans
MJ
,Fauser
BC
2006
СПКЯ в соответствии с критериями Роттердамского консенсуса: изменение распространенности ановуляции ВОЗ-II и связь с метаболическими факторами.
BJOG
113
:1210
—1210
—1217
28.WA
,Moore
VM
,Willson
KJ
,Phillips
Di
,Norman
RJ
,Davies
MJ
2010
Распространенность синдрома поликистозных яичников в выборке населения оценивалась по контрастным диагностическим критериям.
Hum Reprod
25
:544
–551
29.NIDHI
R
,R
,Padmalatha
V
,V
,Nagarathna
R
,Amritanshu
R
2011
2011
Распространенность поликистового синдрома яичников в индийских подростках.
J Pediamtr AdoLesc Gynecol
24
:223
—227
—227
30.Nelson
SM
,MISW
MC
,Wallace
AM
,Fleming
R
,McConnachie
A
2011
Номограмма снижения антимюллерова гормона в сыворотке: популяционное исследование 9601 пациента с бесплодием.
Fertil Steril
95
:736
—736
—741.E1-3
31.Shebl
O
,EBNER
T
,SIR
A
,Schreier-Lechner
E
,Mayer
RB
,TEW
,TEW
G
,SOMMERGRUBER
M
M
2011
2011
Возрастное распределение базальной сыворотки AMH Уровень у женщин репродуктивного возраста и предположительно здоровой когорты.
Fertil STERIL
95
:834
—834
32.TE Velde
Er
,Er
,Pearson
PL
2002
Отменчивость женского репродуктивного старения.
HUM REPOD UPDATE
8
:141
—154
33.фургон Дссилдорп
J
,Faddy
MJ
,Themen
AP
,De Jong
FH
,Peeters
PH
,van der Schouw
YT
,Broekmans
FJ
2008
2008
2008
2008
Broekmans
2008
2008
2008
2008 2008
J Clin EndCrinol Metab
93
:2129
—2129
—2134
—2134
34.Broier
SL
,Eijkemans
MJ
,Scheffer
GJ
,VAN ROOIJ
IA
,de Vet
A
,A
,AP
,Laven
JS
,De Jong
FH
,TE Velde
ER
,Fauser
BC
,BROEKMANS
FJ
2011
Антимюллеров гормон предсказывает менопаузу: долгосрочное последующее исследование у нормовуляторных женщин.
J Clin Endcrinol Metab
96
:2532
—2532
—2539
—2539
35.,EW
,MD
,LIN
H
,GRACIA
CR
2012
Антимюллеров гормон как предиктор времени наступления менопаузы у женщин позднего репродуктивного возраста.
J Clin EndCrinol Metab
97
:1673
—1673
—1609
36.RASHIDI
BH
,ABEDIASL
Z
,Tehraninejad
ES
,Shariat
M
,Mahdavi
A
2009
Продолжительность менструального цикла в зависимости от антимюллерова гормона и фолликулостимулирующего гормона.
J REPROD MED
54
:315
—318
37.певица
T
,Barad
DH
,Weghofer
A
,Gleicher
N
2009
Корреляция антимюллерова гормона и исходного уровня фолликулостимулирующего гормона.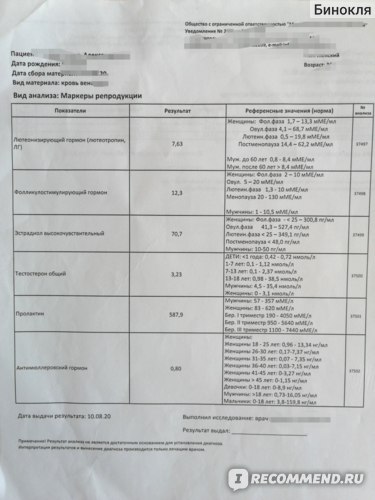
Fertil Steril
91
:2616
—2619
38.Wachs
DS
,CORFER
MS
,MALCOM
PJ
,CHANT
RJ
2007
Концентрации антимюллерова гормона в сыворотке не изменяются при однократном введении фолликулостимулирующего гормона при синдроме поликистозных яичников и у здоровых женщин.
J Clin Endocrinol Metab
92
:1871
–1874
Copyright © 2012 The Endocrine Society
Клиническое применение измерений антимюллерова гормона в сыворотке у мужчин и женщин: обновление
https://doi.org/10.1016/j.xinn.2021.100091Получить права и содержание Мюллеровский гормон (АМГ) играет ключевую роль в моделях, оценивающих овариальный резервАМГ используется для дифференциальной диагностики нарушений полового развития расстройства
Международный стандарт поможет в разработке различных анализов АМГ
Бесплодие является одним из наиболее распространенных неинфекционных заболеваний, одинаково поражающих как мужчин, так и женщин.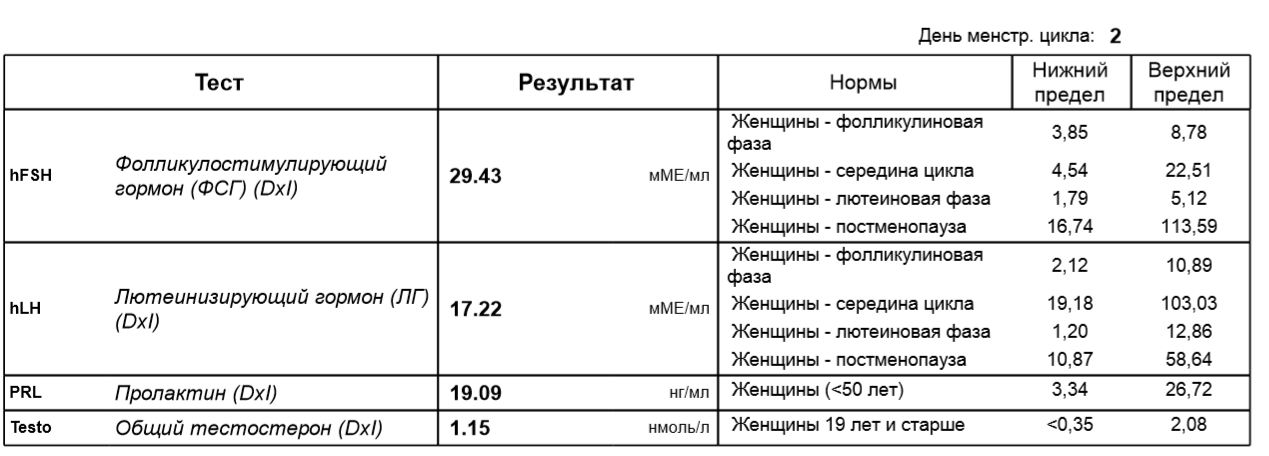 Овариальный резерв, количество примордиальных фолликулов в яичниках считается наиболее важным фактором, определяющим женскую фертильность. Антимюллеровский гормон (АМГ), секретируемый гранулезными клетками растущих фолликулов, признан наиболее важным биомаркером овариального резерва. Модели овариального резерва были разработаны с использованием АМГ и других гормональных показателей, поэтому женщины могут планировать деторождение и репродуктивный выбор. В циклах вспомогательных репродуктивных технологий измерение АМГ помогает предсказать реакцию яичников и определить дозировку рекомбинантного фолликулостимулирующего гормона у женщин.Уровень АМГ в сыворотке все чаще признается потенциальным суррогатным маркером морфологии поликистозных яичников, одним из критериев диагностики синдрома поликистозных яичников. АМГ также секретируется клетками Сертоли яичек у мужчин, и также исследовались измерения АМГ в прогнозировании скорости восстановления сперматозоидов после хирургического вмешательства у мужчин.
Овариальный резерв, количество примордиальных фолликулов в яичниках считается наиболее важным фактором, определяющим женскую фертильность. Антимюллеровский гормон (АМГ), секретируемый гранулезными клетками растущих фолликулов, признан наиболее важным биомаркером овариального резерва. Модели овариального резерва были разработаны с использованием АМГ и других гормональных показателей, поэтому женщины могут планировать деторождение и репродуктивный выбор. В циклах вспомогательных репродуктивных технологий измерение АМГ помогает предсказать реакцию яичников и определить дозировку рекомбинантного фолликулостимулирующего гормона у женщин.Уровень АМГ в сыворотке все чаще признается потенциальным суррогатным маркером морфологии поликистозных яичников, одним из критериев диагностики синдрома поликистозных яичников. АМГ также секретируется клетками Сертоли яичек у мужчин, и также исследовались измерения АМГ в прогнозировании скорости восстановления сперматозоидов после хирургического вмешательства у мужчин. Уровень АМГ значительно выше у мальчиков, чем у девочек до полового созревания. Поэтому сывороточные уровни АМГ в сочетании с тестостероном используют для дифференциальной диагностики нарушений полового развития, анорхии, необструктивной азооспермии и синдрома персистирующего мюллерова протока.В последнее время измерения АМГ в сыворотке также использовались в программах сохранения фертильности при онкофертильности, скрининге гранулезоклеточных опухолей и прогнозировании менопаузы. В этом обзоре мы сосредоточимся на клиническом применении АМГ для оценки фертильности у здоровых мужчин и женщин, а также у больных раком.
Уровень АМГ значительно выше у мальчиков, чем у девочек до полового созревания. Поэтому сывороточные уровни АМГ в сочетании с тестостероном используют для дифференциальной диагностики нарушений полового развития, анорхии, необструктивной азооспермии и синдрома персистирующего мюллерова протока.В последнее время измерения АМГ в сыворотке также использовались в программах сохранения фертильности при онкофертильности, скрининге гранулезоклеточных опухолей и прогнозировании менопаузы. В этом обзоре мы сосредоточимся на клиническом применении АМГ для оценки фертильности у здоровых мужчин и женщин, а также у больных раком.
Ключевые слова
ключевые слова
Anti-Müllerian Гормон Анализы
Assisted Repenductive Technology
Certoli клетки
Гранулоза клетки
Яичников
MENOPAUSE
PCOS
Рекомендуемые статьи Статьи (0)
© 2021
Рекомендуемые статьи
Со ссылкой на статьи
10 главных фактов об уровне антимюллерова гормона и тестировании овариального резерва
Антимюллеров гормон (АМГ) – это вещество, ответственное за разрушение мюллеровых протоков (женских репродуктивных органов) у развивающихся мужских эмбрионов.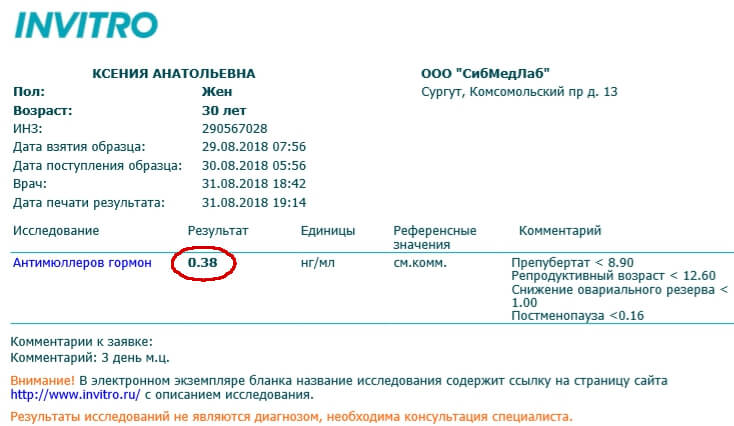 ..
..
- Антимюллеров гормон (АМГ) — это вещество, ответственное за разрушение мюллеровых протоков (женских репродуктивных органов) у развивающихся эмбрионов мужского пола. Важным открытием стал синтез АМГ гранулезными клетками (клетками, окружающими зрелую яйцеклетку), за которым последовала разработка точных анализов крови для измерения АМГ. В течение последних 20 лет широко изучалось значение АМГ в отношении функции яичников.
- АМГ продуцируется в наибольшем количестве антральными фолликулами размером < 6 мм.Фолликулы > 8 мм в диаметре, тека-клетки и атретические фолликулы имеют практически неопределяемый уровень АМГ. Считается, что АМГ препятствует переходу от примордиальных фолликулов к растущим антральным фолликулам. Во время индукции овуляции происходит снижение уровня АМГ. Этого следовало ожидать, так как более крупные преовуляторные фолликулы продуцируют меньше АМГ. Уровень
- АМГ снижается с возрастом. Снижение уровня АМГ может быть самым ранним маркером старения яичников.
 За этим следует снижение уровня ингибина В, а затем повышение уровня ФСГ.Есть исследования, которые предполагают, что уровни АМГ могут (в ближайшем будущем) быть полезными для прогнозирования наступления менопаузы у женщины.
За этим следует снижение уровня ингибина В, а затем повышение уровня ФСГ.Есть исследования, которые предполагают, что уровни АМГ могут (в ближайшем будущем) быть полезными для прогнозирования наступления менопаузы у женщины. - У женщин с ожирением средний уровень АМГ на 65% ниже, чем у женщин без ожирения. Это говорит о том, что ожирение может быть связано с уменьшением овариального резерва. Уровни
- АМГ не сильно изменяются в течение менструального цикла. В отличие от уровней ФСГ (которые следует измерять на 2, 3 или 4 дни цикла), уровни АМГ можно измерять в любой день цикла. Таким образом, он может служить уникальным несвоевременным маркером овариального резерва! Уровни
- АМГ предсказывают реакцию яичников на ЭКО.Более высокие уровни АМГ связаны с большим количеством извлеченных яйцеклеток. С другой стороны, более низкие уровни АМГ (<0,5 нг/мл) предсказывают плохую реакцию яичников с чувствительностью 85% и специфичностью 82,3%.
- Уровни АМГ > 3,5 нг/мл связаны с повышенной частотой синдрома гиперстимуляции яичников.
 Таким образом, уровни АМГ можно использовать в качестве ориентира при выборе дозы препаратов от бесплодия для индукции овуляции. У пациентов с высоким уровнем АМГ дозу следует снизить, а у пациентов с низким уровнем АМГ — наоборот. На уровни
Таким образом, уровни АМГ можно использовать в качестве ориентира при выборе дозы препаратов от бесплодия для индукции овуляции. У пациентов с высоким уровнем АМГ дозу следует снизить, а у пациентов с низким уровнем АМГ — наоборот. На уровни - АМГ НЕ влияют противозачаточные таблетки, беременность или агонисты ГнРГ (например, ацетат лейпролида, люпрон).
- У онкологических больных, перенесших химиотерапию или облучение, уровень АМГ может быть маркером повреждения яичников.
- Для оценки овариального резерва можно использовать сочетание возраста, уровня АМГ, уровня ФСГ и ультразвуковых маркеров, таких как объем яичников и количество антральных фолликулов. В InVia Fertility Specialists мы используем уровни АМГ для скрининга наших потенциальных анонимных доноров яйцеклеток.Мы предпочитаем доноров с уровнем АМГ > 1,5 нг/мл.
Чтобы обратиться к специалисту по лечению бесплодия, который является сертифицированным врачом с отличными показателями успеха, запишитесь на прием в одну из четырех клиник InVia по лечению бесплодия в Чикаго.
Может ли антимюллеровский гормон быть надежным биомаркером для оценки
Введение
Антимюллеровский гормон (АМГ), представляющий собой димерный гликопротеин с молекулярной массой 140 кДа, принадлежащий к надсемейству трансформирующих факторов роста-β, состоит из двух идентичных субъединиц и также называется мюллеров-ингибирующим веществом (МИС). 1,2 Кроме того, АМГ секретируется гранулезными клетками яичников женщин с 36 недель беременности до менопаузы. 3 Его экспрессия начинается в первичных фолликулах и достигает максимума во вторичных и малых антральных фолликулах, но не обнаруживается в примордиальных фолликулах и атретических фолликулах. 4,5 Ингибирует рекрутирование и развитие примордиальных фолликулов в растущие фолликулы. 6,7 Предыдущие исследования подтвердили уровень АМГ в сыворотке как количественный маркер овариального резерва и дисфункции яичников при экстракорпоральном оплодотворении (ЭКО) и синдроме поликистозных яичников.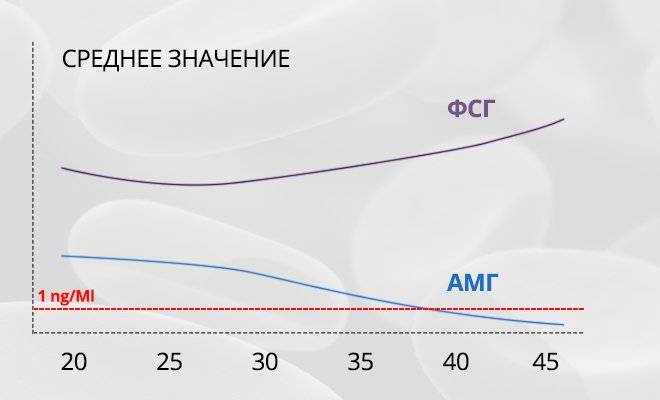 8–10 Однако роль АМГ в прогнозировании восстановления функции яичников у пациенток после химиотерапии остается спорной.
8–10 Однако роль АМГ в прогнозировании восстановления функции яичников у пациенток после химиотерапии остается спорной.
Химиотерапевтические схемы, включающие гонадотоксические молекулы, обычно используются для лечения молодых пациентов с запущенными злокачественными новообразованиями, 11–13 , тогда как циклофосфамид (CTX) является одним из наиболее часто используемых неспецифических цитотоксических препаратов клеточного цикла и часто вызывает нарушение функции яичников. 14 Овариальная токсичность вследствие химиотерапии на основе CTX обычно проявляется аменореей или даже преждевременной недостаточностью яичников (POF). 15 Многие сывороточные маркеры, такие как фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), ингибин В и АМГ, использовались для оценки овариального резерва и способности к зачатию. 16–19 Поскольку АМГ относительно стабилен и не зависит от менструального цикла, 20 многие исследования приняли АМГ в качестве важного биомаркера для оценки функции яичников в период последующего наблюдения после химиотерапии. 21–24 Однако результаты этих исследований были противоречивыми, и до настоящего времени не было достигнуто единого мнения относительно прогностического значения АМГ для функции яичников после химиотерапевтического повреждения. 21,22,25,26
21–24 Однако результаты этих исследований были противоречивыми, и до настоящего времени не было достигнуто единого мнения относительно прогностического значения АМГ для функции яичников после химиотерапевтического повреждения. 21,22,25,26
Учитывая спорные вопросы, упомянутые выше, это исследование было проведено для изучения того, является ли АМГ эффективным биомаркером для прогнозирования функции яичников у женщин в пременопаузе с раком молочной железы, получающих химиотерапию, и для выявления пациенток, у которых уровень АМГ в сыворотке является наиболее ценным предиктором функция яичников.
Пациенты, животные и методы
Исследуемая популяция
С января 2016 г. по декабрь 2017 г. мы случайным образом набрали 144 женщины в пременопаузе с раком молочной железы (возраст 27–49 лет; медиана 43 года), которым потребовалась послеоперационная химиотерапия в нашем центре груди.Использовались следующие схемы: TEC (доцетаксел 75 мг/м 2 + эпирубицин 60 мг/м 2 + CTX 500 мг/м 2 , D1) или FEC (5-фторурацил 500 мг/м 2 + эпирубицин). 75 мг/м 2 + CTX 500 мг/м 2 , D1) каждые 3 недели, всего шесть циклов. Пациенты с предшествующей химиотерапией злокачественных новообразований или других заболеваний или с сопутствующими заболеваниями, связанными с фертильностью, и пациенты с раком молочной железы, получавшие лечение без химиотерапии, были исключены. Сывороточные уровни Е2, ФСГ, ЛГ и АМГ определяли дважды у больных раком молочной железы: до химиотерапии и через 6 мес после последней инъекции химиотерапии.В этом исследовании аменорею определяли как исчезновение менструального цикла во время химиотерапии или после химиотерапии в течение 6 мес; если менструации вновь периодически появлялись в течение 1 года после химиотерапии, состояние женщин определяли как «восстановление менструаций». 27 Прослежены изменения менструального цикла после химиотерапии.
75 мг/м 2 + CTX 500 мг/м 2 , D1) каждые 3 недели, всего шесть циклов. Пациенты с предшествующей химиотерапией злокачественных новообразований или других заболеваний или с сопутствующими заболеваниями, связанными с фертильностью, и пациенты с раком молочной железы, получавшие лечение без химиотерапии, были исключены. Сывороточные уровни Е2, ФСГ, ЛГ и АМГ определяли дважды у больных раком молочной железы: до химиотерапии и через 6 мес после последней инъекции химиотерапии.В этом исследовании аменорею определяли как исчезновение менструального цикла во время химиотерапии или после химиотерапии в течение 6 мес; если менструации вновь периодически появлялись в течение 1 года после химиотерапии, состояние женщин определяли как «восстановление менструаций». 27 Прослежены изменения менструального цикла после химиотерапии.
Одновременно в исследование были включены 177 нормальных здоровых женщин (возраст 17–75 лет; средний возраст 44 года) без гинекологических заболеваний или рака в анамнезе, и уровень АМГ в сыворотке определялся у отдельных лиц случайным образом. Письменное информированное согласие было получено от всех участников, а этическое одобрение было предоставлено Комитетом по этике Шестой народной больницы Шанхайского университета Цзяо Тонг.
Письменное информированное согласие было получено от всех участников, а этическое одобрение было предоставлено Комитетом по этике Шестой народной больницы Шанхайского университета Цзяо Тонг.
Животные
Этот проект был одобрен Комитетом по этике и благополучию животных Шестой народной больницы Шанхайского университета Цзяо Тонг и выполнялся в соответствии с рекомендациями «Исследования на животных: отчетность об экспериментах in vivo» (ARRIVE). Кровь брали из сердца 36 молодых самок мышей C57BL/6J дикого типа в возрасте 1, 4, 6, 8, 12 и 16 месяцев (по шесть мышей на возрастную группу) во время эвтаназии, и у них удаляли яичники для дальнейшие испытания.
Кроме того, 72 молодых самки инбредных мышей Balb/c nude (полученных от Shanghai SLAC Laboratory Animal Co., Шанхай, Китай) в возрасте 6 недель и весом 15–20 г были случайным образом разделены на три группы. Клетки MCF7 (1×10 7 ) вводили подкожно всем мышам в каждой группе. Мы наблюдали и регистрировали рост опухоли каждые 2 дня. В возрасте 8 недель мышам в группе 1 (n = 24), группе 2 (n = 24) и группе 3 (n = 24) вводили однократно внутрибрюшинно 0,1 мл физиологического раствора, 100 мг/кг СТХ и 200 мг/кг СТХ соответственно.Дозы CTX были основаны на предыдущем исследовании, которое продемонстрировало значительную дозозависимую токсичность для яичников без стерилизации. 16,28 Шесть мышей, отобранных стохастически из каждой группы, подверглись забору сердечной крови во время эвтаназии (обезболивание и эвтаназия путем терминальной пункции сердца) и вырезанию яичников перед химиотерапией. Более того, через 1, 3 и 5 недель после химиотерапии у шести мышей, отобранных стохастически из каждой группы, перед эвтаназией собирали кровь и вырезали яичники в каждый момент времени (рис. 1).Яичники фиксировали в формалине, заливали в парафин и окрашивали гематоксилином и эозином (H&E), а сыворотку выделяли из образцов крови для гормональных измерений.
В возрасте 8 недель мышам в группе 1 (n = 24), группе 2 (n = 24) и группе 3 (n = 24) вводили однократно внутрибрюшинно 0,1 мл физиологического раствора, 100 мг/кг СТХ и 200 мг/кг СТХ соответственно.Дозы CTX были основаны на предыдущем исследовании, которое продемонстрировало значительную дозозависимую токсичность для яичников без стерилизации. 16,28 Шесть мышей, отобранных стохастически из каждой группы, подверглись забору сердечной крови во время эвтаназии (обезболивание и эвтаназия путем терминальной пункции сердца) и вырезанию яичников перед химиотерапией. Более того, через 1, 3 и 5 недель после химиотерапии у шести мышей, отобранных стохастически из каждой группы, перед эвтаназией собирали кровь и вырезали яичники в каждый момент времени (рис. 1).Яичники фиксировали в формалине, заливали в парафин и окрашивали гематоксилином и эозином (H&E), а сыворотку выделяли из образцов крови для гормональных измерений.
Рисунок 1 Блок-схема экспериментов, проведенных на мышах-носителях рака. |
Анализ сыворотки E2 и ФСГ
Сыворотки E2 и FSH у всех 144 пациентов с раком молочной железы были протестированы с использованием системы иммуноанализа ADVIA Centaur XP (SIEMENS) соответственно.
Анализ сывороточного АМГ
Уровни АМГ в сыворотке человека и мыши измеряли с использованием набора ИФА для АМГ человека (Cusabio Biotech, № по каталогу: 11351) и набора ИФА для АМГ мыши (XLPM0168) соответственно. Анализы проводили в соответствии с протоколом производителя, а концентрации АМГ определяли по стандартной кривой.Все образцы сыворотки анализировали в двух повторностях.
Анализы проводили в соответствии с протоколом производителя, а концентрации АМГ определяли по стандартной кривой.Все образцы сыворотки анализировали в двух повторностях.
Подсчет фолликулов
Мы подсчитали фолликулы, как описано ранее. 29 Вкратце, общее количество фолликулов в каждом яичнике оценивали путем подсчета количества фолликулов в каждой из пяти секций окрашенных гематоксилин-эозином целых яичников и применения 5-кратного поправочного коэффициента. Затем последовательно вырезали срезы толщиной 5 мкм и подсчитывали фолликулы на каждом пятом срезе. Каждый фолликул проходит пять стадий: примордиальную, первичную, вторичную, антральную и стадии желтого тела.Подсчитывали только фолликулы с ядром ооцита. Первичные фолликулы, вторичные фолликулы и антральные фолликулы вместе именуются растущими фолликулами.
Статистический анализ
Данные представлены как среднее ± стандартная ошибка среднего. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism 7 и SAS 8. 02, а различия между группами химиотерапии и контрольной группой определяли с помощью однофакторного дисперсионного анализа с последующим тестом множественного сравнения.Корреляции между статусом менструации и уровнем гормонов оценивали с помощью логистического регрессионного анализа. Статистическая значимость была установлена на уровне P <0,05.
02, а различия между группами химиотерапии и контрольной группой определяли с помощью однофакторного дисперсионного анализа с последующим тестом множественного сравнения.Корреляции между статусом менструации и уровнем гормонов оценивали с помощью логистического регрессионного анализа. Статистическая значимость была установлена на уровне P <0,05.
Результаты
Характеристики пациента
Клинико-патологическая характеристика больных раком молочной железы представлена в таблице 1. Большинство больных были диагностированы в возрасте старше 35 лет (86,1%) и имели первичный диагноз опухоли Т1 (39,6%) или Т2 (44,4%). Гистологический диагноз включал инвазивные карциномы протоков (89.6%), дольковые карциномы (4,9%) и другие (5,5%). В этой когорте молекулярный подтип у 67 (46,5%), 41 (28,5%), 12 (8,3%) и 24 (16,7%) пациентов был HR+/HER2–, HR+/HER2+, HR–/HER2+ и ТНРМЖ. , соответственно. В общей сложности 12 (8,3%), 92 (63,9%) и 40 (27,8%) женщин подверглись тотальной мастэктомии, модифицированной радикальной мастэктомии и органосохраняющей операции соответственно.
Таблица 1 Клинико-патологические характеристики больных раком молочной железы |
Статус менструации и уровень продуктивного гормона у больных раком молочной железы, получавших химиотерапию
Чтобы проиллюстрировать взаимосвязь между статусом менструации и гормонами у этих пациенток, мы проанализировали данные с помощью логистической регрессии.Как показано в таблицах 2 и 3, аменорея, вызванная химиотерапией, значительно коррелировала с уровнями АМГ, Е2 и ФСГ до химиотерапии и с уровнями АМГ и Е2 после химиотерапии. Восстановление менструального цикла достоверно коррелировало с уровнем АМГ до химиотерапии, но не с уровнем Е2 или ФСГ. Этот результат указывает на то, что, хотя аменорею можно предсказать на основе уровней АМГ, Е2 и ФСГ до химиотерапии, восстановление менструального цикла можно предсказать только на основании уровня АМГ до химиотерапии.
Таблица 2 Статус менструации у больных раком молочной железы, получающих химиотерапию |
Таблица 3 Взаимосвязь между менструацией и репродуктивным гормоном (анализ логистической регрессии) |
Кроме того, у пациентов с раком молочной железы, получавших химиотерапию, уровни АМГ и Е2 в сыворотке достоверно не различались между периодами до и после химиотерапии у пациентов в возрасте <35 лет ( P > 0. 05), в то время как резкое снижение уровня этих гормонов было выявлено после химиотерапии у пациентов старше 35 лет ( P < 0,0001) (табл. 4). Эти данные свидетельствуют о том, что уровни АМГ более эффективны при оценке вызванного химиотерапией повреждения яичников у женщин в пременопаузе старше 35 лет.
05), в то время как резкое снижение уровня этих гормонов было выявлено после химиотерапии у пациентов старше 35 лет ( P < 0,0001) (табл. 4). Эти данные свидетельствуют о том, что уровни АМГ более эффективны при оценке вызванного химиотерапией повреждения яичников у женщин в пременопаузе старше 35 лет.
Таблица 4 Уровни репродуктивных гормонов у больных раком молочной железы до и после химиотерапии (критерий знаковых рангов Уилкоксона) |
Тенденции уровней АМГ в сыворотке у здоровых женщин и самок мышей и корреляция между числом фолликулов и уровнями АМГ у мышей
Далее мы исследовали уровни АМГ в сыворотке крови у здоровых женщин разного возраста.В табл. 5 представлено возрастное распределение всех здоровых женщин, а также средние уровни АМГ в сыворотке по возрастным группам. Уровни АМГ в сыворотке резко снизились у женщин старше 35 лет ( P <0,0001, рис. 2А) и были относительно стабильными до этого возраста.
Таблица 5 Уровень АМГ в сыворотке у нормальной женщины (n=177) |
Рисунок 2 Тенденции уровней АМГ у здоровых женщин и самок мышей и корреляция между числом фолликулов и уровнем АМГ у мышей.( A ) Уровень АМГ в сыворотке был явно снижен у женщин старше 35 лет. ( B ) Уровни АМГ в сыворотке оставались стабильными у мышей в возрасте 4–8 месяцев и снижались после 8-месячного возраста. ( C ) Количество примордиальных фолликулов уменьшалось с возрастом. ( D ) Количество растущих фолликулов значительно уменьшилось у мышей старше 8 месяцев. ( E ) Корреляция между уровнями АМГ и количеством растущих фолликулов была сильно значимой ( r = 0.887, P < 0,0001, критерий Пирсона). ( F ) Окрашенные H&E яичники мышей разного возраста (B–D, каждая полоса представляет минимум шесть мышей, тест ANOVA). |
Затем мы дополнительно определили уровни АМГ в сыворотке у самок мышей дикого типа C57BL/6J разного возраста. Уровни АМГ в сыворотке были повышены у более молодых мышей и значительно снижались с возрастом (рис. 2В). Мы обнаружили три фазы, представляющие изменения уровней АМГ.В первую фазу, до 4-месячного возраста, уровни АМГ в сыворотке были явно повышены (r = 0,97, P < 0,0001). Во второй фазе у мышей в возрасте 4–8 мес уровень АМГ был относительно стабильным ( r = 0,97; 4 и 6-месячный возраст, P = 0,28; 4 и 8-месячный возраст, P = 0,98). Значительное снижение уровня АМГ наблюдалось у мышей старше 8 месяцев ( r = 0,97, P <0,0001), в возрасте, когда у мышей наблюдался нерегулярный цикл и наступала анэструс.
Для подтверждения взаимосвязи между уровнями АМГ и овариальным резервом подсчитывали фолликулы каждой мыши. Результаты этого эксперимента показали, что количество примордиальных фолликулов уменьшалось с возрастом ( r = 0,99, P <0,0001; рис. 2C). Хотя количество растущих фолликулов увеличилось до 6-месячного возраста ( r = 0,91, P < 0,0001; рисунок 2D), оно оставалось стабильным от 6 до 8-месячного возраста ( r = 0.91; 6 месяцев по сравнению с 8 месяцами, P = 0,21) и значительно уменьшились после 8-месячного возраста ( r = 0,91, P <0,0001). Гистологический вид фолликулов показан на рисунке 2F. Наблюдалась сильная корреляция между уровнями АМГ в сыворотке и количеством растущих фолликулов ( r = 0,887, P <0,0001; таблица 6 и рисунок 2Е).
2C). Хотя количество растущих фолликулов увеличилось до 6-месячного возраста ( r = 0,91, P < 0,0001; рисунок 2D), оно оставалось стабильным от 6 до 8-месячного возраста ( r = 0.91; 6 месяцев по сравнению с 8 месяцами, P = 0,21) и значительно уменьшились после 8-месячного возраста ( r = 0,91, P <0,0001). Гистологический вид фолликулов показан на рисунке 2F. Наблюдалась сильная корреляция между уровнями АМГ в сыворотке и количеством растущих фолликулов ( r = 0,887, P <0,0001; таблица 6 и рисунок 2Е).
Таблица 6 Корреляция между уровнями АМГ и ростом фолликулов по возрастным группам |
Влияние циклофосфамида на уровни АМГ в сыворотке и количество фолликулов у голых мышей Balb/c
Мы не обнаружили существенной разницы в размере опухоли между тремя группами до химиотерапии (контрольная группа по сравнению с CTX100 по сравнению с CTX200, P > 0.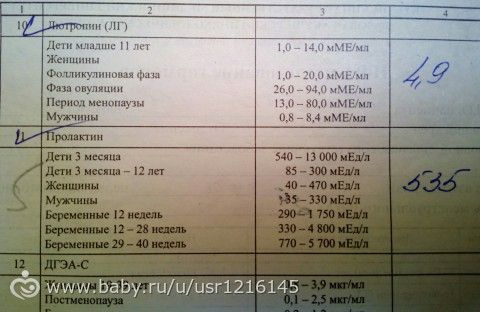 05). Рост опухолей в группе СТХ 100 мг/кг был аналогичен наблюдаемому в контрольной группе, тогда как рост опухоли в группе СТХ 200 мг/кг замедлялся более эффективно (контроль по сравнению с СТХ200, P <0,0001). Тенденции уровней АМГ в сыворотке и количества примордиальных фолликулов и растущих фолликулов голых мышей Balb/c с раком молочной железы в возрасте 8 недель (до химиотерапии), 9 недель (1 неделя после введения КТ или физиологического раствора), 11 недель (3 недели после КТ или введение физиологического раствора) и 13 недель (5 недель после введения CTX или физиологического раствора) показаны на рис. 3A–C.Взаимосвязь между уровнями АМГ в сыворотке и числом фолликулов в контрольной группе и группе, получавшей СТХ, представлена в таблице 7. Достоверных различий в уровнях АМГ в сыворотке не наблюдалось в контрольной группе у мышей в возрасте 8–13 недель, а также у мышей. в возрасте 8 недель (прехимиотерапия) в каждой группе. В группе 200 мг/кг CTX уровни АМГ в сыворотке со временем значительно снижались ( P <0,0001).
05). Рост опухолей в группе СТХ 100 мг/кг был аналогичен наблюдаемому в контрольной группе, тогда как рост опухоли в группе СТХ 200 мг/кг замедлялся более эффективно (контроль по сравнению с СТХ200, P <0,0001). Тенденции уровней АМГ в сыворотке и количества примордиальных фолликулов и растущих фолликулов голых мышей Balb/c с раком молочной железы в возрасте 8 недель (до химиотерапии), 9 недель (1 неделя после введения КТ или физиологического раствора), 11 недель (3 недели после КТ или введение физиологического раствора) и 13 недель (5 недель после введения CTX или физиологического раствора) показаны на рис. 3A–C.Взаимосвязь между уровнями АМГ в сыворотке и числом фолликулов в контрольной группе и группе, получавшей СТХ, представлена в таблице 7. Достоверных различий в уровнях АМГ в сыворотке не наблюдалось в контрольной группе у мышей в возрасте 8–13 недель, а также у мышей. в возрасте 8 недель (прехимиотерапия) в каждой группе. В группе 200 мг/кг CTX уровни АМГ в сыворотке со временем значительно снижались ( P <0,0001). Интересно, что в группе, принимавшей 100 мг/кг СТХ, уровни АМГ в сыворотке были немного повышены в возрасте 9 недель, но резко снизились в возрасте 11 недель, после чего в конечном итоге вновь увеличились в возрасте 13 недель.Более того, количество примордиальных фолликулов постоянно уменьшалось с течением времени в каждой группе ( P < 0,0001), тогда как в группе 200 мг/кг СТХ тенденция к снижению была резкой. Количество растущих фолликулов всегда коррелировало с изменением уровня АМГ в сыворотке крови. Изменения количества растущих фолликулов были выявлены с помощью срезов H&E (рис. 3D).
Интересно, что в группе, принимавшей 100 мг/кг СТХ, уровни АМГ в сыворотке были немного повышены в возрасте 9 недель, но резко снизились в возрасте 11 недель, после чего в конечном итоге вновь увеличились в возрасте 13 недель.Более того, количество примордиальных фолликулов постоянно уменьшалось с течением времени в каждой группе ( P < 0,0001), тогда как в группе 200 мг/кг СТХ тенденция к снижению была резкой. Количество растущих фолликулов всегда коррелировало с изменением уровня АМГ в сыворотке крови. Изменения количества растущих фолликулов были выявлены с помощью срезов H&E (рис. 3D).
Таблица 7 Сравнение уровней АМГ и количества фолликулов в контрольной группе и группе, получавшей CTX (тест ANOVA) |
Рисунок 3 Уровни АМГ в сыворотке и количество фолликулов в яичниках у голых мышей Balb/c.( A ) Уровни АМГ в сыворотке оставались стабильными в контрольной группе и были значительно снижены в группе CTX 200 мг/кг ( P <0,0001). |
Обсуждение
Степень повреждения яичников, вызванного химиотерапией, зависит от возраста пациента, химиотерапевтического агента, схемы приема и дозы препарата. 30 Алкилирующие агенты являются наиболее гонадотоксичными из химиотерапевтических препаратов, токсичность которых снижается в порядке уменьшения токсичности аналогов платины, таксанов, растительных алкалоидов, антрациклинов и антиметаболитов, которые обычно считаются негонадотоксичными. 31 Примордиальные фолликулы более чувствительны к неспецифическим агентам клеточного цикла, таким как алкилирующие агенты и ингибиторы топоизомеразы, в то время как антиметаболиты в основном воздействуют на развивающиеся фолликулы, не изменяя пул спящих фолликулов. 30 Как у человека, так и у мышей снижение фертильности тесно связано с уменьшением пула примордиальных фолликулов. Кроме того, цитотоксические препараты, особенно CTX, вызывают разрушение различных фолликулов, особенно примордиальных фолликулов. 32–34 Повреждение, вызванное CTX, в конечном итоге приведет к дисфункции яичников. Сообщалось, что CTX напрямую повреждает фолликулы посредством алкилирования ДНК и последующего нарушения нормальных клеточных процессов, а также истощает примордиальные фолликулы посредством разрушения ооцитов и клеток гранулезы. 15,35 В отсутствие АМГ истощение фолликулов яичников ускорялось из-за повышенного рекрутирования примордиальных фолликулов в растущие фолликулы.
31 Примордиальные фолликулы более чувствительны к неспецифическим агентам клеточного цикла, таким как алкилирующие агенты и ингибиторы топоизомеразы, в то время как антиметаболиты в основном воздействуют на развивающиеся фолликулы, не изменяя пул спящих фолликулов. 30 Как у человека, так и у мышей снижение фертильности тесно связано с уменьшением пула примордиальных фолликулов. Кроме того, цитотоксические препараты, особенно CTX, вызывают разрушение различных фолликулов, особенно примордиальных фолликулов. 32–34 Повреждение, вызванное CTX, в конечном итоге приведет к дисфункции яичников. Сообщалось, что CTX напрямую повреждает фолликулы посредством алкилирования ДНК и последующего нарушения нормальных клеточных процессов, а также истощает примордиальные фолликулы посредством разрушения ооцитов и клеток гранулезы. 15,35 В отсутствие АМГ истощение фолликулов яичников ускорялось из-за повышенного рекрутирования примордиальных фолликулов в растущие фолликулы. 25,36
25,36
Хотя сообщалось, что острое разрушение фолликулов яичников, вызванное CTX, нельзя предсказать по уровням АМГ в сыворотке, 25 согласно нашему исследованию, возникновение аменореи, вызванной химиотерапией, отрицательно коррелировало с уровнями АМГ и Е2 до химиотерапии, и положительно коррелировал с дохимиотерапевтическим уровнем ФСГ.Кроме того, восстановление менструаций через 1 год после химиотерапии положительно коррелировало с уровнями АМГ до и после химиотерапии, хотя не коррелировало с уровнями Е2 и ФСГ до химиотерапии. Эти результаты подразумевают, что пациентки с более высоким уровнем АМГ с меньшей вероятностью имеют аменорею и с большей вероятностью вернутся к нормальным менструациям, даже после химиотерапии, тогда как пациенты с более низким уровнем АМГ с большей вероятностью будут иметь аменорею и с меньшей вероятностью восстановят менструальный цикл после аменореи. 24 Хотя уровни Е2 и ФСГ до химиотерапии коррелировали с аменореей, мы не обнаружили корреляции между ними и восстановлением менструального цикла после химиотерапии, что соответствовало нашей гипотезе; то есть уровни Е2 и ФСГ сильно колеблются в течение физиологического цикла, в то время как уровни АМГ относительно стабильны 4 . Дальнейший стратифицированный анализ дал интересные результаты: в нашем клиническом исследовании не было выявлено существенных изменений уровня АМГ у молодых пациентов, прошедших химиотерапию, тогда как уровни АМГ резко снизились у пациентов старше 35 лет, получавших химиотерапию. 37,38 Таким образом, у более молодых пациенток достаточный резерв примордиальных фолликулов и сильная способность к компенсации приводили к стабильным уровням АМГ. Таким образом, уровень АМГ в сыворотке как биомаркер для прогнозирования функции яичников представляется более точным у женщин, получающих химиотерапию, старше 35 лет, по сравнению с более молодыми женщинами (<35 лет).
Дальнейший стратифицированный анализ дал интересные результаты: в нашем клиническом исследовании не было выявлено существенных изменений уровня АМГ у молодых пациентов, прошедших химиотерапию, тогда как уровни АМГ резко снизились у пациентов старше 35 лет, получавших химиотерапию. 37,38 Таким образом, у более молодых пациенток достаточный резерв примордиальных фолликулов и сильная способность к компенсации приводили к стабильным уровням АМГ. Таким образом, уровень АМГ в сыворотке как биомаркер для прогнозирования функции яичников представляется более точным у женщин, получающих химиотерапию, старше 35 лет, по сравнению с более молодыми женщинами (<35 лет).
Не было достигнуто единого мнения относительно того, можно ли использовать АМГ в качестве предиктора функции яичников у женщин, проходящих химиотерапию, особенно у более молодых пациенток. 37–39 Хотя исследования показали, что АМГ не имеет большого значения для прогнозирования функции яичников у несовершеннолетних пациенток, получающих химиотерапию, разумного объяснения этому наблюдению предложено не было. 25,26,37,39 В нашем исследовании здоровых женщин уровень АМГ в сыворотке крови демонстрировал устойчивую тенденцию к снижению с возрастом у женщин старше 35 лет; однако он оставался относительно стабильным у женщин моложе 35 лет. Следовательно, АМГ не может быть точным и подходящим биомаркером овариального резерва у молодых женщин. 40,41 Мы получили аналогичный результат в исследовании на мышах, в котором уровни АМГ в сыворотке снижались с возрастом у мышей после повышения в течение первых 6 месяцев. Последующее исследование показало, что количество растущих фолликулов тесно связано с количеством примордиальных фолликулов и уровнем АМГ в сыворотке. У мышей старше 8 мес как уровень АМГ в сыворотке, так и количество растущих фолликулов неуклонно снижались, что согласуется с мнением Шеффера и соавт. 41 Кроме того, в эксперименте с токсичностью на мышах количество примордиальных фолликулов последовательно уменьшалось со временем в каждой группе ( P < 0.
25,26,37,39 В нашем исследовании здоровых женщин уровень АМГ в сыворотке крови демонстрировал устойчивую тенденцию к снижению с возрастом у женщин старше 35 лет; однако он оставался относительно стабильным у женщин моложе 35 лет. Следовательно, АМГ не может быть точным и подходящим биомаркером овариального резерва у молодых женщин. 40,41 Мы получили аналогичный результат в исследовании на мышах, в котором уровни АМГ в сыворотке снижались с возрастом у мышей после повышения в течение первых 6 месяцев. Последующее исследование показало, что количество растущих фолликулов тесно связано с количеством примордиальных фолликулов и уровнем АМГ в сыворотке. У мышей старше 8 мес как уровень АМГ в сыворотке, так и количество растущих фолликулов неуклонно снижались, что согласуется с мнением Шеффера и соавт. 41 Кроме того, в эксперименте с токсичностью на мышах количество примордиальных фолликулов последовательно уменьшалось со временем в каждой группе ( P < 0. 0001), тогда как в группе, принимавшей 200 мг/кг СТХ, тенденция к снижению была резкой. Количество растущих фолликулов всегда соответствовало изменению уровня АМГ в сыворотке крови. Исследование, о котором сообщили Луан и др., не обнаружило значительного увеличения количества первичных или вторичных фолликулов у мышей; однако наблюдалось значительное увеличение соотношения растущих фолликулов к спящим фолликулам после нескольких циклов лечения СТХ. 42 Это может быть связано с потерей спящих фолликулов, в то время как количество растущих фолликулов остается прежним.Соответственно, снижение уровней АМГ в сыворотке наблюдалось в течение 3 дней после введения СТХ, но эти значения возвращались к уровням, сходным с таковыми у мышей, получавших носитель, через 7 дней после лечения. 42 Эти результаты свидетельствуют о том, что у неполовозрелых самок мышей и женщин уровни АМГ повышаются из-за увеличения числа растущих фолликулов. В дальнейшем количество растущих фолликулов остается постоянным в течение раннего репродуктивного периода у самок, что сопровождается постоянными уровнями АМГ.
0001), тогда как в группе, принимавшей 200 мг/кг СТХ, тенденция к снижению была резкой. Количество растущих фолликулов всегда соответствовало изменению уровня АМГ в сыворотке крови. Исследование, о котором сообщили Луан и др., не обнаружило значительного увеличения количества первичных или вторичных фолликулов у мышей; однако наблюдалось значительное увеличение соотношения растущих фолликулов к спящим фолликулам после нескольких циклов лечения СТХ. 42 Это может быть связано с потерей спящих фолликулов, в то время как количество растущих фолликулов остается прежним.Соответственно, снижение уровней АМГ в сыворотке наблюдалось в течение 3 дней после введения СТХ, но эти значения возвращались к уровням, сходным с таковыми у мышей, получавших носитель, через 7 дней после лечения. 42 Эти результаты свидетельствуют о том, что у неполовозрелых самок мышей и женщин уровни АМГ повышаются из-за увеличения числа растущих фолликулов. В дальнейшем количество растущих фолликулов остается постоянным в течение раннего репродуктивного периода у самок, что сопровождается постоянными уровнями АМГ. Однако с возрастом уровень АМГ в сыворотке крови постепенно снижается, что сопровождается уменьшением числа растущих фолликулов у женщин.
Однако с возрастом уровень АМГ в сыворотке крови постепенно снижается, что сопровождается уменьшением числа растущих фолликулов у женщин.
регулирует скорость рекрутирования примордиальных фолликулов для дальнейшего роста, а рекрутирование примордиальных фолликулов ингибируется присутствием АМГ в зрелых яичниках. 4,7,36 У молодых женщин, поскольку фолликулы в основном представляют собой примордиальные фолликулы, АМГ не может точно оценить функциональное нарушение яичников.Однако у молодых взрослых, даже если растущие фолликулы были в значительной степени уничтожены химиотерапевтическими препаратами, оставшиеся растущие фолликулы и своевременное пополнение примордиального фолликулярного пула поддерживали стабильность АМГ; таким образом, уровень АМГ в сыворотке не точно отражал степень повреждения функции яичников. И наоборот, АМГ может точно отражать нарушение функции яичников у женщин среднего и пожилого возраста из-за их ограниченного овариального резерва. 40,43
Заключение
Согласно нашим исследованиям, АМГ является эффективным биомаркером для прогнозирования функции яичников у женщин в пременопаузе с раком молочной железы, получающих химиотерапию, хотя и исключительно у женщин старше 35 лет. АМГ как предиктор функции яичников и средство защиты яичников заслуживает дальнейшего изучения. 18,29 Таким образом, АМГ можно использовать не только как прогностический и оценочный показатель функции яичников у женщин в пременопаузе с множественными опухолями, но и как потенциальную терапевтическую мишень.
АМГ как предиктор функции яичников и средство защиты яичников заслуживает дальнейшего изучения. 18,29 Таким образом, АМГ можно использовать не только как прогностический и оценочный показатель функции яичников у женщин в пременопаузе с множественными опухолями, но и как потенциальную терапевтическую мишень.
Сокращения
АМГ, антимюллеровский гормон; MIS, мюллеровское ингибирующее вещество; ЭКО, экстракорпоральное оплодотворение; СПКЯ, синдром поликистозных яичников; СТХ, циклофосфамид; POF, преждевременная недостаточность яичников; ФСГ, фолликулостимулирующий гормон; ЛГ, лютеинизирующий гормон; Е2, эстрадиол; TNBC, тройной негативный рак молочной железы.
Заявление об обмене данными
Любые данные, предназначенные для совместного использования, деидентифицируются.
Одобрение этики и информированное согласие
Исследование было одобрено Комитетом по институциональным исследованиям, Комитетом по этике и благополучию животных Шанхайского университета Цзяо Тонг, входящего в состав Шестой народной больницы Шанхая.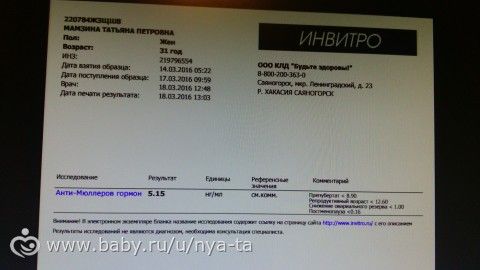 Все пациенты дали согласие до включения в исследование.
Все пациенты дали согласие до включения в исследование.
Благодарности
Мы хотели бы поблагодарить все клинические подразделения и участников, участвовавших в этом исследовании.Мы также хотели бы поблагодарить FSeditor за редактирование на английском языке.
Комиссия по науке и технологиям медицинской программы муниципалитета Шанхая Программа исследования рака Чжэцзянского медицинского общества Этот проект финансировался Комиссией по науке и технике Шанхайского муниципалитета по медицинской программе 15411966500 и программой исследований рака 2015ZYC-A07 Медицинского общества Чжэцзян.Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Каталожные номера
1.Кейт Р.Л., Матталиано Р.Дж., Хессион С. и др. Выделение бычьего и человеческого генов мюллеровского ингибирующего вещества и экспрессия человеческого гена в клетках животных. Сотовый . 1986;45(5):685–698. дои: 10.1016/0092-8674(86)
-X 2. Behringer RR, Finegold MJ, Cate RL. Функция вещества, ингибирующего Мюллера, во время полового развития млекопитающих. Сотовый . 1994;79(3):415–425. дои: 10.1016/0092-8674(94)
Behringer RR, Finegold MJ, Cate RL. Функция вещества, ингибирующего Мюллера, во время полового развития млекопитающих. Сотовый . 1994;79(3):415–425. дои: 10.1016/0092-8674(94)
3. Джоссо Н., Клементе Н. Путь трансдукции антимюллерова гормона, специфичного для пола члена семейства TGF-бета. Trends Endocrinol Metab . 2003;14(2):91–97. дои: 10.1016/S1043-2760(03)00005-5
4. Кевенаар М.Е., Мирасахиб М.Ф., Крамер П. и соавт. Уровни антимюллерова гормона в сыворотке отражают размер пула примордиальных фолликулов у мышей. Эндокринология . 2006;147(7):3228–3234. doi:10.1210/en.2005-1588
5. Weenen C, Laven JSE, Von Bergh ARM, et al. Паттерн экспрессии антимюллерова гормона в яичниках человека: потенциальные последствия для начального и циклического набора фолликулов. Моль Гум Репрод . 2004;10(2):77–83. doi: 10.1093/моль-час/gah015
6. Behringer RR, Cate RL, Froelick GJ, Palmiter RD, Brinster RL. Аномальное половое развитие у трансгенных мышей, хронически экспрессирующих мюллеровское ингибирующее вещество. Природа . 1990;345(6271):167–170. дои: 10.1038/345167a0
Природа . 1990;345(6271):167–170. дои: 10.1038/345167a0
7. Durlinger ALL, Gruijters MJG, Piet K, et al. Антимюллеровский гормон ингибирует инициацию роста примордиальных фолликулов в яичниках мышей. Эндокринология .2002;143(3):1076–1084. дои: 10.1210/эндо.143.3.8691
8. Wang S, Zhang Y, Mensah V, Huber WJ, Huang YT, Alvero R. Дискордантность антимюллерова гормона (AMH) и фолликулостимулирующего гормона (FSH) у женщин, подвергающихся экстракорпоральному оплодотворению (ЭКО): какой из них является лучший предиктор живорождения? J Резистентность яичников . 2018;11(1):60. doi: 10.1186/s13048-018-0430-z
9. Dewailly D, Laven J. AMH как первичный маркер фертильности. Евро J Эндокринол . 2019;181(6):D45–D51.дои: 10.1530/EJE-19-0373
10. Гарг Д., Тал Р. Роль АМГ в патофизиологии синдрома поликистозных яичников. Reprod Biomed Online . 2016;33(1):15–28. doi:10.1016/j.rbmo.2016.04.007
11. Fredholm H, Eaker S, Frisell J, Holmberg L, Fredriksson I, Lindman H. Рак молочной железы у молодых женщин: плохая выживаемость, несмотря на интенсивное лечение. PLoS Один . 2009;4(11):e7695. doi:10.1371/journal.pone.0007695
Рак молочной железы у молодых женщин: плохая выживаемость, несмотря на интенсивное лечение. PLoS Один . 2009;4(11):e7695. doi:10.1371/journal.pone.0007695
12. DeSantis CE, Ma J, Gaudet MM, et al.Статистика рака молочной железы, 2019 г. CA Cancer J Clin . 2019;69(6):438–451. doi:10.3322/caac.21583
13. Розенберг С.М., Партридж А.Х. Лечение рака молочной железы у очень молодых женщин. Грудь . 2015; 24 (Приложение 2): S154–S158. doi:10.1016/j.breast.2015.07.036
14. Сониго С., Бо И., Бинар Н., Гринберг М. Влияние химиотерапии на яичники: молекулярные аспекты и профилактика повреждения яичников. Int J Mol Sci . 2019;20(21):21. дои: 10.3390/ijms20215342
15.Бедоски Г., Наварро П.А., Октай К. Повреждение яичников, вызванное химиотерапией: механизмы и клиническое воздействие. Онкол будущего . 2016;12(20):2333–2344. doi:10.2217/fon-2016-0176
16. Broer SL, van Dissseldorp J, Broeze KA, et al. Добавленная ценность тестирования овариального резерва на характеристики пациенток в прогнозировании реакции яичников и продолжающейся беременности: индивидуальный подход к данным пациенток. Обновление воспроизведения шума . 2013;19(1):26–36. дои: 10.1093/humupd/dms041
Обновление воспроизведения шума . 2013;19(1):26–36. дои: 10.1093/humupd/dms041
17.Таль Р., Сейфер Д.Б. Тестирование овариального резерва: руководство пользователя. Am J Obstet Gynecol . 2017;217(2):129–140. doi:10.1016/j.ajog.2017.02.027
18. Steiner AZ, Pritchard D, Stanczyk FZ, et al. Ассоциация биомаркеров овариального резерва и бесплодия у пожилых женщин репродуктивного возраста. ЯМА . 2017;318(14):1367–1376. дои: 10.1001/jama.2017.14588
19. Ульрих Н.Д., Марш Е.Е. Тестирование овариального резерва: обзор вариантов, их применения и ограничений. Клин Акушерство Гинекол . 2019;62(2):228–237. doi:10.1097/GRF.0000000000000445
20. Gracia CR, Shin SS, Prewitt M, et al. Многоцентровая клиническая оценка анализа доступа к АМГ для определения уровней АМГ у женщин репродуктивного возраста во время нормальных менструальных циклов. J Assist Reprod Genet . 2018;35(5):777–783. doi: 10.1007/s10815-018-1141-5
21. Dezellus A, Barriere P, Campone M, et al. Проспективная оценка динамики антимюллерова гормона в сыворотке крови у 250 женщин репродуктивного возраста, получавших химиотерапию по поводу рака молочной железы. Евр J Рак . 2017;79:72–80. doi:10.1016/j.ejca.2017.03.035
Dezellus A, Barriere P, Campone M, et al. Проспективная оценка динамики антимюллерова гормона в сыворотке крови у 250 женщин репродуктивного возраста, получавших химиотерапию по поводу рака молочной железы. Евр J Рак . 2017;79:72–80. doi:10.1016/j.ejca.2017.03.035
22. Фреур Т., Барьер П., Массон Д. Уровни антимюллерова гормона и эволюция у женщин репродуктивного возраста с раком молочной железы, получавших химиотерапию. Евр J Рак . 2017; 74:1–8. doi:10.1016/j.ejca.2016.12.008
23. Zhong Y, Lin Y, Cheng X, et al. ГнРГ для защиты яичников и связь между АМГ и функцией яичников во время адъювантной химиотерапии рака молочной железы. J Рак .2019;10(18):4278–4285. doi:10.7150/jca.31859
24. Kim H-A, Choi J, Park CS, et al. Постхимиотерапевтический уровень антимюллерова гормона в сыворотке предсказывает восстановление функции яичников. Endocr Connect . 2018;7(8):949–956. дои: 10.1530/EC-18-0180
25. Browne HN, Moon KS, Mumford SL, et al.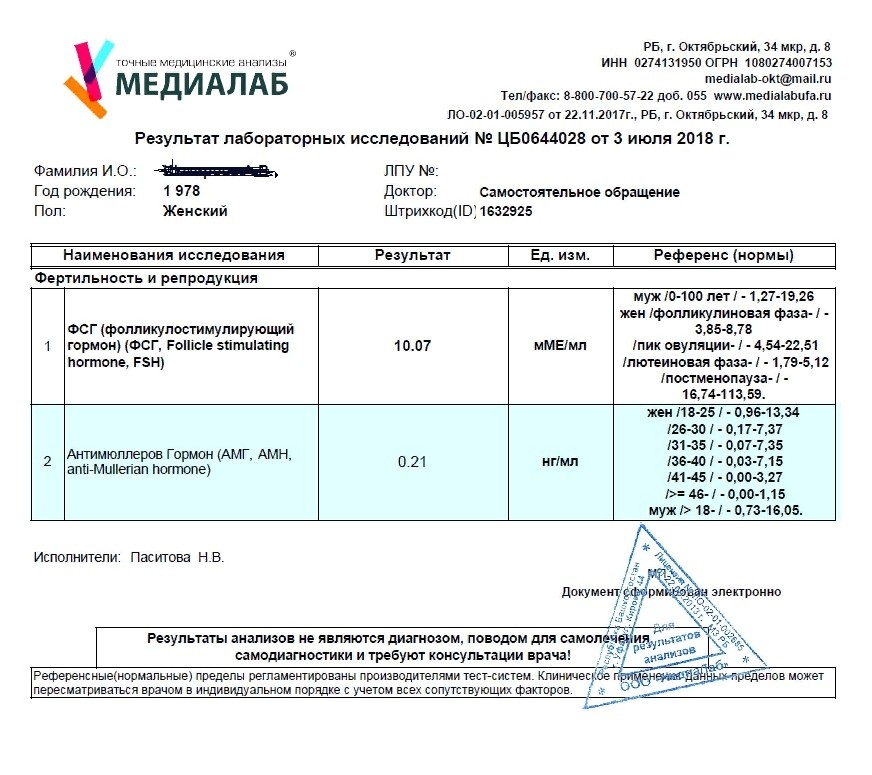 Является ли антимюллеровский гормон маркером острой деструкции фолликулов яичников, вызванной циклофосфамидом, у мышей, предварительно получавших цетрореликс? Fertil Steril . 2011;96(1):180–186.e2.doi:10.1016/j.fertnstert.2011.04.008
Является ли антимюллеровский гормон маркером острой деструкции фолликулов яичников, вызванной циклофосфамидом, у мышей, предварительно получавших цетрореликс? Fertil Steril . 2011;96(1):180–186.e2.doi:10.1016/j.fertnstert.2011.04.008
26. Детти Л., Ульманн Р.А., Лу М. и соавт. Сывороточные маркеры овариального резерва и гистология яичников у взрослых мышей, получавших циклофосфамид в препубертатном возрасте. J Assist Reprod Genet . 2013;30(11):1421–1429. doi: 10.1007/s10815-013-0087-x
27. Koga C, Akiyoshi S, Ishida M, Nakamura Y, Ohno S, Tokunaga E. Вызванная химиотерапией аменорея и возобновление менструации у женщин в пременопаузе с гормональным рецептор-позитивным ранним раком молочной железы. Рак молочной железы . 2017;24(5):714–719. doi: 10.1007/s12282-017-0764-1
28. Meirow D, Lewis H, Nugent D, Epstein M. Субклиническое истощение первичных фолликулярных резервов у мышей, получавших циклофосфамид: клиническое значение и предлагаемый точный инструмент исследования. Репродукция шума . 1999; 14 (7): 1903–1907. doi:10.1093/humrep/14.7.1903
Репродукция шума . 1999; 14 (7): 1903–1907. doi:10.1093/humrep/14.7.1903
29. Кано М., Сосульский А.Е., Чжан Л. и соавт. АМГ/МИС в качестве противозачаточного средства, защищающего овариальный резерв во время химиотерапии. Proc Natl Acad Sci U S A . 2017;114(9):E1688–E1697. doi:10.1073/pnas.1620729114
30. Мейроу Д., Бидерман Х., Андерсон Р.А., Уоллес У.Б. Токсичность химиотерапии и облучения для женской репродукции. Клин Акушерство Гинекол . 2010;53(4):727–739. дои: 10.1097/GRF.0b013e3181f96b54
31. Roness H, Kashi O, Meirow D. Профилактика повреждения яичников, вызванного химиотерапией. Fertil Steril . 2016;105(1):20–29. doi:10.1016/j.fertnstert.2015.11.043
32.Калич-Философ Л., Ронесс Х., Кармели А. и др. Циклофосфамид вызывает активацию и «выгорание» фолликулов; AS101 предотвращает потерю фолликулов и сохраняет фертильность. Sci Transl Med . 2013;5(185):185ra162–185ra162. doi:10.1126/scitranslmed. 3005402
3005402
33. Chen X-Y, Xia H-X, Guan H-Y, Li B, Zhang W. Потеря фолликулов и апоптоз у мышей, получавших циклофосфамид: в чем дело? Int J Mol Sci . 2016;17(6).
34. Sonigo C, Beau I, Grynberg M, Binart N. AMH предотвращает потерю первичных фолликулов яичников и изменение фертильности у мышей, получавших циклофосфамид. ФАСЭБ Дж . 2019;33(1):1278–1287. doi:10.1096/fj.201801089R
35. Нгуен К.Н., Зерафа Н., Лью С.Х., Финдли Дж.К., Хики М., Хатт К.Дж. Вызванное цисплатином и циклофосфамидом истощение примордиальных фолликулов вызвано прямым повреждением ооцитов. Моль Гум Репрод . 2019;25(8):433–444. doi: 10.1093/моль час/газ020
36. Durlinger AL, Kramer P, Karels B, et al. Контроль рекрутирования примордиальных фолликулов с помощью антимюллерова гормона в яичниках мышей. Эндокринология .1999;140(12):5789–5796. дои: 10.1210/эндо.140.12.7204
37. Decanter C, Morschhauser F, Pigny P, Lefebvre C, Gallo C, Dewailly D.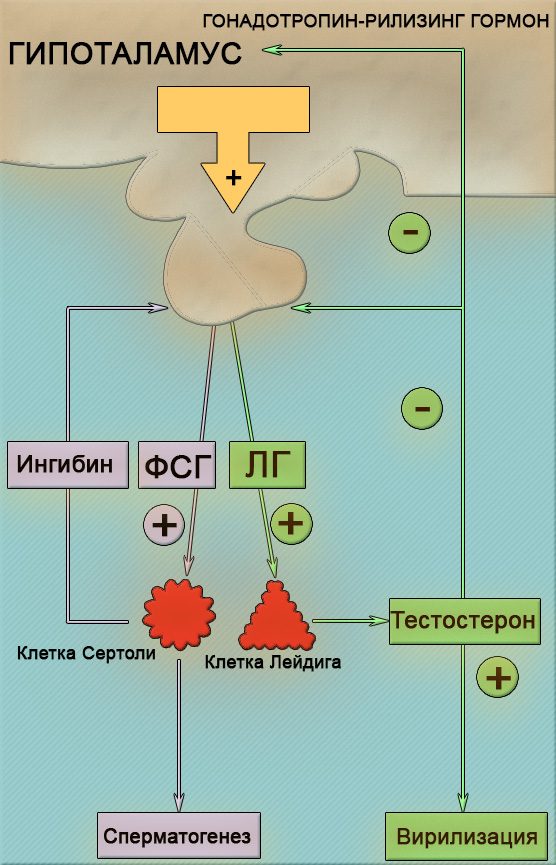 Последующее наблюдение за антимюллеровым гормоном у молодых женщин, получавших химиотерапию по поводу лимфомы: предварительные результаты. Reprod Biomed Online . 2010;20(2):280–285. doi:10.1016/j.rbmo.2009.11.010
Последующее наблюдение за антимюллеровым гормоном у молодых женщин, получавших химиотерапию по поводу лимфомы: предварительные результаты. Reprod Biomed Online . 2010;20(2):280–285. doi:10.1016/j.rbmo.2009.11.010
38. van Beek RD, van den Heuvel-eibrink MM, Laven JSE, et al. Антимюллеровский гормон является чувствительным сывороточным маркером функции гонад у женщин, лечившихся от лимфомы Ходжкина в детстве. J Clin Endocrinol Metab . 2007;92(10):3869–3874. doi:10.1210/jc.2006-2374
39. Lutchman Singh K, Muttukrishna S, Stein RC, et al. Предикторы овариального резерва у молодых женщин с раком молочной железы. Бр J Рак . 2007; 96 (12): 1808–1816. doi:10.1038/sj.bjc.6603814
40. Вонг QHY, Андерсон Р.А. Роль антимюллерова гормона в оценке повреждения яичников при химиотерапии, лучевой терапии и хирургическом вмешательстве. Curr Opin Endocrinol Diabetes Obes . 2018;25(6):391–398.doi:10.1097/MED.0000000000000447
41./90/2.png) Scheffer GJ, Broekmans FJM, Looman CWN, et al. Количество антральных фолликулов у здоровых женщин с доказанной фертильностью лучше всего отражает репродуктивный возраст. Репродукция шума . 2003;18(4):700–706. doi:10.1093/humrep/deg135
Scheffer GJ, Broekmans FJM, Looman CWN, et al. Количество антральных фолликулов у здоровых женщин с доказанной фертильностью лучше всего отражает репродуктивный возраст. Репродукция шума . 2003;18(4):700–706. doi:10.1093/humrep/deg135
42. Луан Ю., Эдмондс М.Е., Вудрафф Т.К., Ким С.Ю. Ингибиторы апоптоза защищают овариальный резерв от циклофосфамида. J Эндокринол . 2019;240(2):243–256. doi: 10.1530/JOE-18-0370
43.Bozza C, Puglisi F, Lambertini M, Osa EO, Manno M, Del Mastro L. Антимюллеровский гормон: определение овариального резерва у больных раком молочной железы на ранней стадии. Endocr Relat Рак . 2014;21(1):R51–R65. дои: 10.1530/ERC-13-0335
Какова роль гормонов АМГ и MIS в исследовании гранулезоклеточных опухолей (ГКО) яичников
Коттаратхил В.Д., Энтони М.А., Наир И.Р., Павитран К. Последние достижения в области гранулезоклеточной опухоли яичников: обзор. Индийский J Surg Oncol . 2013 март 4 (1): 37-47. [Медлайн]. [Полный текст].
2013 март 4 (1): 37-47. [Медлайн]. [Полный текст].
Шах С.П., Кобель М., Сенз Дж., Морин Р.Д., Кларк Б.А., Виганд К.С. Мутация FOXL2 при гранулезоклеточных опухолях яичника. N Английский J Med . 2009 25 июня. 360(26):2719-29. [Медлайн].
Анттонен М., Пихлайоки М., Андерссон Н. и др. FOXL2, GATA4 и SMAD3 совместно модулируют экспрессию генов, жизнеспособность клеток и апоптоз в опухолевых клетках гранулёзных клеток яичников. PLoS Один .2014. 9(1):e85545. [Медлайн]. [Полный текст].
Lappohn RE, Burger HG, Bouma J, Bangah M, Krans M, de Bruijn HW. Ингибин как маркер гранулезоклеточных опухолей. N Английский J Med . 1989, 21 сентября. 321(12):790-3. [Медлайн].
Robertson DM, Stephenson T, Pruysers E. Характеристика форм ингибина и их измерение с помощью ELISA альфа-субъединицы ингибина в сыворотке женщин в постменопаузе с раком яичников. J Clin Endocrinol Metab .2002 г., февраль 87(2):816-24. [Медлайн].
J Clin Endocrinol Metab .2002 г., февраль 87(2):816-24. [Медлайн].
Миллер Б.Э., Бэррон Б.А., Ван Дж.Ю. Прогностические факторы гранулезоклеточной опухоли яичника у взрослых. Рак . 1997 15 мая. 79(10):1951-5. [Медлайн].
Али Хель-С, Китахара Г., Нибе К., Ямагучи Р., Хории Ю., Заабель С. и др. Плазменный антимюллеровский гормон как биомаркер опухолей гранулезо-тека клеток крупного рогатого скота: сравнение с иммунореактивным ингибином и концентрациями стероидов в яичниках. Териогенология .2013 ноябрь 80(8):940-9. [Медлайн].
Лейн А.Х., Ли М.М., Фуллер А.Ф. младший. Диагностическая ценность определения мюллеровского ингибирующего вещества у пациентов с первичными и рецидивирующими гранулезоклеточными опухолями. Гинекол Онкол . 1999 г., апрель 73 (1): 51–55. [Медлайн].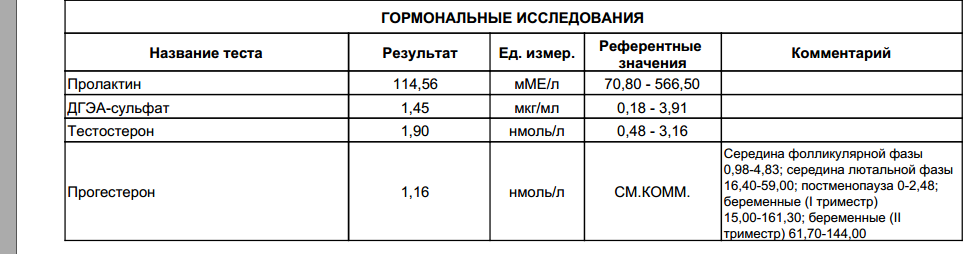
Long WQ, Ranchin V, Pautier P. Обнаружение минимальных уровней сывороточного антимюллерова гормона во время наблюдения за пациентами с гранулезоклеточной опухолью яичников с помощью высокочувствительного твердофазного иммуноферментного анализа. J Clin Endocrinol Metab . 2000 фев. 85(2):540-4. [Медлайн].
Anttonen M, Unkila-Kallio L, Leminen A, Butzow R, Heikinheimo M. Высокая экспрессия GATA-4 связана с агрессивным поведением, тогда как низкая экспрессия антимюллерова гормона связана с потенциалом роста гранулезоклеточных опухолей яичников. J Clin Endocrinol Metab . 2005 г., декабрь 90 (12): 6529-35. [Медлайн].
Янг Р.Х., Скалли Р.Э. Стромальные, стероидноклеточные и другие опухоли яичников полового тяжа с эндокринными, параэндокринными и паранеопластическими проявлениями.Курман Р. Дж., изд. Патология женских половых органов по Блауштейну . 4-е изд. Нью-Йорк, штат Нью-Йорк: Springer-Verlag; 1994. 783-847.
Дж., изд. Патология женских половых органов по Блауштейну . 4-е изд. Нью-Йорк, штат Нью-Йорк: Springer-Verlag; 1994. 783-847.
Вольф Дж.К., Маллен Дж., Эйфель П.Дж. Лучевое лечение распространенной или рецидивирующей гранулезоклеточной опухоли яичника. Гинекол Онкол . 1999 Апрель 73 (1): 35-41. [Медлайн].
Hauspy J, Beiner ME, Harley I, Rosen B, Murphy J, Chapman W. Роль адъювантной лучевой терапии при гранулезоклеточных опухолях яичников. Int J Radiat Oncol Biol Phys . 2011 1 марта. 79 (3): 770-4. [Медлайн].
Коломбо Н., Парма Г., Зананьоло В., Инсинга А. Лечение опухолей стромальных клеток яичников. J Клин Онкол . 2007 10 июля. 25(20):2944-51. [Медлайн].
Сигл Б.Л., Энн П., Батлер С., Шахаби С. Гранулезноклеточная опухоль яичников: исследование Национальной базы данных по раку. Гинекол Онкол . 2017 авг. 146 (2): 285-291. [Медлайн].
Гинекол Онкол . 2017 авг. 146 (2): 285-291. [Медлайн].
Уйгун К., Айдинер А., Саип П.Гранулезноклеточная опухоль яичника: ретроспективный анализ 45 случаев. Am J Clin Oncol . 2003 26 октября (5): 517-21. [Медлайн].
Zanagnolo V, Pasinetti B, Sartori E. Клинический обзор 63 случаев стромальных опухолей полового тяжа. Eur J Gynaecol Oncol . 2004. 25(4):431-8. [Медлайн].
Браун Дж., Суд А.К., Диверс М.Т., Милоевич Л., Гершенсон Д.М. Паттерны метастазирования при опухолях стромы полового тяжа яичника: можно ли отказаться от рутинной стадийной лимфаденэктомии? Гинекол Онкол . 2009 Апрель 113 (1): 86-90. [Медлайн].
Тралл М.М., Палей П., Пайзер Э., Гарсия Р., Гофф Б.А. Закономерности распространения и рецидивов стромально-половых опухолей яичников.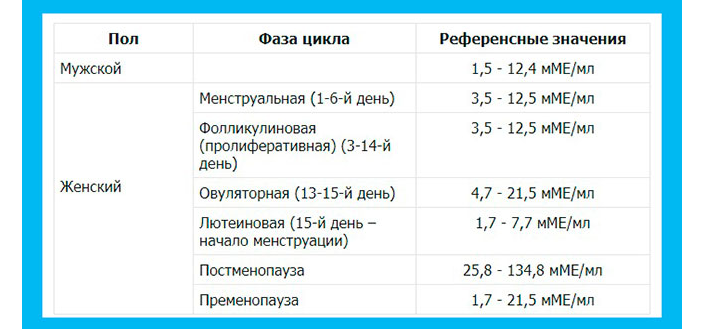 Гинекол Онкол . 2011 авг. 122(2):242-5. [Медлайн]. [Полный текст].
Гинекол Онкол . 2011 авг. 122(2):242-5. [Медлайн]. [Полный текст].
van Meurs HS, Buist MR, Westermann AM, Sonke GS, Kenter GG, van der Velden J. Эффективность химиотерапии при измеримых гранулезоклеточных опухолях: ретроспективное исследование и обзор литературы. Int J Gynecol Рак . 2014 24 марта (3): 496-505. [Медлайн].
Хоумсли Х.Д., Банди Б.Н., Херто Дж.А. Комбинированная терапия блеомицином, этопозидом и цисплатином гранулезоклеточных опухолей яичников и других стромальных злокачественных новообразований: исследование группы гинекологической онкологии. Гинекол Онкол . 1999 фев. 72(2):131-7. [Медлайн].
Пекорелли С., Вагенаар Х.К., Верготе И.Б. Комбинированная химиотерапия цисплатином (P), винбластином (V) и блеомицином (B) при рецидивирующих или распространенных гранулезо(-тека) клеточных опухолях яичника. Совместное групповое исследование гинекологического рака EORTC [опубликованная опечатка появляется в Eur J Cancer, 1999, декабрь;. Евр J Рак . 1999 г., 35 сентября (9): 1331-7. [Медлайн].
Совместное групповое исследование гинекологического рака EORTC [опубликованная опечатка появляется в Eur J Cancer, 1999, декабрь;. Евр J Рак . 1999 г., 35 сентября (9): 1331-7. [Медлайн].
Замбетти М., Эскобедо А., Пилотти С., Де Пало Г. Комбинированная химиотерапия цис-платином/винбластином/блеомицином при прогрессирующих или рецидивирующих гранулезоклеточных опухолях яичника. Гинекол Онкол . 1990 март 36 (3): 317-20. [Медлайн].
Коломбо Н., Парма Г., Франки Д.Режим активной химиотерапии при прогрессирующих опухолях стромы полового тяжа яичников. Гинекол Онкол . 1999 фев. 72(2):129-30. [Медлайн].
Тао Х, Суд А.К., Диверс М.Т., Шмелер К.М., Ник А.М., Коулман Р.Л. Антиангиогенная терапия бевацизумабом у пациенток с гранулезоклеточными опухолями яичников. Гинекол Онкол . 2009 г., сен. 114(3):431-6. [Медлайн].
2009 г., сен. 114(3):431-6. [Медлайн].
Briasoulis E, Karavasilis V, Pavlidis N. Активность мегестрола при рецидивирующей гранулезоклеточной опухоли яичника у взрослых. Энн Онкол . 1997 г. 8 августа (8): 811-2. [Медлайн].
Korach J, Perri T, Beiner M, Davidzon T, Fridman E, Ben-Baruch G. Многообещающее влияние ингибиторов ароматазы на рецидивирующие гранулезоклеточные опухоли. Int J Gynecol Рак . 2009 г. 19 июля (5): 830-3. [Медлайн].
Ламм В., Шифер А., Нёбауэр И.М., Хорват Р., Шпайзер П., Кёстлер В.Дж. Терапия ингибиторами ароматазы как эффективное средство спасения у пациента с рефрактерной к тамоксифену метастатической гранулезоклеточной опухолью яичника. J Клин Онкол . 2014 16 июня. [Medline].
Шим С.Х., Ли С. Дж., Ким Д.Ю., Ким Дж., Ким С.Н., Кан С.Б. и др. Долгосрочное последующее исследование 91 случая гранулезоклеточных опухолей яичников. Противораковый рез . 2014 г. 34 февраля (2): 1001-10. [Медлайн].
Дж., Ким Д.Ю., Ким Дж., Ким С.Н., Кан С.Б. и др. Долгосрочное последующее исследование 91 случая гранулезоклеточных опухолей яичников. Противораковый рез . 2014 г. 34 февраля (2): 1001-10. [Медлайн].
Мом CH, Engelen MJ, Willemse PH, Gietema JA, ten Hoor KA, de Vries EG. Гранулезноклеточные опухоли яичника: клиническое значение уровней ингибина А и В в сыворотке в большой когорте с одним центром. Гинекол Онкол . 2007 май. 105(2):365-72. [Медлайн].
ван Мерс Х.С., Шуит Э., Хорлингс Х.М., ван дер Вельден Дж., ван Дриэль В.Дж., Мол Б.В. и др. Разработка и внутренняя проверка прогностической модели для прогнозирования безрецидивной выживаемости у пациентов со взрослыми гранулезоклеточными опухолями яичника. Гинекол Онкол . 2014 сен. 134(3):498-504. [Медлайн].
Чжан М., Ченг М. К., Шин Д.Ю., Капп Д.С., Хусейн А., Тенг Н.Н. и др.Прогностические факторы, ответственные за выживаемость при опухолях стромы полового тяжа яичника — анализ 376 женщин. Гинекол Онкол . 2007 фев. 104 (2): 396-400. [Медлайн].
К., Шин Д.Ю., Капп Д.С., Хусейн А., Тенг Н.Н. и др.Прогностические факторы, ответственные за выживаемость при опухолях стромы полового тяжа яичника — анализ 376 женщин. Гинекол Онкол . 2007 фев. 104 (2): 396-400. [Медлайн].
Брюк С., Фарккиля А., Бютцов Р., Леминен А., Таппер Дж., Хейкинхеймо М. и др. Характеристики и исход рецидива молекулярно определяемых гранулезоклеточных опухолей яичников взрослого типа. Гинекол Онкол . 2016 Декабрь 143 (3): 571-577. [Медлайн].
Браун Дж., Шварцман Х.С., Диверс М.Т.Активность таксанов по сравнению с блеомицином, этопозидом и цисплатином при лечении опухолей полового тяжа и стромальных яичников. Гинекол Онкол . 2005 май. 97(2):489-96. [Медлайн].
Cronje HS, Niemand I, Bam RH. Гранулезные и тека-клеточные опухоли у детей: отчет о 17 случаях и обзор литературы. Акушерство Gynecol Surv . 1998 Апрель 53 (4): 240-7. [Медлайн].
Акушерство Gynecol Surv . 1998 Апрель 53 (4): 240-7. [Медлайн].
Cronje HS, Niemand I, Bam RH. Обзор гранулезо-текаклеточных опухолей из реестра опухолей яичников Эмиля Новака. Am J Obstet Gynecol . 1999, февраль 180 (2 часть 1): 323-7. [Медлайн].
East N, Alobaid A, Goffin F, Ouallouche K, Gauthier P. Гранулезноклеточная опухоль: рецидив через 40 лет после первоначального диагноза. J Obstet Gynaecol Банка . 27 апреля 2005 г. (4): 363-4. [Медлайн].
Evans AT 3rd, Gaffey TA, Malkasian GD Jr. Клинико-патологический обзор 118 гранулезных и 82 текаклеточных опухолей. Акушерство Гинекол . 1980 фев. 55(2):231-8.[Медлайн].
Фишман А., Куделка А.П., Тресукосол Д. Ацетат лейпролида для лечения рефрактерной или персистирующей гранулезоклеточной опухоли яичников. J Reprod Med . 1996 июнь 41(6):393-6. [Медлайн].
Freeman SA, Modesitt SC. Терапия анастрозолом при рецидивирующих гранулезоклеточных опухолях яичников у взрослых: отчет о 2 случаях. Гинекол Онкол . 2006 ноябрь 103(2):755-8. [Медлайн].
Гершенсон Д.М., Хартманн Л.С., Янг Р.Х.Опухоли стромы полового канатика яичников. Хоскинс В.Дж. и др., ред. Принципы и практика гинекологической онкологии . 4-е изд. Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс; 2005. 1011-34.
Джеймисон С., Фуллер П.Дж. Лечение гранулезоклеточной опухоли яичника. Карр Опин Онкол . 2008 сен. 20 (5): 560-4. [Медлайн].
Ko SF, Wan YL, Ng SH. Гранулезноклеточные опухоли яичников у взрослых: спектр сонографических и КТ-находок с патологической корреляцией. AJR Am J Рентгенол . 1999 май. 172(5):1227-33. [Медлайн].
La Marca A, Volpe A. Антимюллеровский гормон (АМГ) в женском воспроизводстве: является ли измерение циркулирующего АМГ полезным инструментом?. Клин Эндокринол (Oxf) . 2006 июнь 64(6):603-10. [Медлайн].
Лак Э.Э., Перес-Атайде А.Р., Мурти А.С. Текаклеточные опухоли гранулезы у девочек в пременархальном периоде: клиническое и патологоанатомическое исследование десяти случаев. Рак . 1981 г., 15 октября.48(8):1846-54. [Медлайн].
Ли В.Л., Юань К.С., Лай Ч.Р. Гемоперитонеум является начальным проявлением рецидивирующей гранулезоклеточной опухоли яичника. Jpn J Clin Oncol . 1999 29 октября (10): 509-12. [Медлайн].
МакЭвой Г.К., изд. AHFS Информация о лекарствах . Бетесда, Мэриленд: Американское общество фармацевтов системы здравоохранения; 2000.
Мом CH, Engelen MJ, Willemse PH, Gietema JA, ten Hoor KA, de Vries EG.Гранулезноклеточные опухоли яичника: клиническое значение уровней ингибина А и В в сыворотке в большой когорте с одним центром. Гинекол Онкол . 2007 май. 105(2):365-72. [Медлайн].
С.Р. Химиотерапевтические средства. Паздур Р., Хоскинс В.Х., Вагман Л., ред. Лечение рака: мультидисциплинарный подход . 4-е изд. Мелвилл, Нью-Йорк: PRR Incorporated; 2000. 971-80.
Пауэлл Дж.Л., Отис К.Н. Лечение распространенной ювенильной гранулезоклеточной опухоли яичника. Гинекол Онкол . 1997 фев. 64(2):282-4. [Медлайн].
Rey RA, Lhomme C, Marcillac I. Антимюллеровый гормон как сывороточный маркер гранулезоклеточных опухолей яичника: сравнительное исследование с сывороточным альфа-ингибином и эстрадиолом. Am J Obstet Gynecol . 1996 март 174(3):958-65. [Медлайн].
Робинсон Дж. Б., Им Д. Д., Логан Л. Внеовариальная гранулезоклеточная опухоль. Гинекол Онкол . 1999 г., июль 74 (1): 123-7. [Медлайн].
Рубин СК, Саббатини П., Рэндалл М.Э.Рак яичников. Паздур Р., Хоскинс В.Х., Вагман Л., ред. Лечение рака: мультидисциплинарный подход . 4-е изд. Мелвилл, Нью-Йорк: PRR Incorporated; 2000. 409-28.
Segal R, DePetrillo AD, Thomas G. Клинический обзор взрослых гранулезоклеточных опухолей яичника. Гинекол Онкол . 1995 март 56(3):338-44. [Медлайн].
Sehouli J, Drescher FS, Mustea A. Гранулезноклеточная опухоль яичника: данные наблюдения 65 пациентов за 10 лет. Противораковый рез . 2004 март-апрель. 24(2С):1223-9. [Медлайн].
Spencer HW, Mullings AM, Char G. Гранулезно-текаклеточная опухоль яичников. Поздняя метастазирующая опухоль. West Indian Med J . 1999 март 48(1):33-5. [Медлайн].
Виллелла Дж., Херрманн Ф.Р., Каул С., Леле С., Маркетти Д., Натиэлла Дж. Клинические и патологические прогностические факторы у женщин с гранулезоклеточной опухолью яичника взрослого типа. Int J Gynecol Pathol .26 апреля 2007 г. (2): 154–159. [Медлайн].
Янг Р.Х., Дикерсин Г.Р., Скалли Р.Э. Ювенильная гранулезоклеточная опухоль яичника. Клинико-патологический анализ 125 случаев. Ам Дж. Сург Патол . 1984 г. 8 августа (8): 575-96. [Медлайн].
я получил ТО по бесплодию. Это было не то, что я ожидал
Вскоре после того, как мне исполнилось 30, я впервые заметил, что мое чрево стало открытым форумом. Такие фразы, как «планы на будущее» и «зоны охвата», стали небрежно разбрасываться в разговорах, словно цепочка хлебных крошек, ведущих меня к конечной цели женщины: родильному отделению.
Когда я вышла замуж, плотина открылась, и тонкая инсинуация вскоре сменилась тревожно прямой. — У вас двоих есть дети? внезапно многие – на работе и в кругу друзей – сочли уместным вопрос. «Время идет», — прозвучало во время рождественского обеда. Меньше Белого Кролика, больше Капитана Крюка. Я больше не личность, я теперь просто матка на ногах.
Возможно, еще больше разочаровывает, чем грубая агрессивность всего этого, моя неспособность ответить с какой-либо убедительностью.В то время как движение за свободу от детей завоевало популярность среди миллениалов, гордо предпочитающих наслаждаться жизнью без бремени родительских обязанностей, а «антинаталистское» движение громко выпячивает достоинства воздержания от воспитания детей во имя экологической ответственности, я поддерживаю limbo, ни «без детей по выбору», ни «без детей на данный момент». Видите ли, я не знаю, хочу ли я детей. Я просто не могу решить.
Именно поиск ответа на этот вопрос привел меня к тому, что одним августовским утром во вторник я задрала ноги в стременах, когда профессор Ник Маклон, медицинский директор Женской клиники бесплодия, крутил внутри меня трансвагинальный ультразвук и выкрикивал цифры, как мы были в зале бинго.«Девять, 10 — ах да! Тринадцать.»
Я приехала в клинику на Харли-Стрит, сбросив 300 фунтов стерлингов, которых мне совершенно не нужно было тратить, чтобы сделать «ТО по фертильности». Я рассудил, что чистый счет за фертильность позволит мне отложить решение еще дольше. Однако неудовлетворительная оценка на MOT может вызвать проблему. И когда я приближался к своему 33-летию, я прекрасно осознавал, что «страшный возраст» 35 лет — возраст, о котором все чихают и качают головой, когда говорят (и говорят, и говорят) о женской фертильности, — был не так уж далек.
(Getty Images/iStockphoto)
Осмотр фертильности – или проверка фертильности, как предпочитает называть ее профессор Маклон («Женщины – не автомобили», – заверяет он меня) – оценивает запасы яйцеклеток и гормонов женщины с целью определения насколько успешны ее шансы на зачатие. Тесты, которые предлагаются в различных клиниках по всей Великобритании и стоят от 300 до 600 фунтов стерлингов, обычно включают анализ крови для проверки уровня антимюллерова гормона (АМГ) и фолликулостимулирующего гормона (ФСГ), а также УЗИ для подсчета фолликулов яичников.
ФСГ, вырабатываемый мозгом, увеличивает рост фолликулов (фолликулы — это маленькие мешочки, которые удерживают яйцеклетки и высвобождают их каждый месяц, когда они готовы к оплодотворению), в то время как АМГ прямо коррелирует с размером запаса яйцеклеток. АМГ естественным образом снижается с возрастом, поэтому низкий уровень АМГ может быть признаком ранней менопаузы. Однако уровни как АМГ, так и ФСГ колеблются в течение месячного цикла (последний необходимо измерять в первые несколько дней менструации), поэтому сами по себе они не считаются точными маркерами фертильности.Вот почему большинство MOT по фертильности также включают трансвагинальное УЗИ и консультацию, включающую краткое обсуждение образа жизни, регулярности менструаций, а также сексуального анамнеза и истории болезни.
Приближаясь к своему 33-летию, я прекрасно осознавала, что «страшный возраст» 35 лет не за горами
Тесты, подобные тому, который я прошла, изначально были разработаны клиниками ЭКО для прогнозирования реакции женщины на фертильность лечение. Но эксперты скептически относятся к ценности предикторов фертильности, поскольку многие считают их ложной уверенностью, ведущей к поспешным решениям или даже эксплуатации неуверенности женщин.
После моего собственного теста мне сказали, что мой уровень АМГ в норме для моего возраста и соответствует количеству яйцеклеток, моей истории болезни и моему образу жизни (мне сказали, что отказ от курения помог – и я думаю, что они должны указать это на пакет), доктор Маклон говорит, что он не видел ничего, что указывало бы на то, что у меня более высокий риск преждевременного бесплодия, чем у обычной женщины. Он разумно подбирает слова. «Чего я не говорю, так это того, что вы можете подождать, и все будет в порядке — есть много факторов. Это всего лишь моментальный снимок», — говорит он, объясняя, что для полной интерпретации результатов мне нужно будет пройти еще одно ТО через шесть месяцев (что удобно обошлось мне еще в несколько сотен фунтов).«Но у меня нет никакой очевидной причины говорить: «Боже, тебе лучше сломаться».
Он добавляет несколько зловеще, что «ваши яйца по количеству и качеству никогда не будут лучше, чем сегодня. Вероятность родить, скажем, двоих детей без медицинской помощи значительно возрастет, если вы начнете в течение ближайших года или двух».
Но насколько точны тесты, которые доктор Маклон провел на мне? Исследование, проведенное в 2017 году Университетом Северной Каролины и опубликованное в журнале Американской медицинской ассоциации (Jama), показало, что уровни ФСГ и АМГ не влияют на вероятность зачатия женщины.В исследовании приняли участие 750 женщин в возрасте от 30 до 44 лет без бесплодия в анамнезе, которые пытались забеременеть в течение трех месяцев или меньше, и было обнаружено, что низкий овариальный резерв, низкий уровень ФСГ и низкий уровень АМГ не связаны между собой. со сниженной фертильностью. «Эти результаты не поддерживают использование тестов на фолликулостимулирующий гормон мочи или крови или уровней антимюллерова гормона для оценки естественной фертильности женщин с такими характеристиками», — заключили они, заявив, что женщин следует «предостерегать» от таких тестов.
(Getty Images/iStockphoto)
Британское общество фертильности (BFS) также предостерегает от рекламы таких тестов как предикторов успешного зачатия. «Важно помнить, что эти тесты были разработаны для информирования о лечении ЭКО, а не для вашей естественной фертильности», — говорят они. «Многие женщины с низким овариальным резервом забеременеют без каких-либо проблем, в то время как другим с хорошим овариальным резервом может потребоваться время и лечение бесплодия. Их растущее использование в качестве «теста MOT на фертильность», чтобы убедить женщин в том, что их фертильность нормальна или что им следует рассмотреть вопрос о лечении раньше, чем позже, остается открытым для интерпретации.BFS говорит, что возраст остается основным показателем овариального резерва.
Доктор Чанна Джаясена, клинический директор Имперской репродуктивной эндокринологии, описывает МОТ по фертильности как ящик Пандоры. «Женщин можно подтолкнуть к чему-то, что на основе ограниченных данных может изменить их поведение», — говорит он мне. «Фертильность — это высоко коммерциализированная и прибыльная область медицины… Компании очень хорошо ослепляют нас наукой о том, насколько точны эти тесты, и нам нужно учитывать этические последствия чрезмерного стресса для кого-то… или принуждения их к ненадлежащему замораживанию». их яйца.
Фертильность — высоко коммерциализированная и прибыльная область медицины… Компании очень хорошо ослепляют нас наукой о точности этих тестов
Доктор Чанна Джаясена, клинический директор Imperial Reproductive Endocrinology очень низкий, «он просто говорит нам, что если бы у вас было ЭКО, вам нужно было бы больше гормонов. Это говорит нам не больше, чем ваш возраст о том, когда вы проходите через менопаузу. Вы все еще можете забеременеть без АМГ, а высокий АМГ может быть проблематичным, поскольку он может быть связан с СПКЯ [синдромом поликистозных яичников]».Сказав это, «оборотная сторона заключается в том, что у вас будут редкие проблемы, с которыми вы столкнетесь во время осмотра рождаемости».
Он добавляет, что 35 лет, вероятно, не тот возраст, о котором все должны беспокоиться: «Ваша фертильность меняется очень медленно из года в год вниз вплоть до 38 лет. После 38–42 лет происходит более быстрое, устойчивое и быстрое снижение . Я бы предпочел, чтобы люди были наделены этой информацией — чтобы они не думали, что в свой 35-й день рождения их яичники вот-вот взорвутся».
Женщины все чаще предпочитают заводить детей в более позднем возрасте.Новые данные, опубликованные Управлением национальной статистики (ONS) на этой неделе, показали, что в 2020 году половина женщин в Англии и Уэльсе впервые не родила ребенка к 30-летию. И хотя ожидаемый бэби-бум на карантине так и не материализовался (коэффициент рождаемости фактически снизился, при этом данные ONS показывают снижение на 8,1 и 10,1% в 2020 и 2021 годах соответственно), клиники по лечению бесплодия сообщили о росте спроса, когда они вновь открылись весной 2020 года после два месяца принудительного закрытия.
Количество запросов только в Лондонскую женскую клинику удвоилось — отчасти, по словам доктора Маклон, из-за неудовлетворенного спроса, а отчасти в ожидании нового карантина. «Мы наблюдаем рост интереса к услугам по лечению бесплодия, будь то замораживание яйцеклеток в будущем [или другие вопросы], и это может быть отчасти связано с задержкой, когда люди не хотят иметь детей сейчас из-за Covid. но хочется заморозить на будущее. Я думаю, что люди хотят немного больше контроля над планированием», — говорит он.
Для 32-летней учительницы Клары* стремление к контролю — вот что побудило ее заплатить за тест на фертильность.«Я знаю, что хочу детей, но могла бы с радостью подождать десять лет, прежде чем завести их, но я не так давно живу с мужем, и мне хотелось бы знать, сможем ли мы провести некоторое время вместе, прежде чем создавать семью», — говорит она . Независимый .
Результаты Клары показали, что у нее нормальное количество яйцеклеток для ее возраста, что оба ее яичника работают, а слизистая оболочка матки имеет оптимальную толщину. «Тест показал, что сейчас я не в невыгодном положении, а будь я в нем, я бы планировала завести детей чуть раньше», — говорит она.«Для меня потратить 400 фунтов стерлингов на то, чтобы не иметь ребенка в данный момент, кажется лучшей суммой, которую я когда-либо мог потратить, потому что теперь я могу соответствующим образом использовать свое время и энергию — путешествовать и сосредоточиться на своей карьере — и иметь детей, когда придет время. чувствует себя хорошо. Приятно знать, что не так торопятся, как я ожидал».
Женевьева Робертс прошла обследование на фертильность, когда ей было 37 лет. Незамужняя и ищущая уверенности (ранее она зачала от бывшего партнера, но позже у нее случился выкидыш), она предполагала, что ее фертильность будет в порядке.«Когда пришли [результаты], я помню, как почувствовала, что подо мной пошатнулись основы всего моего мира», — рассказывает она The Independent .
Когда пришли результаты, я помню, как почувствовал, что подо мной пошатнулись основы всего моего мира
У Робертс был очень низкий АМГ, и ей сказали, что она не сможет забеременеть естественным путем. Она прошла внутриматочную инсеминацию (IUI) и стала матерью Астрид (сейчас ей четыре года). Через два года Робертс зачала Хави с помощью ЭКО.«Это полностью изменило мою жизнь к лучшему, и это были два лучших решения, которые я когда-либо принимал. Я думаю, что знание — это сила, но вы должны быть готовы действовать в соответствии с ним».
Робертс МТ позволила ей отделить решение завести детей от поиска подходящего партнера. «Точно так же, как [мой медицинский осмотр на фертильность] не говорил «не волнуйся», потому что мне было бы грустно, я бы ждала несколько лет, встретила подходящего партнера, и это не сработало». Конечно, из-за того, что Женевьева действовала на своем медицинском осмотре на фертильность, неясно, забеременела бы она в конце концов естественным путем или нет.
Я спрашиваю доктора Маклона, что он думает о людях, называющих MOT фертильности маркетинговым ходом. Он выглядит раздраженным. «Существует мнение, что любые инновации в сфере фертильности основаны на циничном извлечении прибыли, и таких людей, как я, это расстраивает», — говорит он. «Я имею в виду частные клиники с ясным взглядом, они получают прибыль, но они укомплектованы врачами и медсестрами, которые хотят лучшего для своих пациентов — часто те же самые люди, которые работают в Национальной службе здравоохранения, приходят сюда вечером — и с ТО фертильности Я верю, что в нем есть полезная информация.Он называет MOT своей клиники по лечению бесплодия «расширением прав и возможностей женщин», поскольку он предоставляет данные, на основании которых они могут действовать.
Я скептически отношусь к тому, чтобы тратить сотни фунтов стерлингов на определение уровня гормонов, влияние которых на фертильность еще не доказано, расширяет возможности женщин, но меня не может не утешать то, что на моем собственном ТО нет ничего явно неправильного. BFS говорит, что, хотя хороший овариальный резерв никоим образом не гарантирует рождения ребенка, а плохой овариальный резерв не предполагает проблем с зачатием, «нет сомнений в том, что тесты, показывающие хороший овариальный резерв, обнадеживают».
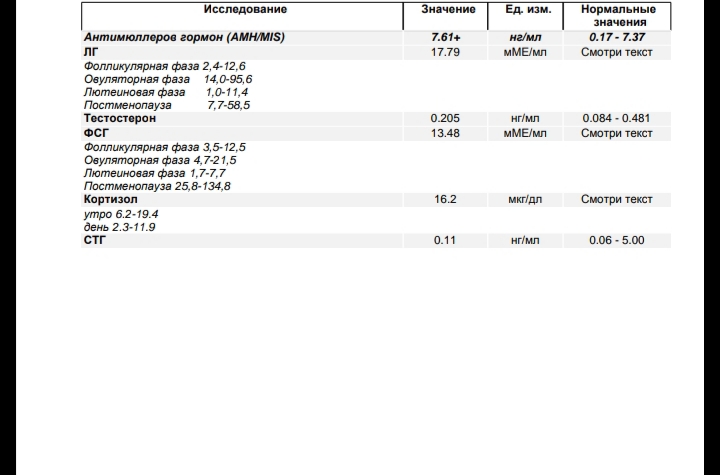
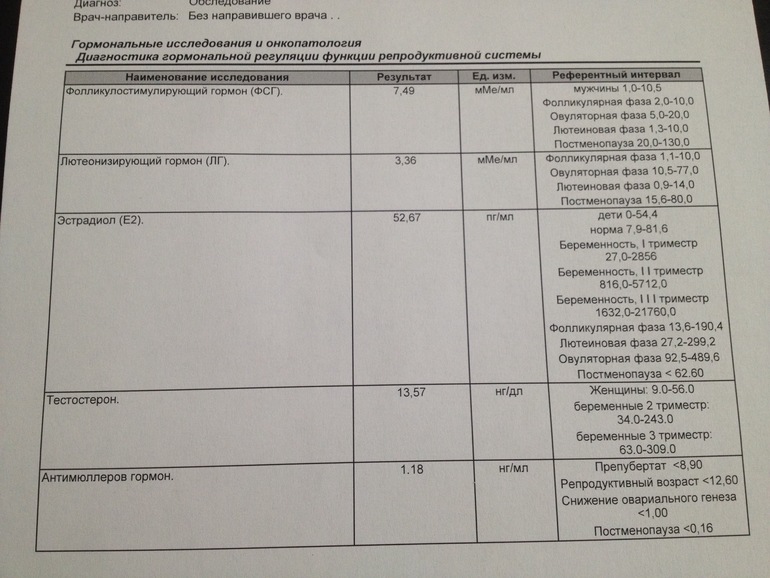



 За этим следует снижение уровня ингибина В, а затем повышение уровня ФСГ.Есть исследования, которые предполагают, что уровни АМГ могут (в ближайшем будущем) быть полезными для прогнозирования наступления менопаузы у женщины.
За этим следует снижение уровня ингибина В, а затем повышение уровня ФСГ.Есть исследования, которые предполагают, что уровни АМГ могут (в ближайшем будущем) быть полезными для прогнозирования наступления менопаузы у женщины. Таким образом, уровни АМГ можно использовать в качестве ориентира при выборе дозы препаратов от бесплодия для индукции овуляции. У пациентов с высоким уровнем АМГ дозу следует снизить, а у пациентов с низким уровнем АМГ — наоборот.
Таким образом, уровни АМГ можно использовать в качестве ориентира при выборе дозы препаратов от бесплодия для индукции овуляции. У пациентов с высоким уровнем АМГ дозу следует снизить, а у пациентов с низким уровнем АМГ — наоборот. Семьдесят две голые мыши Balb/c в возрасте 6 недель и массой тела 15–20 г были случайным образом разделены на три группы. Клетки MCF7 (1×10 7 ) вводили подкожно каждой мыши во всех группах.В возрасте 8 недель мышам в группе 1 (n = 24), группе 2 (n = 24) и группе 3 (n = 24) вводили однократно внутрибрюшинно 0,1 мл физиологического раствора, 100 мг/кг СТХ и 200 мг/кг СТХ соответственно. У шести мышей, отобранных стохастически из каждой группы, был взят забор крови из сердца во время эвтаназии и вырезание яичников перед химиотерапией. Впоследствии, в возрасте 9, 11 и 13 недель, у шести мышей, отобранных случайным образом из каждой группы, перед эвтаназией собирали кровь и удаляли яичники в каждый момент времени.
Семьдесят две голые мыши Balb/c в возрасте 6 недель и массой тела 15–20 г были случайным образом разделены на три группы. Клетки MCF7 (1×10 7 ) вводили подкожно каждой мыши во всех группах.В возрасте 8 недель мышам в группе 1 (n = 24), группе 2 (n = 24) и группе 3 (n = 24) вводили однократно внутрибрюшинно 0,1 мл физиологического раствора, 100 мг/кг СТХ и 200 мг/кг СТХ соответственно. У шести мышей, отобранных стохастически из каждой группы, был взят забор крови из сердца во время эвтаназии и вырезание яичников перед химиотерапией. Впоследствии, в возрасте 9, 11 и 13 недель, у шести мышей, отобранных случайным образом из каждой группы, перед эвтаназией собирали кровь и удаляли яичники в каждый момент времени.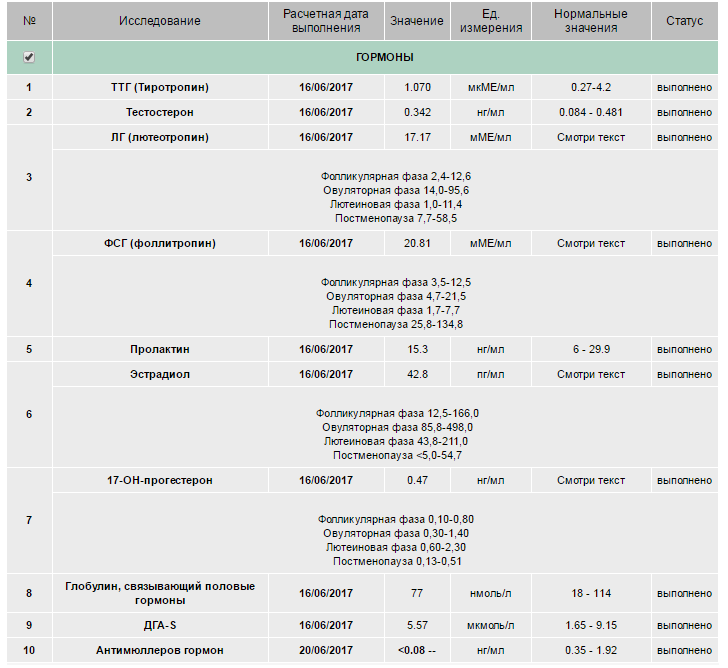
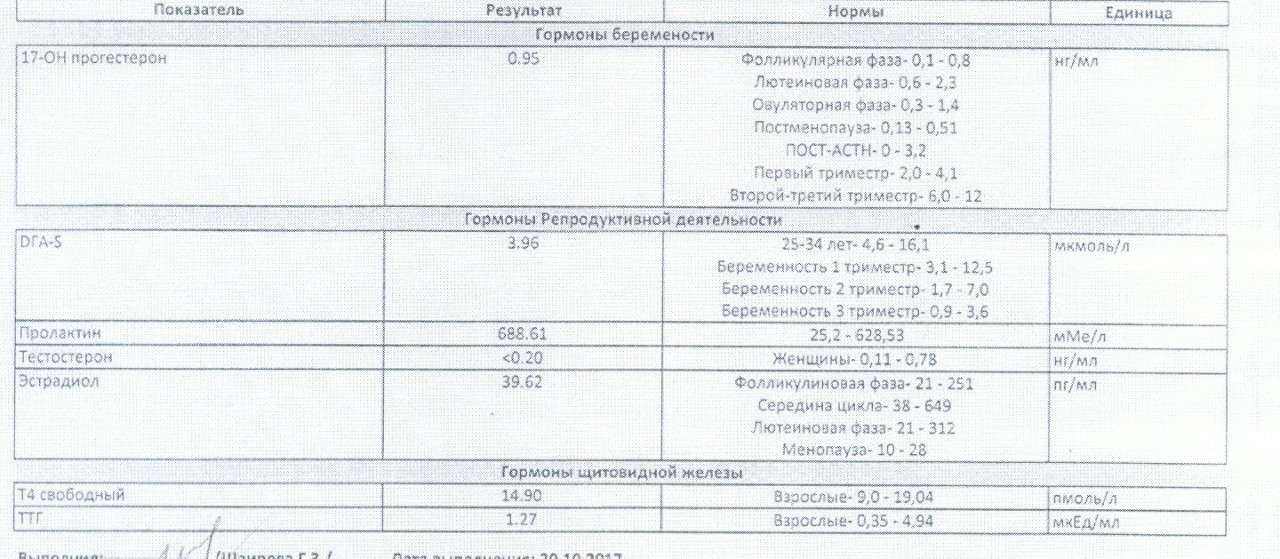 ( B ) Количество примордиальных фолликулов не было явно изменено в контрольной группе ( P > 0,05) и группе 100 мг/кг CTX в ранний момент времени, в то время как их уменьшение было очевидным в группе CTX 200 мг/кг. кг ( P < 0,0001). ( C ) Количество растущих фолликулов оставалось стабильным в контрольной группе и группе 100 мг/кг CTX ( P > 0.05). Напротив, он был значительно снижен в группе 200 мг/кг CTX через 5 недель после химиотерапии ( P <0,0001). ( D ) Окрашивание гематоксилин-эозином репрезентативных срезов всех мышей в различных группах лечения A–C (каждый столбец представляет минимум шесть мышей, тест ANOVA).
( B ) Количество примордиальных фолликулов не было явно изменено в контрольной группе ( P > 0,05) и группе 100 мг/кг CTX в ранний момент времени, в то время как их уменьшение было очевидным в группе CTX 200 мг/кг. кг ( P < 0,0001). ( C ) Количество растущих фолликулов оставалось стабильным в контрольной группе и группе 100 мг/кг CTX ( P > 0.05). Напротив, он был значительно снижен в группе 200 мг/кг CTX через 5 недель после химиотерапии ( P <0,0001). ( D ) Окрашивание гематоксилин-эозином репрезентативных срезов всех мышей в различных группах лечения A–C (каждый столбец представляет минимум шесть мышей, тест ANOVA).