Овариальный резерв и аутоиммунные заболевания щитовидной железы | Григорян
Среди эндокринных расстройств у женщин репродуктивного возраста лидирует патология щитовидной железы. Субклинический гипотиреоз может приводить к нерегулярности менструального цикла, синдрому «хронической» ановуляции, ассоциации гипотиреоза с бесплодием, что свидетельствует о влиянии тиреоидного статуса на рост и созревание фолликулов [1]. Данное наблюдение привело к рекомендациям в назначении препаратов тироксина желающим забеременеть женщинам при уровне тиреотропного гормона (ТТГ) от 2,5 мкМЕ/мл и выше [2]. Однако результаты клинических исследований, касающихся данного вопроса, противоречивы. Так, исследование Reh и соавт. показало отсутствие различий в частоте наступления беременности и родов в программах экстракорпорального оплодотворения (ЭКО) при выборе порогового значения ТТГ 2,5 или 4,5 мкМЕ/мл [3], в другом исследовании уровень ТТГ менее 2,5 мкМЕ/мл и уровень антимюллерова гормона (АМГ) более 1,4 нг/мл оказались независимыми предикторами достижения успешной беременности с родами при необъяснимом бесплодии [4].
Целью настоящего обзора, выполненного в рамках гранта РНФ № 17-75-30035, является систематизация современной информации о влиянии аутоиммунной патологии щитовидной железы на репродуктивную функцию женщин. Для понимания методологических подходов к изучению указанной проблемы необходимо коротко остановиться на основных понятиях репродуктивной медицины.
Под овариальным резервом понимают функциональный резерв яичника, который определяет способность последнего к развитию здорового фолликула с полноценной яйцеклеткой и адекватному ответу на овариальную стимуляцию. Овариальный резерв отражает количество находящихся в яичниках фолликулов (примордиальный пул и растущие фолликулы) и зависит от физиологических и патофизиологических факторов. Подавляющее большинство показателей овариального резерва характеризует гормонзависимую стадию роста фолликулов.
Одно из первых исследований, посвященных оценке связи наличия аутоиммунных антител и фертильности, провели Wilson C. и соавт. в 1975 г. [10]. Авторы показали отсутствие зависимости между наличием антитиреиодных антител (АТА) и репродуктивной функцией. Однако спустя 20 лет, в исследовании Roussev R.G. и соавт. [11] частота выявления АТА у больных с бесплодием оказалась равна 8% против 0% в группе контроля.
Однако спустя 20 лет, в исследовании Roussev R.G. и соавт. [11] частота выявления АТА у больных с бесплодием оказалась равна 8% против 0% в группе контроля.
В 1997 г. Geva E. и соавт. [12] провели исследование, в которое включили 40 больных с идиопатическим (необъяснимым) бесплодием, 40 пациенток с бесплодием вследствие обструкции маточных труб и 40 здоровых, ранее не рожавших женщин. Оценивали уровни АТА к микросомальной фракции тироцитов и к тиреоглобулину (АТ-ТГ). Частота выявления АТА составила 20% в группе идиопатического бесплодия, 17,5% – в группе с патологией маточных труб и только 5% в группе здоровых добровольцев (p<0,05 при сравнении по данному параметру между здоровыми женщинами и обеими группами больных бесплодием).
В дальнейшем такая корреляция была подтверждена: в одном ретроспективном исследовании частота выявления ATA у больных, вошедших в программы ВРТ, составила 19% против 15% в группе контроля [13], в другом исследовании частота выявления аутоантител (включая антитела к тиреопероксидазе (АТ-ТПО) и АТ-ТГ) также оказалась выше в группе больных с бесплодием. В то же время в исследовании 2001 г. Reimand K. и соавт. [14] показали отсутствие различий в частоте выявления АТА в группе женщин с бесплодием и в группе контроля.
В то же время в исследовании 2001 г. Reimand K. и соавт. [14] показали отсутствие различий в частоте выявления АТА в группе женщин с бесплодием и в группе контроля.
В нескольких исследованиях показана ассоциация между выявлением АТА и специфическими причинами бесплодия. Так, Poppee K. и соавт. [15] провели проспективное исследование с участием 438 женщин (средний возраст 32±5 лет) с бесплодием различной этиологии и 100 здоровых женщин, сопоставимых по возрасту. Целью исследования явилось сравнение распространенности аутоиммунных заболеваний щитовидной железы и латентных нарушений ее функции. В 45% случаев основной причиной бесплодия являлась патология у партнерши, из них 11% – эндометриоз, 30% – заболевания маточных труб и 59% – овариальная дисфункция. Мужской фактор имел место в 38% случаев, идиопатическое бесплодие – в 17%. В целом средний уровень ТТГ оказался достоверно выше в группе женщин с бесплодием по сравнению со здоровыми женщинами (1,3 против 1,2 мМЕ/л). Выходящий за нормальные пределы уровень ТТГ встречался в группах одинаково часто.

В таблице 1 представлено сравнение частоты позитивности по АТА у больных бесплодием и у здоровых женщин.
Таблица 1. Сравнение частоты позитивности по АТА у больных бесплодием и у здоровых женщин.
Ссылка | Частота выявления АТА при бесплодии | Частота выявления АТА у здоровых женщин | Уровень значимости различий (p) |
Geva et al. [12] | 20% (идиопатическое есплодие) 17,5% (трубное бесплодие) | 5% | <0,05 |
Poppee et al. [15] | 18% (при женском факторе бесплодия) | 8% | <0,05 |
Abalovich et al. [16] | 25% (бесплодие + эндометриоз) | 14% | <0,05 |
Grassi G. и соавт. [18] изучили уровень ТТГ, свободного тироксина, а также уровни антител к микросомам и антител к тиреоглобулину у 149 женщин с бесплодием. В случае отклонения каких-либо из изученных лабораторных параметров от нормы дополнительно проводили ультразвуковое исследование (УЗИ) щитовидной железы и определяли неспецифические аутоиммунные антитела. Несмотря на то что авторы обнаружили более высокую частоту выявления АТА у больных с бесплодием, само по себе наличие такого лабораторного феномена не влияло на вероятность наступления беременности.
и соавт. [18] изучили уровень ТТГ, свободного тироксина, а также уровни антител к микросомам и антител к тиреоглобулину у 149 женщин с бесплодием. В случае отклонения каких-либо из изученных лабораторных параметров от нормы дополнительно проводили ультразвуковое исследование (УЗИ) щитовидной железы и определяли неспецифические аутоиммунные антитела. Несмотря на то что авторы обнаружили более высокую частоту выявления АТА у больных с бесплодием, само по себе наличие такого лабораторного феномена не влияло на вероятность наступления беременности.
Muller A.F. и соавт. [19] в исследовании с участием 173 женщин, которым проводилось ЭКО, определяли уровни АТ-ТПО и ТТГ. В рамках дополнительного исследования случай-контроль также измеряли уровни антикардиолипиновых антител. Целью исследования явилась оценка частоты выкидышей в зависимости от указанных выше параметров. У 54 из 173 женщин наступила беременность (31%), при этом частота достижения беременности у больных, позитивных по АТА, оказалась выше – 48% (12 из 25) против 28% (42 из 148).
Kilic S. и соавт. [20] в исследовании с участием 69 женщин с идиопатическим бесплодием изучили исходы ЭКО, толщину эндометрия и эмбриологические параметры в зависимости от статуса по АТА. В исследование вошли женщины, сопоставимые по возрасту, индексу массы тела (ИМТ), базальному гормональному профилю и протоколу индукции овуляции. В зависимости от результатов тестирования на АТА были выделены три группы: негативные (n=31), позитивные (n=23), позитивные в медикаментозном эутиреозе (n=15). Различий между группами в количестве полученных и оплодотворенных яйцеклеток, толщине эндометрия, характеристиках эмбрионов выявлено не было.
Таблица 2. Частота наступления беременности в программах ЭКО у больных бесплодием в зависимости от статуса по АТА
Ссылка | Позитивные по АТА | Уровень значимости различий (p) | |
Muller et al. [19] | 48% | 28% | 0,05 |
Kilic et al. [20] | 13,3% (у больных с медикаментозно компенсированным гипотиреозом) 30,4% (у больных с эутиреозом) | 41,9% | 0,24 (при сравнении групп негативных по АТА и позитивных по АТА) |
Несмотря на более чем 40-летнюю историю изучения связи аутоиммунных заболеваний щитовидной железы и фертильности, интерес к этой проблеме не уменьшается до сих пор. В последние годы проведено несколько хорошо спланированных исследований, призванных с учетом доступных на данном этапе развития медицинской науки методов исследования, включая изучение высокочувствительных биомаркеров, установить влияние статуса по АТА на овариальный резерв.
В последние годы проведено несколько хорошо спланированных исследований, призванных с учетом доступных на данном этапе развития медицинской науки методов исследования, включая изучение высокочувствительных биомаркеров, установить влияние статуса по АТА на овариальный резерв.
Целью исследования В.А. Гурьевойи соавт. [21] явилось установление овариального резерва у женщин групп риска и значимости факторов, его определяющих. В исследование были включены 174 женщины репродуктивного возраста с нарушенной фертильной функцией, которые составили основную группу, в группу сравнения вошли 30 женщин с ненарушенной репродукцией. На этапе отбора женщины были рандомизированы по возрасту, социальному статусу, роду занятий, месту проживания, соматической и гинекологической патологии. Оценку состояния овариального резерва у женщин сравниваемых групп проводили путем определения уровня половых гормонов в сыворотке крови (ФСГ, ЛГ, эстрадиола и АМГ), а также оценивали ультразвуковые параметры овариального резерва (объем яичников и количество антральных фолликулов). Для определения вероятного аутоиммунного повреждения яичников исследовались АТА. У 8,8% женщин с нарушенной репродукцией было выявлено повышение АТА, средние показатели которого составили 380±111,4 МЕ/мл. У 5,5% женщин со сниженным овариальным резервом был установлен диагноз аутоиммунный тиреоидит, эутиреоидный, и в 30,8% случаев – гипотиреоз.
Для определения вероятного аутоиммунного повреждения яичников исследовались АТА. У 8,8% женщин с нарушенной репродукцией было выявлено повышение АТА, средние показатели которого составили 380±111,4 МЕ/мл. У 5,5% женщин со сниженным овариальным резервом был установлен диагноз аутоиммунный тиреоидит, эутиреоидный, и в 30,8% случаев – гипотиреоз.
Pirgon O. и соавт. (2016) [22] изучили овариальную функцию и овариальный резерв у девушек с впервые выявленным хроническим аутоиммунным тиреоидитом (тиреоидитом Хашимото) в состоянии эутиреоза. В исследование случай-контроль вошли 30 девушек (средний возраст 15,1±1,4 г) с высоким титром АТА и диффузной неоднородностью щитовидной железы по данным УЗИ и 30 здоровых сопоставимых по возрасту девушек. Оценивали такие параметры, как уровень антиовариальных антител (АОА), отношение уровней ЛГ к уровню ФСГ (ЛГ/ФСГ), уровни эстрадиола, АМГ, ингибина-В, общего тестостерона, количество антральных фолликулов, объем яичников и длину матки. Различий между группами по таким параметрам, как отношение ЛГ/ФСГ, уровень эстрадиола и ингибина В не было. В то же время уровни АОА, АМГ и тестостерона были достоверно выше в группе больных аутоиммунным тиреоидитом (p=0,02, p=0,07 и p=0,03 соответственно). У девушек с аутоиммунным тиреоидитом уровень АОА положительно коррелировал с отношением ЛГ/ФСГ (p=0,03), уровнями АМГ (p=0,01) и ингибина В (p<0,001). Авторы пришли к выводу, что по результатам всех проведенных тестов у девушек с хроническим аутоиммунным тиреоидитом сохраняется нормальный овариальный резерв. При этом повышение титра АОА, ассоциированное с повышением АТА, требует настороженности в отношении возможности развития преждевременной недостаточности яичников у этих девушек, что планируется оценить в отдаленной перспективе.
В то же время уровни АОА, АМГ и тестостерона были достоверно выше в группе больных аутоиммунным тиреоидитом (p=0,02, p=0,07 и p=0,03 соответственно). У девушек с аутоиммунным тиреоидитом уровень АОА положительно коррелировал с отношением ЛГ/ФСГ (p=0,03), уровнями АМГ (p=0,01) и ингибина В (p<0,001). Авторы пришли к выводу, что по результатам всех проведенных тестов у девушек с хроническим аутоиммунным тиреоидитом сохраняется нормальный овариальный резерв. При этом повышение титра АОА, ассоциированное с повышением АТА, требует настороженности в отношении возможности развития преждевременной недостаточности яичников у этих девушек, что планируется оценить в отдаленной перспективе.
Tuten A. и соавт. [23] также изучили влияние статуса по АТА на овариальный резерв. В исследование включили 22 женщины репродуктивного возраста с аутоиммунным тиреоидитом Хашимото в стадии гипотиреоза, получавших терапию тироксином, группу контроля составили 49 здоровых женщин, сопоставимых по возрасту. Авторы показали, что овариальный резерв у больных аутоиммунным тиреоидитом не только не был снижен, но и превышал таковой у здоровых добровольцев (достоверно более высокий уровень АМГ), при этом количество антральных фолликулов у женщин двух групп было сопоставимо. Тем не менее авторы указывают, что АТА ассоциированы с развитием СПКЯ, с наличием которого в латентной стадии и может быть связано повышение уровня АМГ.
Авторы показали, что овариальный резерв у больных аутоиммунным тиреоидитом не только не был снижен, но и превышал таковой у здоровых добровольцев (достоверно более высокий уровень АМГ), при этом количество антральных фолликулов у женщин двух групп было сопоставимо. Тем не менее авторы указывают, что АТА ассоциированы с развитием СПКЯ, с наличием которого в латентной стадии и может быть связано повышение уровня АМГ.
Magri F. и соавт. [24] провели крупное исследование с целью изучить зависимость между статусом по АТА и овариальным резервом. В исследование вошли 288 женщин моложе 40 лет с пониженной фертильностью в состоянии эутиреоза. Позитивными по АТА была 55 из них. До проведения контролируемой гиперстимуляции яичников измеряли сывороточные уровни АМГ, ФСГ, ЛГ, эстрадиола, ТТГ. Рассчитывали также отношение между сывороточной концентрацией эстрадиола (E2) в день извлечения яйцеклеток и общей введенной дозой рекомбинантного ФСГ (E2/рФСГ). Сывороточный уровень АМГ достоверно коррелировал со значением отношения E2/рФСГ, общей введенной дозой рФСГ и количеством зрелых (M II) яйцеклеток независимо от статуса по АТА. При низких значениях АМГ наличие АТА не оказывало дополнительного влияния на исходы контролируемой гиперстимуляции яичников, однако при высоких значениях АМГ наличие АТА оказывало существенное воздействие на отношение E2/рФСГ, общую дозу рФСГ и количество зрелых яйцеклеток. Авторы пришли к заключению, что при низком уровне АМГ отмечается плохой ответ на контролируемую гиперстимуляцию яичников независимо от наличия АТА, в то время как при высоком уровне АМГ, свидетельствующем о хорошем овариальном резерве, АТА ухудшают исходы контролируемой гиперстимуляции яичников.
При низких значениях АМГ наличие АТА не оказывало дополнительного влияния на исходы контролируемой гиперстимуляции яичников, однако при высоких значениях АМГ наличие АТА оказывало существенное воздействие на отношение E2/рФСГ, общую дозу рФСГ и количество зрелых яйцеклеток. Авторы пришли к заключению, что при низком уровне АМГ отмечается плохой ответ на контролируемую гиперстимуляцию яичников независимо от наличия АТА, в то время как при высоком уровне АМГ, свидетельствующем о хорошем овариальном резерве, АТА ухудшают исходы контролируемой гиперстимуляции яичников.
Крупное поперечное ретроспективное исследование N.P. Polyzos и соавт. [25] также посвящено изучению вопроса, приводят ли аутоиммунные заболевания щитовидной железы к снижению овариального резерва. Информация из карт 4894 женщин была взята из архива центра репродуктивной медицины университетской больницы Брюсселя. Оценивали влияние уровней АМГ, свободного тироксина, ТТГ и АТ-ТПО на исход. Судя по уровню АМГ, у 3929 пациенток отмечался нормальный овариальный резерв, сниженный – у 487 и высокий – у 478. Уровни ТТГ и свободного тироксина не различались между группами с разным овариальным резервом. Частота выявления АТ-ТПО среди женщин с низким, нормальным и высоким уровнями АМГ также не различалась (12,1%, 10,3% и 9,8% соответственно, p=0,423). Субклинический или скрытый гипотиреоз также выявлялся с одинаковой частотой в разных группах. При этом у больных с генетическими причинами сниженного овариального резерва частота латентного или субклинического гипотиреоза была достоверно выше, чем в группе с необъяснимым снижением (25% против 3,2%, p=0,002, и 18,8% против 1,6%, p=0,004). При этом гипотиреоз встречался одинаково часто при снижении овариального резерва разной этиологии.
Уровни ТТГ и свободного тироксина не различались между группами с разным овариальным резервом. Частота выявления АТ-ТПО среди женщин с низким, нормальным и высоким уровнями АМГ также не различалась (12,1%, 10,3% и 9,8% соответственно, p=0,423). Субклинический или скрытый гипотиреоз также выявлялся с одинаковой частотой в разных группах. При этом у больных с генетическими причинами сниженного овариального резерва частота латентного или субклинического гипотиреоза была достоверно выше, чем в группе с необъяснимым снижением (25% против 3,2%, p=0,002, и 18,8% против 1,6%, p=0,004). При этом гипотиреоз встречался одинаково часто при снижении овариального резерва разной этиологии.
В то же время Saglam F. и соавт. [26] пришли к противоположному результату. В исследование включали женщин репродуктивного возраста (моложе 40 лет), 85 с наличием АТА и 80 здоровых добровольцев. Подробно изучали репродуктивный анамнез (количество беременностей, их исходы), а также в фолликулярную фазу проводили измерение уровней гонадотропинов, стероидов, АМГ и ингибина В. Количество беременностей и живорождений было меньше в группе женщин с аутоиммунными заболеваниями щитовидной железы (p<0,01). Различий в уровнях ФСГ, эстрадиола или ингибина В не было. Однако уровень АМГ оказался достоверно ниже у больных с носительством АТА по сравнению с контролем (1,16±0,17 против 1,28±0,25 нг/мл, p=0,001). Даже после поправки на возраст наличие АТА значимо и независимо определяло более низкий уровень АМГ (множественный регрессионный анализ, t=2,674, p=0,008). Авторы пришли к заключению, что, по всей видимости, аутоиммунные заболевания щитовидной железы предопределяют снижение овариального резерва. Ayesha и соавт. [27] показали, что аутоиммунные заболевания щитовидной железы – наиболее частая аутоиммунная патология у больных с преждевременной недостаточностью яичников.
Количество беременностей и живорождений было меньше в группе женщин с аутоиммунными заболеваниями щитовидной железы (p<0,01). Различий в уровнях ФСГ, эстрадиола или ингибина В не было. Однако уровень АМГ оказался достоверно ниже у больных с носительством АТА по сравнению с контролем (1,16±0,17 против 1,28±0,25 нг/мл, p=0,001). Даже после поправки на возраст наличие АТА значимо и независимо определяло более низкий уровень АМГ (множественный регрессионный анализ, t=2,674, p=0,008). Авторы пришли к заключению, что, по всей видимости, аутоиммунные заболевания щитовидной железы предопределяют снижение овариального резерва. Ayesha и соавт. [27] показали, что аутоиммунные заболевания щитовидной железы – наиболее частая аутоиммунная патология у больных с преждевременной недостаточностью яичников.
Weghofer A. и соавт. [28] решили выяснить, что же на самом деле влияет на овариальный резерв: сниженная функция щитовидной железы или ее аутоиммунная патология. В исследование включили 225 больных бесплодием женщин, средний возраст 38,4±5 лет. За нормальный уровень ТТГ приняли интервал от 0,4 до 4,5 мкМЕ/мл и оценили уровень АМГ в зависимости от уровня ТТГ менее 3 или от 3 и более мкМЕ/мл. Также определяли уровень АТА: АТ-ТПО, АТ-ТГ и антитела к тиреоидным рецепторам. Средний уровень АМГ составил 1,3±2,0 нг/мл, средний уровень ТТГ 1,8±0,9 мкЕД/мл. АТА были выявлены у 11,1% больных. У женщин с уровнем ТТГ менее 3 мкМЕ/мл уровень АМГ оказался достоверно выше, чем у больных с ТТГ ≥ 3 мкМЕ/мл (p=0,03). Это различие сохранялось после поправки на статус по АТА и возраст. По мнению авторов, их наблюдение подтверждает тот факт, что овариальный резерв зависит именно от функции щитовидной железы, а не от носительства АТА. В связи с этим они полагают, что с целью увеличения овариального резерва может быть целесообразно назначение тироксина больным с уровнем ТТГ ≥ 3 мкМЕ/мл.
За нормальный уровень ТТГ приняли интервал от 0,4 до 4,5 мкМЕ/мл и оценили уровень АМГ в зависимости от уровня ТТГ менее 3 или от 3 и более мкМЕ/мл. Также определяли уровень АТА: АТ-ТПО, АТ-ТГ и антитела к тиреоидным рецепторам. Средний уровень АМГ составил 1,3±2,0 нг/мл, средний уровень ТТГ 1,8±0,9 мкЕД/мл. АТА были выявлены у 11,1% больных. У женщин с уровнем ТТГ менее 3 мкМЕ/мл уровень АМГ оказался достоверно выше, чем у больных с ТТГ ≥ 3 мкМЕ/мл (p=0,03). Это различие сохранялось после поправки на статус по АТА и возраст. По мнению авторов, их наблюдение подтверждает тот факт, что овариальный резерв зависит именно от функции щитовидной железы, а не от носительства АТА. В связи с этим они полагают, что с целью увеличения овариального резерва может быть целесообразно назначение тироксина больным с уровнем ТТГ ≥ 3 мкМЕ/мл.
Таким образом, литературные данные независимо от давности проведенных исследований и диагностических возможностей как для выявления аутоиммунной патологии щитовидной железы, так и для определения овариального резерва, противоречивы. В то же время очевидно, что даже выявление корреляции между носительством АТА и снижением параметров, характеризующих овариальный резерв, не доказывает причинно-следственных связей. Авторы, утверждающие существование такой связи, предлагают различные гипотезы патогенеза недостаточности яичников и патологии беременности при аутоиммунных заболеваниях щитовидной железы. Одно из объяснений – субклинический гипотиреоз или неспособность щитовидной железы адекватно ответить на запрос, возникающий при гиперстимуляции яичников или во время беременности [29, 30].
В то же время очевидно, что даже выявление корреляции между носительством АТА и снижением параметров, характеризующих овариальный резерв, не доказывает причинно-следственных связей. Авторы, утверждающие существование такой связи, предлагают различные гипотезы патогенеза недостаточности яичников и патологии беременности при аутоиммунных заболеваниях щитовидной железы. Одно из объяснений – субклинический гипотиреоз или неспособность щитовидной железы адекватно ответить на запрос, возникающий при гиперстимуляции яичников или во время беременности [29, 30].
Интересная гипотеза на основании результатов собственного исследования высказана Monteleone P. и соавт. [31]. В проспективное наблюдательное исследование включили 31 пациентку с первичным бесплодием в связи с мужским или трубным фактором с базальным уровнем ФСГ на третий день менее 10 МЕ/л и хорошим ответом на контролируемую гиперстимуляцию яичников (более 3 фолликулов не менее 18 мм в конце цикла стимуляции). Определяли уровни АТА (АТ-ТГ, АТ-ТПО), по результатам больных разделили на две группы: позитивных по АТА (n=14) и негативных по АТА (n=17, группа контроля). В качестве критериев исключения выступали другие аутоиммунные заболевания, СПКЯ и эндометриоз. При выполнении процедур ВРТ в день извлечения яйцеклетки путем тонкоигольной аспирации отбирали образцы фолликулярной жидкости для анализа на уровень АТА. Оказалось, что у больных, позитивных по АТА, они определяются и в фолликулярной жидкости, причем уровень их составляет приблизительно половину от уровня в плазме крови. При этом наличие АТА ассоциировалось со снижением частоты успешного оплодотворения, получения эмбрионов класса А и наступления беременности, а также с увеличением частоты раннего невынашивания. По мнению авторов, АТА могут вызывать антителозависимую цитотоксичность в растущем фолликуле, повреждать созревающую яйцеклетку, снижая ее потенцию к дальнейшему развитию и последующей имплантации эмбриона.
В качестве критериев исключения выступали другие аутоиммунные заболевания, СПКЯ и эндометриоз. При выполнении процедур ВРТ в день извлечения яйцеклетки путем тонкоигольной аспирации отбирали образцы фолликулярной жидкости для анализа на уровень АТА. Оказалось, что у больных, позитивных по АТА, они определяются и в фолликулярной жидкости, причем уровень их составляет приблизительно половину от уровня в плазме крови. При этом наличие АТА ассоциировалось со снижением частоты успешного оплодотворения, получения эмбрионов класса А и наступления беременности, а также с увеличением частоты раннего невынашивания. По мнению авторов, АТА могут вызывать антителозависимую цитотоксичность в растущем фолликуле, повреждать созревающую яйцеклетку, снижая ее потенцию к дальнейшему развитию и последующей имплантации эмбриона.
Есть и другие доказательства того, что АТА могут перекрестно реагировать с клетками яичника, в том числе с яйцеклетками. Так, Kelkar R.L. и соавт. [32] показали, что у 5 из 8 женщин с преждевременной недостаточностью яичников и наличием антител к прозрачной оболочке яйцеклетки (zona pellucida) выявлялись АТА, при этом антитела к прозрачной оболочке перекрестно реагировали с антигенами прозрачной оболочки яйцеклеток других видов (овцы, обезьяны, свиньи, мыши), а из других тканей у мышей имели сродство только к щитовидной железе. Следовательно, можно предположить и аффинность АТА к яйцеклеткам.
Следовательно, можно предположить и аффинность АТА к яйцеклеткам.
ЗАКЛЮЧЕНИЕ
Таким образом, данные о влиянии носительства АТА на репродуктивную функцию женщин противоречивы, а целесообразность включения их в скрининговое обследование у женщин, получающих лечение в рамках программ ВРТ, дискутабельна. На данный момент нет единого подхода к интерпретации результатов такого тестирования и доказательных рекомендаций относительно изменений лечебной тактики в зависимости от статуса пациенток по АТА. Для ответа на эти вопросы необходимо проведение крупных, хорошо спланированных рандомизированных контролируемых клинических исследований, которые позволят выявить возможные патогенетические связи между снижением овариального резерва и наличием аутоиммунной патологии щитовидной железы, а также сформулировать рекомендации по персонифицированному лечению больных для улучшения репродуктивного здоровья.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена в рамках гранта Российского научного фонда «Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркеры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация» (Грант РНФ № 17-75-30035).
Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация» (Грант РНФ № 17-75-30035).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли значимый вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию статьи перед публикацией.
1. Poppe K, Velkeniers B. Female infertility and the thyroid. Best Pract Res Clin Endocrinol Metab. 2004;18(2):153-165. doi: 10.1016/j.beem.2004.03.004
2. Mintziori G, Anagnostis P, Toulis KA, Goulis DG. Thyroid diseases and female reproduction. Minerva Med. 2012;103(1):47-62. PMID: 22278068
3. Reh A, Grifo J, Danoff A. What is a normal thyroid-stimulating hormone (TSH) level? Effects of stricter TSH thresholds on pregnancy outcomes after in vitro fertilization. Fertil Steril. 2010;94(7):2920-2922. doi: 10.1016/j.fertnstert.2010.06.041
Reh A, Grifo J, Danoff A. What is a normal thyroid-stimulating hormone (TSH) level? Effects of stricter TSH thresholds on pregnancy outcomes after in vitro fertilization. Fertil Steril. 2010;94(7):2920-2922. doi: 10.1016/j.fertnstert.2010.06.041
4. Murto T, Bjuresten K, Landgren B-M, Stavreus-Evers A. Predictive value of hormonal parameters for live birth in women with unexplained infertility and male infertility. Reprod Biol Endocrinol. 2013;11(1):61. doi: 10.1186/1477-7827-11-61
5. Krassas GE, Perros P, Kaprara A. Thyroid autoimmunity, infertility and miscarriage. Expert Rev Endocrinol Metab. 2008;3(2):127-136. doi: 10.1586/17446651.3.2.127
6. Geva E, Lessing JB, Lerner-Geva L, et al. The Presence of Antithyroid Antibodies in Euthyroid Patients With Unexplained Infertility and Tubal Obstruction. Am J Reprod Immunol. 1997;37(2):184-186. doi: 10.1111/j.1600-0897.1997.tb00210.x
Am J Reprod Immunol. 1997;37(2):184-186. doi: 10.1111/j.1600-0897.1997.tb00210.x
7. Janssen O, Mehlmauer N, Hahn S, et al. High prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Eur J Endocrinol. 2004;37(2):363-369. doi: 10.1530/eje.0.1500363
8. Боярский К.Ю., Гайдуков С.Н., Чинчаладзе А.С. Факторы, определяющие овариальный резерв женщины // Журнал акушерства и женских болезней. – 2009. – Т.58. – №2. – С.65-71. [Boyarsky CY, Gaidukov SN, Chinchaladze AS. Factors which can predict ovarian reserve. Journal of obstetrics and women’s diseases. 2009;58(2):65-71. (In Russ.)]
9. Jamil Z, Fatima SS, Ahmed K, Malik R. Anti-Mullerian Hormone: Above and Beyond Conventional Ovarian Reserve Markers. Dis Markers. 2016;2016(2):1-9. doi: 10.1155/2016/5246217
2016;2016(2):1-9. doi: 10.1155/2016/5246217
10. Wilson C, Elstein M, Eade O., Lloyd R, Wright R. SMOOTH-MUSCLE ANTIBODIES IN INFERTILITY. Lancet. 1975;306(7947):1238-1239. doi: 10.1016/S0140-6736(75)92074-7
11. Roussev RG, Kaider BD, Price DE, Coulam CB. Laboratory Evaluation of Women Experiencing Reproductive Failure. Am J Reprod Immunol. 1996;35(4):415-420. doi: 10.1111/j.1600-0897.1996.tb00503.x
12. Geva E, Lessing JB, Lerner-Geva L, et al. The Presence of Antithyroid Antibodies in Euthyroid Patients With Unexplained Infertility and Tubal Obstruction. Am J Reprod Immunol. 1997;37(2):184-186. doi: 10.1111/j.1600-0897.1997.tb00210.x
13. Kutteh W. Increased prevalence of antithyroid antibodies identified in women with recurrent pregnancy loss but not in women undergoing assisted reproduction. Fertil Steril. 1999;71(5):843-848. doi: 10.1016/S0015-0282(99)00091-6
Kutteh W. Increased prevalence of antithyroid antibodies identified in women with recurrent pregnancy loss but not in women undergoing assisted reproduction. Fertil Steril. 1999;71(5):843-848. doi: 10.1016/S0015-0282(99)00091-6
14. Reimand K, Talja I, Metsküla K, et al. Autoantibody studies of female patients with reproductive failure. J Reprod Immunol. 2001;51(2):167-176. doi: 10.1016/S0165-0378(01)00075-4
15. Poppe K, Glinoer D, Van Steirteghem A, et al. Thyroid Dysfunction and Autoimmunity in Infertile Women. Thyroid. 2002;12(11):997-1001. doi: 10.1089/105072502320908330
16. Abalovich M, Mitelberg L, Allami C, et al. Subclinical hypothyroidism and thyroid autoimmunity in women with infertility. Gynecol Endocrinol. 2007;23(5):279-283. doi: 10.1080/09513590701259542
doi: 10.1080/09513590701259542
17. Kachuei M, Jafari F, Kachuei A, Keshteli AH. Prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Arch Gynecol Obstet. 2012;285(3):853-856. doi: 10.1007/s00404-011-2040-5
18. Grassi G, Balsamo A, Ansaldi C, et al. Thyroid autoimmunity and infertility. Gynecol Endocrinol. 2001;15(5):389-396. doi: 10.1080/713602919
19. Muller A, Verhoeff A, Mantel M, Berghout A. Thyroid autoimmunity and abortion: a prospective study in women undergoing in vitro fertilization. Fertil Steril. 1999;71(1):30-34. doi: 10.1016/S0015-0282(98)00394-X
20. Kilic S, Tasdemir N, Yilmaz N, et al. The effect of anti-thyroid antibodies on endometrial volume, embryo grade and IVF outcome.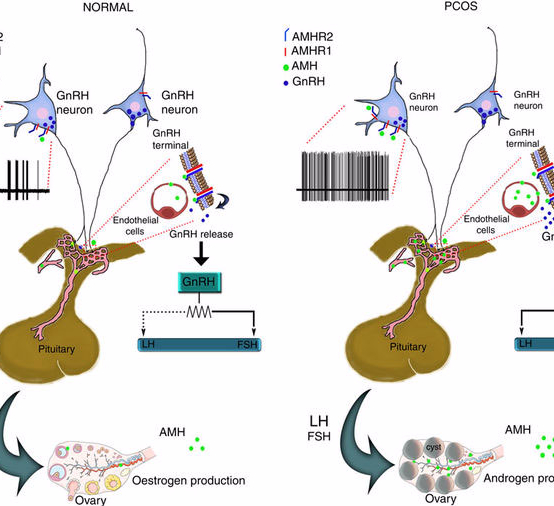 Gynecol Endocrinol. 2008;24(11):649-655. doi: 10.1080/09513590802531112
Gynecol Endocrinol. 2008;24(11):649-655. doi: 10.1080/09513590802531112
21. Гурьева В.А., Куракина В.А. Оценка факторов, определяющих овариальный резерв у женщин с нарушенной репродуктивной функцией // Журнал акушерства и женских болезней. – 2012. – Т.61. – №6. – С.76-81. [Gur’eva VA, Kurakina VA. Evaluation factors, determining ovarian reserve in women with reproductive function disorders. Journal of obstetrics and women’s diseases. 2012;61(6):76-81. (In Russ.)]
22. Pirgon O, Sivrice C, Demirtas H, Dundar B. Assessment of ovarian reserve in euthyroid adolescents with Hashimoto thyroiditis. Gynecol Endocrinol. 2016;32(4):306-310. doi: 10.3109/09513590.2015.1116510
23. Tuten A, Hatipoglu E, Oncul M, et al. Evaluation of ovarian reserve in Hashimoto’s thyroiditis. Gynecol Endocrinol. 2014;30(10):708-711. doi: 10.3109/09513590.2014.926324
Gynecol Endocrinol. 2014;30(10):708-711. doi: 10.3109/09513590.2014.926324
24. Magri F, Schena L, Capelli V, et al. Anti-Mullerian hormone as a predictor of ovarian reserve in ART protocols: the hidden role of thyroid autoimmunity. Reprod Biol Endocrinol. 2015;13(1):106. doi: 10.1186/s12958-015-0103-3
25. Polyzos NP, Sakkas E, Vaiarelli A, et al. Thyroid autoimmunity, hypothyroidism and ovarian reserve: a cross-sectional study of 5000 women based on age-specific AMH values. Hum Reprod. 2015;30(7):1690-1696. doi: 10.1093/humrep/dev089
26. Saglam F, Onal ED, Ersoy R, et al. Anti-Müllerian hormone as a marker of premature ovarian aging in autoimmune thyroid disease. Gynecol Endocrinol. 2015;31(2):165-168. doi: 10.3109/09513590. 2014.973391
2014.973391
27. Ayesha, Jha V, Goswami D. Premature Ovarian Failure: An Association with Autoimmune Diseases. J Clin Diagn Res. 2016;10(10):10-12. doi: 10.7860/JCDR/2016/22027.8671
28. Weghofer A, Barad DH, Darmon S, et al. What affects functional ovarian reserve, thyroid function or thyroid autoimmunity? Reprod Biol Endocrinol. 2016;14(1):26. doi: 10.1186/s12958-016-0162-0
29. Poppe K, Glinoer D, Tournaye H, et al. Impact of Ovarian Hyperstimulation on Thyroid Function in Women with and without Thyroid Autoimmunity. J Clin Endocrinol Metab. 2004;89(8):3808-3812. doi: 10.1210/jc.2004-0105
30. Lazzarin N, Moretti C, De Felice G, et al. Further Evidence on the Role of Thyroid Autoimmunity in Women with Recurrent Miscarriage. Int J Endocrinol. 2012;2012(8):1-4. doi: 10.1155/2012/717185
Further Evidence on the Role of Thyroid Autoimmunity in Women with Recurrent Miscarriage. Int J Endocrinol. 2012;2012(8):1-4. doi: 10.1155/2012/717185
31. Monteleone P, Parrini D, Faviana P, et al. Female Infertility Related to Thyroid Autoimmunity: The Ovarian Follicle Hypothesis. Am J Reprod Immunol. 2011;66(2):108-114. doi: 10.1111/j.1600-0897.2010.00961.x
32. Kelkar RL, Meherji PK, Kadam SS, et al. Circulating auto-antibodies against the zona pellucida and thyroid microsomal antigen in women with premature ovarian failure. J Reprod Immunol. 2005;66(1):53-67. doi: 10.1016/j.jri.2005.02.003
Ответы на вопросы пациентов
Рабият, 35 лет, Москва
Добрый день!мне 36 лет. год планируем ребенка. имеются две межмышечные миомы одна 15 мм и 12 мм. в сентябре сдавала на гормоны:
год планируем ребенка. имеются две межмышечные миомы одна 15 мм и 12 мм. в сентябре сдавала на гормоны:
ТТГ 0.990 мЕд/л
ФСГ 6.40 мЕд/мл
ЛГ 2.47 мЕд/мл
Эстрадиол 166 пмоль/л
ГСПГ 26.8 нмоль/л
Пролактин 356 мЕд/л
Дигидротестостерон 337 пг/мл
Анти-Мюллеров гормон <0.13 нг/мл, в октябре повторила
Анти-Мюллеров гормон 0.39 нг/мл
в декабре была самостоятельная беременность, хгч был 146Мед/мл, тесты показывали 2-3 недели, было сильное переутомление организма в связи с чем произошел самопроизвольный выкидыш без чистки.
прошла курс лечения, принимала овариум композитум, фемостон и 11 мая снова тесты показали положительный результат(последние менструации были 9 апреля), хгч было 24 Мед/мл, Фибриноген 4.4 г/л, D-димер 127 нг/мл , Гомоцистеин 8.33 мкмоль/л
назначили сохраняющие утрожестан, дивигель, прогинова, В6 форте,прогестерон, ношпу и тромбо асс, однако 18 мая хгч был уже 1 Мед/мл, тесты ничего не показывали, на УЗИ тоже ничего не было видно. лекарства прекратила пить и через день пошли месячные. У мужа показатели спермограммы хорошие, паталогий нет.Врач рекомендует делать ЭКО. нужно ли мне его делать если зачатие происходит, Можете ли вы мне в моей ситуации помочь выносить ребенка? если да то когда я могу приехать?
лекарства прекратила пить и через день пошли месячные. У мужа показатели спермограммы хорошие, паталогий нет.Врач рекомендует делать ЭКО. нужно ли мне его делать если зачатие происходит, Можете ли вы мне в моей ситуации помочь выносить ребенка? если да то когда я могу приехать?
Добрый день.
Миомы матки очень маловероятно влияют на вынашиваете беременности. Учитывая крайне низкий Антимюллеров гормон, скорее всего причиной невынашивания беременности является плохое качество яйцеклеток. К сожалению, при таком уровне Антимюллерова гормона в большинстве случаев ЭКО со стимуляцией собственных яичников малоэффективно. В такой ситуации мы рекомендуем ЭКО с донорскими яйцеклетками. Однако, чтобы окончательно разобраться в ситуации, и понять, как мы можем вам помочь, и возможно ли беременность с вашими яйцеклетками, вам конечно лучше приехать на личную консультацию, взяв с собой обязательно все анализы, УЗИ, заключения специалистов, так как существует множество других нюансов, влияющих на зачатие и вынашиваете беременности.
С уважением, врач акушер-гинеколог, гинеколог-эндокринолог, к.м.н. Жахур Н.А.
Антимюллеровский гормон (АМГ, анти-мюллеров гормон, антимюллеровый, антимюллеров гормон) (определение уровня в крови)
Артикул: 00140
Стоимость анализа
в лаборатории:
Обычный
1 790рубстоимость указана без учета стоимости забора биологического материала
Добавить в корзинуСинонимы: ингибирующее вещество Мюллера (MIS), ингибирующий гормон Мюллера (MIH), ингибирующий фактор Мюллера (MIF), Мюллеров ингибитор.
Готовность результатов анализа
Обычные*: 4 к.д.
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Забор биоматериала
Методы выполнения и тесты
Иммуноанализ. Количественный тест, нг/мл
Количественный тест, нг/мл
Файлы
Скачать образец результата анализаЭтот анализ входит в блоки:
Для чего это нужно
Измерение уровней сывороточного АМГ является важным маркером репродуктивного статуса как у мужчин, так и у женщин. Концентрация АМГ лучше всего отражает снижение репродуктивной функции у здоровых женщин с доказанной фертильностью: она коррелирует с количеством антральных фолликулов и возрастом женщины. Определение уровня АМГ также используется для определения предположительного ответа яичников на стимуляции при ЭКО. Патологические уровни АМГ у мальчиков могут говорить о нарушениях полового созревания. С последними публикациями об АМГ можно ознакомиться здесь.
АМГ – маркер овариального резерва, который имеет высокую воспроизводимость (достаточно единственного определения АМГ), уровень которого, измеренный в течение менструального цикла, не имеет значительных колебаний.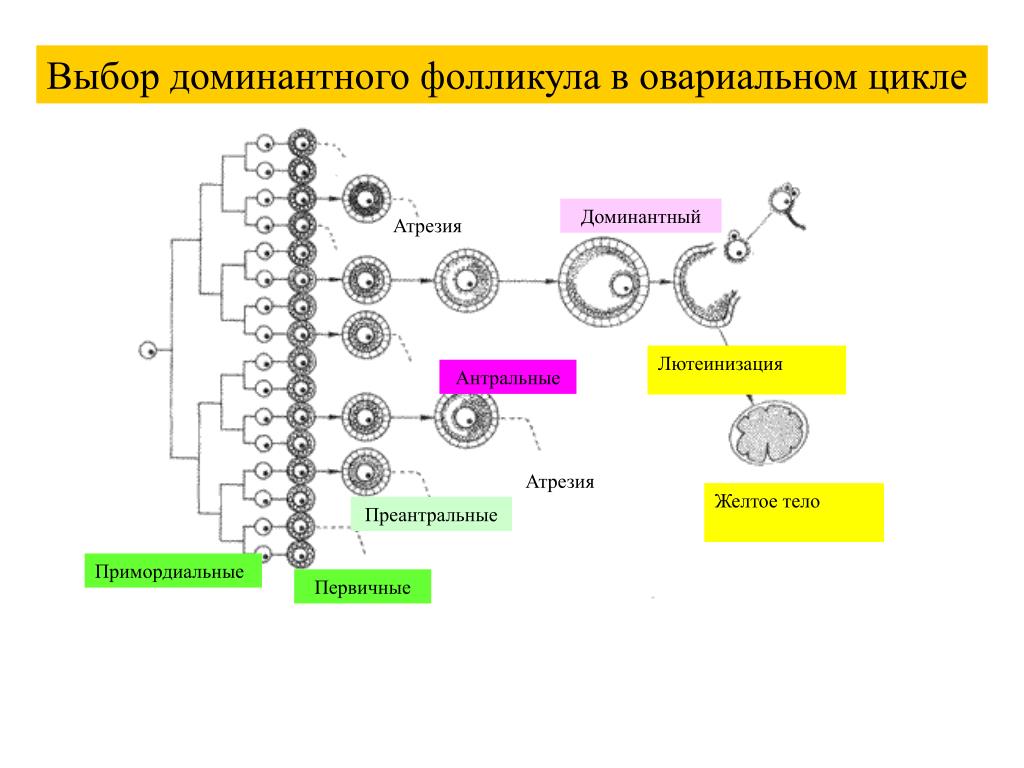
Определение уровня АМГ проводится в следующих случаях:
-
определение овариального статуса у женщин
-
для успешного прогноза получения ооцитов и клинической беременности в проколах ЭКО
-
СПКЯ (синдрома поликистозных яичников)
-
опухоли гранулезных клеток
-
задержка и преждевременное половое созревание у мальчиков
-
крипторхизм и анорхия у мальчиков
-
гермафродитизм у детей
Антимюллеров гормон (АМГ). Что такое АМГ. Когда, как и зачем надо исследовать уровень АМГ
Также спрашивают:
С этим анализом сдают:
Как сдать анализы в Лабораториях ЦИР?
Для экономии времени оформите заказ на анализ в Интернет-магазине! Оплачивая заказ онлайн, Вы получаете скидку 10% на весь оформленный заказ!
У Вас есть вопросы? Напишите нам или позвоните +7 (495) 514-00-11. По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
Антимюллеров гормон — Библиотека — Библиотека — Полезная информация — Медицинский центр
В данной статье рассмотрена роль, которую играет в яичнике антимюллеровый гормон (АМГ), представитель факторов роста и дифференциации из числа трансформирующего фактора роста β. АМГ осуществляет ингибирующее влияние на привлечение примордиальных фолликулов в цикл развития и также может ингибировать зависимый от фолликулостимулирующего гормона отбор доминирующих фолликулов. Кроме упомянутой функциональной роли в яичнике, АМГ сыворотки является прекрасным претендентом на роль маркера овариального резерва, не только у пациентов клиник по лечению бесплодия, а и у женщин во время и после онкотерапии.
Яичник является уникальным органом женского организма. Для выполнения двух его основных функций — синтеза женских половых стероидных гормонов и женских гамет — клетки яичника непрерывно проходят программу развития, которая в определенной степени похожа на многочисленные процессы, происходящие в течение эмбрионального развития. Другим уникальным аспектом является то, что яичник прекращает функционировать еще задолго до того, как начинает угасать функция других органов в процессе старения, что приводит как к бесплодию, так и до наступления физиологических процессов, связанных с отсутствием женских половых стероидных гормонов, то есть до менопаузы.
Другим уникальным аспектом является то, что яичник прекращает функционировать еще задолго до того, как начинает угасать функция других органов в процессе старения, что приводит как к бесплодию, так и до наступления физиологических процессов, связанных с отсутствием женских половых стероидных гормонов, то есть до менопаузы.
Во время эмбрионального развития в яичнике располагается популяция зародышевых половых клеток, которые после миграции и пролиферации вступают в первую стадию мейоза, но не завершают этот процесс. Указанные зародышевые половые клетки окружаются соматическими клетками, которые формируют так называемые примордиальные фолликулы примерно на 20-й неделе беременности, тогда как зародышевые половые клетки, не окруженные соматическими, погибают путем апоптоза. Сразу же после образования, некоторые примордиальные фолликулы входят в пул фолликулов, которые растут: окруженный соматическими клетками ооцит увеличивается в размерах, а клетки, которые его окружают (которые теперь называются клетками зернистого слоя), приобретают столбчатую форму и начинают пролиферировать, так называемый процесс рекрутмента (привлечение, recruitment). Этот процесс продолжается в течение жизни до тех пор, пока не истощится пул примордиальных фолликулов, результатом чего является наступление менопаузы у женщин. Растущие фолликулы подлежат гибели путем атрезии — процесс, который предусматривает апоптоз зернистых клеток и ооцита. Атрезия наступает в том случае, если фолликул не спасется от гибели гонадотропным гормоном гипофиза — ФСГ. Такое спасение, также известное как селекция, возможно только после полового созревания, когда активируется эндокринная ось гипофиз-половых желез. в фолликулах, которые продолжают рост под контролем ФСГ (множественные у таких видов как мышь или крыса; обычно только один у человека), в конце концов запускается механизм высвобождения ооцита для оплодотворения под действием еще одного гонадотропина — лютеинизирующего гормона (ЛГ). В ходе овуляции завершаются отсроченные конечные стадии мейоза ооцитов.
Этот процесс продолжается в течение жизни до тех пор, пока не истощится пул примордиальных фолликулов, результатом чего является наступление менопаузы у женщин. Растущие фолликулы подлежат гибели путем атрезии — процесс, который предусматривает апоптоз зернистых клеток и ооцита. Атрезия наступает в том случае, если фолликул не спасется от гибели гонадотропным гормоном гипофиза — ФСГ. Такое спасение, также известное как селекция, возможно только после полового созревания, когда активируется эндокринная ось гипофиз-половых желез. в фолликулах, которые продолжают рост под контролем ФСГ (множественные у таких видов как мышь или крыса; обычно только один у человека), в конце концов запускается механизм высвобождения ооцита для оплодотворения под действием еще одного гонадотропина — лютеинизирующего гормона (ЛГ). В ходе овуляции завершаются отсроченные конечные стадии мейоза ооцитов.
Такой процесс кажется очень «расточительным». Очевидно, после периода эмбрионального развития новые примордиальные фолликулы не формируются, хотя недавно эти классические взгляды на функционирование яичника были подвергнуты сомнению со стороны Johnson et al. (2), которые, используя сочетание различных методов клеточной биологии, показали, что в яичнике мышей может происходить частичное новообразование примордиальных фолликулов. Однако, остается неясным, насколько этот процесс может способствовать продолжению продолжительности жизни популяции примордиальных фолликулов. Из примерно 7000000 зародышевых половых клеток, присутствующих в яичнике человека в период эмбрионального развития, всего около 500 в конечном счете пройдут овуляцию и получат возможность быть оплодотворенными. Таким образом, процессы рекрутмента и селекции фолликулов безусловно должны быть под строгим контролем.
(2), которые, используя сочетание различных методов клеточной биологии, показали, что в яичнике мышей может происходить частичное новообразование примордиальных фолликулов. Однако, остается неясным, насколько этот процесс может способствовать продолжению продолжительности жизни популяции примордиальных фолликулов. Из примерно 7000000 зародышевых половых клеток, присутствующих в яичнике человека в период эмбрионального развития, всего около 500 в конечном счете пройдут овуляцию и получат возможность быть оплодотворенными. Таким образом, процессы рекрутмента и селекции фолликулов безусловно должны быть под строгим контролем.
Существует две ключевые точки в развитии, которые определяют будущую судьбу примордиального фолликула (рис. 1): 1) рекрутмент и начало роста и селекции фолликула; 2) спасение фолликула от атрезии и дальнейшей селекции преовуляторного фолликула (1).
ФАКТОРЫ, КОТОРЫЕ ПРИНИМАЮТ УЧАСТИЕ В РЕКРУТМЕНТЕ
Молекулярные механизмы, которые регулируют рекрутмент примордиальных фолликулов, в значительной мере остаются неизвестными. Скорость, с которой происходит рекрутмент, зависит от размеров пула примордиальных фолликулов, что подтверждается наблюдаемым экспоненциальным уменьшением количества фолликулов в яичнике с возрастом (3). Кроме того, обнаружено несколько ростовых факторов, которые задействованы в инициации или ингибировании роста. Так, было обнаружено, что рост примордиальных фолликулов стимулируется фактором стволовых клеток (SCF) — важным фактором роста во время миграции и пролиферации первичных зародышевых половых клеток (4) — и другими факторами роста, например фактором, который ингибирует лейкемией (LIF), инсулином, основным фактором роста фибробластов (bFGF) (5-8). Также в этом процессе привлечены ростовые факторы из семьи трансформирующего фактора роста β (TGF-β). Фактор морфогенеза костей 4 (BMP4) стимулирует выживание примордиальных фолликулов и переход от примордиальных к первичному фолликула в культуре in vitro (6). Кроме того, отсутствие GDF9, ооцит-специфического представителя семьи TGF-β, приводит к блокировке фолликулогенеза на стадии первичного фолликула (9), хотя сам по себе GDF9, кажется, не задействован в рекрутменте примордиальных фолликулов (7).
Скорость, с которой происходит рекрутмент, зависит от размеров пула примордиальных фолликулов, что подтверждается наблюдаемым экспоненциальным уменьшением количества фолликулов в яичнике с возрастом (3). Кроме того, обнаружено несколько ростовых факторов, которые задействованы в инициации или ингибировании роста. Так, было обнаружено, что рост примордиальных фолликулов стимулируется фактором стволовых клеток (SCF) — важным фактором роста во время миграции и пролиферации первичных зародышевых половых клеток (4) — и другими факторами роста, например фактором, который ингибирует лейкемией (LIF), инсулином, основным фактором роста фибробластов (bFGF) (5-8). Также в этом процессе привлечены ростовые факторы из семьи трансформирующего фактора роста β (TGF-β). Фактор морфогенеза костей 4 (BMP4) стимулирует выживание примордиальных фолликулов и переход от примордиальных к первичному фолликула в культуре in vitro (6). Кроме того, отсутствие GDF9, ооцит-специфического представителя семьи TGF-β, приводит к блокировке фолликулогенеза на стадии первичного фолликула (9), хотя сам по себе GDF9, кажется, не задействован в рекрутменте примордиальных фолликулов (7).
АНТИМЮЛЛЕРОВ ГОРМОН
Недавно было обнаружено, что еще один представитель семейства TGF-β — антимюллеров гормон (АМГ) — играет важную роль в регуляции процесса рекрутмента. АМГ впервые обнаружили как фактор эмбриональных яичек, который сигнализирует регрессию мюллеровых протоков у плода мужского пола. Однако, экспрессия АМГ происходит и в яичнике (рис. 2). Все фолликулы, растущие до достижения стадии антрального фолликула у мышей (10) или размера примерно 6 мм в человека (10,11), экспрессируют АМГ. На самом деле, первые столбчатые клетки в переходных примордиальных фолликулах также являются положительными по иммунореактивности на АМГ. Такой характер экспрессии белка АМГ указывает на то, что АМГ может играть особую роль в регуляции роста фолликула: его экспрессия осуществляется сразу же после рекрутмента и прекращается в фолликулах, отобранных для овуляции. Для изучения возможной роли АМГ в рекрутменте фолликулов было определено динамику развития фолликулов у мышей с ноль-мутацией гена АМГ (12). В яичниках 4-месячных мышей с ноль-мутацией по гену АМГ было выявлено почти втрое больше растущих фолликулов чем у мышей дикого типа; при этом количество примордиальных фолликулов была снижена [Рис. 3, (10)]. Повышение количества растущих фолликулов наблюдалось уже на 25-м дне, перед началом эстрального цикла у мышей, а усиление рекрутмента приводило к преждевременному истощению пула примордиальных фолликулов в 13-месячных мышей с ноль-мутацией по гену АМГ (рис. 3). Такие результаты указывали на то, что АМГ может иметь ингибирующее влияние на рекрутмент фолликулов. Действительно, АМГ ингибирует рекрутмент примордиальных фолликулов в in vitro культурах неонатальных яичников (13).
В яичниках 4-месячных мышей с ноль-мутацией по гену АМГ было выявлено почти втрое больше растущих фолликулов чем у мышей дикого типа; при этом количество примордиальных фолликулов была снижена [Рис. 3, (10)]. Повышение количества растущих фолликулов наблюдалось уже на 25-м дне, перед началом эстрального цикла у мышей, а усиление рекрутмента приводило к преждевременному истощению пула примордиальных фолликулов в 13-месячных мышей с ноль-мутацией по гену АМГ (рис. 3). Такие результаты указывали на то, что АМГ может иметь ингибирующее влияние на рекрутмент фолликулов. Действительно, АМГ ингибирует рекрутмент примордиальных фолликулов в in vitro культурах неонатальных яичников (13).
Anti-Mullerian hormone and polycystic ovary syndrome | Nikolaenkov
Polycystic ovary syndrome (PCOS) is the most common form of normogonadotropic ovarian insufficiency, hyperandrogenaemy and anovulation sterility. One of the probable causes of this disease is disturbance of folliculogenesis, which is accompanied by overproduction of anti-Mullerian hormone (AMH) by ovarian tissue. There is a literature review about structure, biological properties and the role of AMH in pathogenesis of PCOS in this article.
There is a literature review about structure, biological properties and the role of AMH in pathogenesis of PCOS in this article.
Синдром поликистозных яичников (СПЯ) — это заболевание, характеризующееся нарушением процессов фолликулогенеза, задержкой фолликулов на стадии малых и больших антральных при сохранении числа примордиальных, отсутствием инициации доминантного фолликула и, как следствие, нарушением процессов овуляции, клинически проявляющимся опсо- и аменореей; гирсутизмом, угревой сыпью; изменением размера, формы и структуры яичников в виде их поликистозной трансформации [56]. Синдром поликистозных яичников выявляется у 6-8 % женщин репродуктивного возраста [9, 10]. В этих пределах его частота варьирует у представительниц различных этнических групп [29]. В России она составляет 6,4 % [3]. СПЯ является самой распространённой формой гиперандрогенемии, занимая 80-90 % в его структуре [41].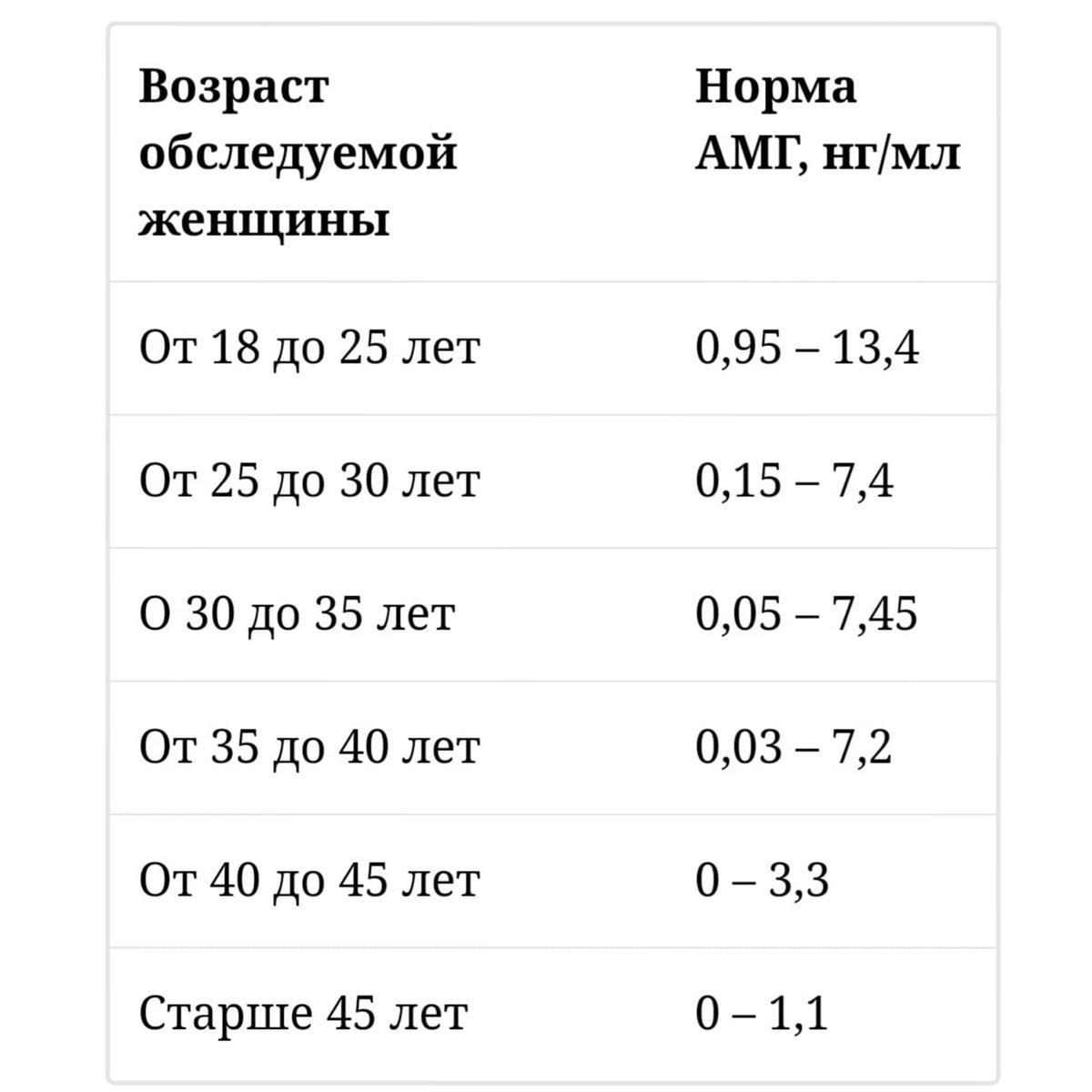 СПЯ диагностируется у 15-20 % женщин с бесплодием [11]. Среди больных с функциональным бесплодием доля этого синдрома достигает 53 % [6], причём при ановуляции его частота приближается к 75 % [4]. Рядом исследователей было обнаружено повышение содержания антимюллерова гормона (АМГ) в крови [1, 2, 49], фолликулярной жидкости [17] и гранулёзных клетках антральных фолликулов [1, 50] яичников больных СПЯ. АМГ представляет собой димерный гликопротеид с молекулярной массой 140 кДа, состоящий из двух гомологичных субъединиц, объединенных дисульфидной связью. АМГ относится к семейству цитокинов трансформирующего фактора роста-β (ТФР-β) [17]. Это семейство включает в себя более тридцати пяти структурно схожих пептидов. Сюда входят активины, ингибины, костный морфогенетический белок [43]. Расщепляясь, АМГ образует активный С-концевой фрагмент. Его мишенями являются только органы репродуктивной системы. Члены семейства трансформирующего фактора роста-β реализуют свои функции после взаимодействия с трансмембранными серин/треонин киназными рецепторами.
СПЯ диагностируется у 15-20 % женщин с бесплодием [11]. Среди больных с функциональным бесплодием доля этого синдрома достигает 53 % [6], причём при ановуляции его частота приближается к 75 % [4]. Рядом исследователей было обнаружено повышение содержания антимюллерова гормона (АМГ) в крови [1, 2, 49], фолликулярной жидкости [17] и гранулёзных клетках антральных фолликулов [1, 50] яичников больных СПЯ. АМГ представляет собой димерный гликопротеид с молекулярной массой 140 кДа, состоящий из двух гомологичных субъединиц, объединенных дисульфидной связью. АМГ относится к семейству цитокинов трансформирующего фактора роста-β (ТФР-β) [17]. Это семейство включает в себя более тридцати пяти структурно схожих пептидов. Сюда входят активины, ингибины, костный морфогенетический белок [43]. Расщепляясь, АМГ образует активный С-концевой фрагмент. Его мишенями являются только органы репродуктивной системы. Члены семейства трансформирующего фактора роста-β реализуют свои функции после взаимодействия с трансмембранными серин/треонин киназными рецепторами. АМГ действует на специфические рецепторы двух типов: АМГР-I и АМГР-II. Рецепторы АМГ II типа появляются после соединения специфических лигандов, независимых от рецепторов I типа, однако для запуска сигнального пути действия АМГ необходимо наличие рецепторов обоих типов [20]. Рецепторы I типа имеют промежуточное значение, так как их активация происходит уже после запуска сигнального пути АМГ, когда рецепторы II типа уже активированы [38]. В середине ХХ века проведены первые эксперименты, показавшие, что эмбриональные яички млекопитающих выделяют субстанцию, которая способна вызывать регрессию Мюллерова протока и приводить к фенотипической перестройке организма по мужскому типу. Это вещество в 1947 году впервые выделил французский эндокринолог Alfred Jost. Вещество было названо «антимюллеровская субстанция» или антимюллеров гормон. В 1986 году АМГ был отнесён к семейству ТФР-β [17]. АМГ продуцируется эмбриональными яичками и приводит к регрессии Мюллерова протока у плодов мужского пола. При дефиците АМГ или его рецептора формируется синдром персистенции Мюллерова протока, который характеризуется наличием маточных труб, матки и верхней трети влагалища у генетически-детерминированных плодов мужского пола [13].
АМГ действует на специфические рецепторы двух типов: АМГР-I и АМГР-II. Рецепторы АМГ II типа появляются после соединения специфических лигандов, независимых от рецепторов I типа, однако для запуска сигнального пути действия АМГ необходимо наличие рецепторов обоих типов [20]. Рецепторы I типа имеют промежуточное значение, так как их активация происходит уже после запуска сигнального пути АМГ, когда рецепторы II типа уже активированы [38]. В середине ХХ века проведены первые эксперименты, показавшие, что эмбриональные яички млекопитающих выделяют субстанцию, которая способна вызывать регрессию Мюллерова протока и приводить к фенотипической перестройке организма по мужскому типу. Это вещество в 1947 году впервые выделил французский эндокринолог Alfred Jost. Вещество было названо «антимюллеровская субстанция» или антимюллеров гормон. В 1986 году АМГ был отнесён к семейству ТФР-β [17]. АМГ продуцируется эмбриональными яичками и приводит к регрессии Мюллерова протока у плодов мужского пола. При дефиците АМГ или его рецептора формируется синдром персистенции Мюллерова протока, который характеризуется наличием маточных труб, матки и верхней трети влагалища у генетически-детерминированных плодов мужского пола [13]. Длительное время считалось, что АМГ выполняет исключительно функцию регрессии Мюллерова протока у плодов мужского пола, однако в дальнейшем выяснились иные функции этого гормона, относящиеся к тканям яичников, где АМГ продуцируется, начиная с 36-й недели внутриутробного развития [53] вплоть до менопаузы. В неонатальном периоде его уровень в сыворотке крови постепенно увеличивается, достигая максимума к пубертатному периоду, в течение репродуктивного возраста снижается и достигает неопределяемых значений к менопаузе [49]. Антимюллеров гормон продуцируется гранулёзными клетками растущих фолликулов от стадии первичных, достигая максимума в малых антральных и практически исчезает в фолликулах размерами более 9 мм [49]. Он не синтезируется ни атретическими фолликулами, ни клетками теки. Уровень АМГ в крови тесно коррелирует с количеством антральных фолликулов [21, 32, 39, 48, 50, 61]. Durlinger A. L. и соавторы [24] проводили обработку яичников двухдневных мышей рекомбинантным АМГ. Контролем служили интактные яичники мышей того же возраста.
Длительное время считалось, что АМГ выполняет исключительно функцию регрессии Мюллерова протока у плодов мужского пола, однако в дальнейшем выяснились иные функции этого гормона, относящиеся к тканям яичников, где АМГ продуцируется, начиная с 36-й недели внутриутробного развития [53] вплоть до менопаузы. В неонатальном периоде его уровень в сыворотке крови постепенно увеличивается, достигая максимума к пубертатному периоду, в течение репродуктивного возраста снижается и достигает неопределяемых значений к менопаузе [49]. Антимюллеров гормон продуцируется гранулёзными клетками растущих фолликулов от стадии первичных, достигая максимума в малых антральных и практически исчезает в фолликулах размерами более 9 мм [49]. Он не синтезируется ни атретическими фолликулами, ни клетками теки. Уровень АМГ в крови тесно коррелирует с количеством антральных фолликулов [21, 32, 39, 48, 50, 61]. Durlinger A. L. и соавторы [24] проводили обработку яичников двухдневных мышей рекомбинантным АМГ. Контролем служили интактные яичники мышей того же возраста. В этот период яичники мышей содержат отдельные ооциты, примордиальные и единичные первичные фолликулы. Через два дня в исследуемой группе количество первичных фолликулов было на 40 % меньше, чем в контрольной группе. Из этого был сделан вывод, что АМГ тормозит формирование первичных фолликулов. Grossman M. и соавторы [30] культивировали in vitro клетки гранулёзы, полученные из яичников женщин во время проведения экстракорпорального оплодотворения. В культуре клеток определяли содержание эстрадиола и уровень экспрессии матричной рибонуклеиновой кислоты цитохрома Р-450 (м-РНК СУР-19). Содержание эстрадиола было значимо больше там, где культивирование клеток происходило без добавления АМГ. Кроме того, обработка культуры клеток АМГ приводила как к снижению эстрадиола, так и к уменьшению содержания м-РНК СУР-19. Полученные результаты говорят о снижении экспрессии ФСГ-зависимой ароматазы клеток гранулёзы под воздействием АМГ. Учитывая тот факт, что содержание АМГ в фолликулярной жидкости предоминантного и доминантного фолликулов ничтожно мало [49], т.
В этот период яичники мышей содержат отдельные ооциты, примордиальные и единичные первичные фолликулы. Через два дня в исследуемой группе количество первичных фолликулов было на 40 % меньше, чем в контрольной группе. Из этого был сделан вывод, что АМГ тормозит формирование первичных фолликулов. Grossman M. и соавторы [30] культивировали in vitro клетки гранулёзы, полученные из яичников женщин во время проведения экстракорпорального оплодотворения. В культуре клеток определяли содержание эстрадиола и уровень экспрессии матричной рибонуклеиновой кислоты цитохрома Р-450 (м-РНК СУР-19). Содержание эстрадиола было значимо больше там, где культивирование клеток происходило без добавления АМГ. Кроме того, обработка культуры клеток АМГ приводила как к снижению эстрадиола, так и к уменьшению содержания м-РНК СУР-19. Полученные результаты говорят о снижении экспрессии ФСГ-зависимой ароматазы клеток гранулёзы под воздействием АМГ. Учитывая тот факт, что содержание АМГ в фолликулярной жидкости предоминантного и доминантного фолликулов ничтожно мало [49], т. е. АМГ находится в фолликулах, находящихся в стадиях, предшествующих гормонально-зависимому росту, некоторыми исследователями выдвинуто предположение, что АМГ защищает фолликулы от преждевременного митогенного влияния фолликулостимулирующего гормона [1]. Содержание в сыворотке крови АМГ отрицательно коррелирует с возрастом. В исследовании, охватившем более тысячи женщин от 20 до 50 лет с регулярным менструальным циклом, было показано, что среднее содержание АМГ в сыворотке крови женщин возрастной группы от 20 лет до 31 года составляет 4,2 нг/мл, тогда как к возрастному периоду от 41 года до 50 лет снижается до 0,6 нг/мл [32] (рис. 1). Рис. 1. Связь уровня АМГ с возрастом женщин Исследование, проведённое Saifer D. B. с соавторами [57] и охватившее 17120 женщин в возрасте от 24 до 50 лет позволило выявить не только средний уровень АМГ в крови, характерный для определённого возраста, но и определить темп снижения его уровня, который составил 0,2 нг/мл ежегодно до 40 лет и 0,1 нг/мл в год после 40 лет.
е. АМГ находится в фолликулах, находящихся в стадиях, предшествующих гормонально-зависимому росту, некоторыми исследователями выдвинуто предположение, что АМГ защищает фолликулы от преждевременного митогенного влияния фолликулостимулирующего гормона [1]. Содержание в сыворотке крови АМГ отрицательно коррелирует с возрастом. В исследовании, охватившем более тысячи женщин от 20 до 50 лет с регулярным менструальным циклом, было показано, что среднее содержание АМГ в сыворотке крови женщин возрастной группы от 20 лет до 31 года составляет 4,2 нг/мл, тогда как к возрастному периоду от 41 года до 50 лет снижается до 0,6 нг/мл [32] (рис. 1). Рис. 1. Связь уровня АМГ с возрастом женщин Исследование, проведённое Saifer D. B. с соавторами [57] и охватившее 17120 женщин в возрасте от 24 до 50 лет позволило выявить не только средний уровень АМГ в крови, характерный для определённого возраста, но и определить темп снижения его уровня, который составил 0,2 нг/мл ежегодно до 40 лет и 0,1 нг/мл в год после 40 лет. Построение графика снижения АМГ для каждой конкретной женщины может дать достаточно точное представление о возрасте предстоящей менопаузы. Имеются данные о том, что АМГ практически не подвержен колебаниям в течение менструального цикла [31, 37], не меняется во время беременности [34], во время приема агонистов гонадотропин-рилизинг гормона (аГРГ) [44] и контрацептивных препаратов [8, 21]. В дальнейшем было показано существенное его снижение в сыворотке крови при использовании комбинированных оральных контрацептивных препаратов, содержащих этинилэстрадиол и дезогестрел, вагинальных колец, содержащих этинилэстрадиол и этоногестрел и трансдермальных пластырей, содержащих этинилэстрадиол и норэлгестромин [33]. Кроме того, более низкие значения уровня АМГ были определены в крови у женщин, применявших гормональные контрацептивные препараты [22]. В течение менструального цикла незначительные колебания АМГ вполне могут присутствовать и характеризуются некоторым его снижением в секреторную фазу [59].
Построение графика снижения АМГ для каждой конкретной женщины может дать достаточно точное представление о возрасте предстоящей менопаузы. Имеются данные о том, что АМГ практически не подвержен колебаниям в течение менструального цикла [31, 37], не меняется во время беременности [34], во время приема агонистов гонадотропин-рилизинг гормона (аГРГ) [44] и контрацептивных препаратов [8, 21]. В дальнейшем было показано существенное его снижение в сыворотке крови при использовании комбинированных оральных контрацептивных препаратов, содержащих этинилэстрадиол и дезогестрел, вагинальных колец, содержащих этинилэстрадиол и этоногестрел и трансдермальных пластырей, содержащих этинилэстрадиол и норэлгестромин [33]. Кроме того, более низкие значения уровня АМГ были определены в крови у женщин, применявших гормональные контрацептивные препараты [22]. В течение менструального цикла незначительные колебания АМГ вполне могут присутствовать и характеризуются некоторым его снижением в секреторную фазу [59]. В отделениях вспомогательных репродуктивных технологий определение в крови АМГ является рутинным методом исследования, как прогностического критерия эффективности стимуляции яичников и получения необходимого числа ооцитов, удовлетворяющих репродуктологическим критериям качества [7, 36, 61]. Содержание АМГ в сыворотке крови коррелирует с чувствительностью ответа яичников на гонадотропную стимуляцию [15]. В последние годы большое внимание уделяется изучению связи АМГ с синдромом гиперстимуляции яичников [46]. В проспективном исследовании была выявлена достоверная положительная связь эффективности стимуляции овуляции гонадотропинами с уровнем АМГ в сыворотке крови, а также с благоприятным течением последующей беременности [47]. Проведенное Broekmans F. J. и соавторами [14] исследование не подтвердило наличие закономерности исходов беременностей после ЭКО с содержанием АМГ в сыворотке крови. В этих исследованиях не выделялись группы больных с высоким содержанием АМГ в сыворотке крови, поэтому эти результаты могут значительно отличаться от предшествующих.
В отделениях вспомогательных репродуктивных технологий определение в крови АМГ является рутинным методом исследования, как прогностического критерия эффективности стимуляции яичников и получения необходимого числа ооцитов, удовлетворяющих репродуктологическим критериям качества [7, 36, 61]. Содержание АМГ в сыворотке крови коррелирует с чувствительностью ответа яичников на гонадотропную стимуляцию [15]. В последние годы большое внимание уделяется изучению связи АМГ с синдромом гиперстимуляции яичников [46]. В проспективном исследовании была выявлена достоверная положительная связь эффективности стимуляции овуляции гонадотропинами с уровнем АМГ в сыворотке крови, а также с благоприятным течением последующей беременности [47]. Проведенное Broekmans F. J. и соавторами [14] исследование не подтвердило наличие закономерности исходов беременностей после ЭКО с содержанием АМГ в сыворотке крови. В этих исследованиях не выделялись группы больных с высоким содержанием АМГ в сыворотке крови, поэтому эти результаты могут значительно отличаться от предшествующих. Уровень АМГ резко повышен в крови 93 % больных гранулёзоклеточным раком яичников. Среднее его значение составляет 190,3 нг/мл при вариабельности от 2 нг/мл до 1124 нг/мл [54, 55]. Повышение содержания АМГ в сыворотке крови больных гранулёзоклеточным раком яичников на 4-5 месяцев предшествует развитию клинической картины этого заболевания, поэтому АМГ является высокоинформативным маркером и хорошим диагностическим критерием этого заболевания. Кроме того, АМГ является высокоинформативным критерием возможности послеоперационного рецидивирования гранулёзоклеточного рака. Несмотря на то, что большинство опухолей яичников происходит из целомического эпителия, в настоящее время всё большее количество исследований свидетельствует о том, что доля опухолей из фимбриального отдела маточных труб и прочих компонентов мюллерова протока неуклонно растёт [23]. Так как АМГ приводит к редукции мюллеровых протоков у плодов мужского пола, возникло предположение о возможности применения АМГ для лечения опухолей этого происхождения.
Уровень АМГ резко повышен в крови 93 % больных гранулёзоклеточным раком яичников. Среднее его значение составляет 190,3 нг/мл при вариабельности от 2 нг/мл до 1124 нг/мл [54, 55]. Повышение содержания АМГ в сыворотке крови больных гранулёзоклеточным раком яичников на 4-5 месяцев предшествует развитию клинической картины этого заболевания, поэтому АМГ является высокоинформативным маркером и хорошим диагностическим критерием этого заболевания. Кроме того, АМГ является высокоинформативным критерием возможности послеоперационного рецидивирования гранулёзоклеточного рака. Несмотря на то, что большинство опухолей яичников происходит из целомического эпителия, в настоящее время всё большее количество исследований свидетельствует о том, что доля опухолей из фимбриального отдела маточных труб и прочих компонентов мюллерова протока неуклонно растёт [23]. Так как АМГ приводит к редукции мюллеровых протоков у плодов мужского пола, возникло предположение о возможности применения АМГ для лечения опухолей этого происхождения. Причём in vitro уже получены данные о регрессе опухолевых клеток под воздействием АМГ. Masiakos P. T. с соавторами [42] провели обработку культур клеток, полученных от 27 больных с серозной цистаденокарциномой яичников III-IVстадии заболевания рекомбинантным АМГ. Те опухолевые клетки, которые содержали АМГР-II, в 82 % не создавали колоний и скорость их деления резко снижалась. Stephen A. E. и соавторы [58] проводили эксперименты, в которых лабораторным мышам под почечную капсулу вводились клетки рака яичника человека. После появления опухоли наблюдали за её ростом в контрольной группе и в группе мышей, парентерально получавших рекомбинантный АМГ. У мышей, получавших рекомбинантный АМГ в течение двух или трех недель, размеры опухоли были статистически значимо меньше. СПЯ характеризуется увеличением числа антральных фолликулов в яичниках, отсутствием селекции доминантного фолликула при сохраненном числе примордиальных и первичных фолликулов. Одним из звеньев этих изменений фолликулогенеза может быть АМГ.
Причём in vitro уже получены данные о регрессе опухолевых клеток под воздействием АМГ. Masiakos P. T. с соавторами [42] провели обработку культур клеток, полученных от 27 больных с серозной цистаденокарциномой яичников III-IVстадии заболевания рекомбинантным АМГ. Те опухолевые клетки, которые содержали АМГР-II, в 82 % не создавали колоний и скорость их деления резко снижалась. Stephen A. E. и соавторы [58] проводили эксперименты, в которых лабораторным мышам под почечную капсулу вводились клетки рака яичника человека. После появления опухоли наблюдали за её ростом в контрольной группе и в группе мышей, парентерально получавших рекомбинантный АМГ. У мышей, получавших рекомбинантный АМГ в течение двух или трех недель, размеры опухоли были статистически значимо меньше. СПЯ характеризуется увеличением числа антральных фолликулов в яичниках, отсутствием селекции доминантного фолликула при сохраненном числе примордиальных и первичных фолликулов. Одним из звеньев этих изменений фолликулогенеза может быть АМГ. В конце 90-х годов прошлого столетия выявлено, что уровень АМГ в сыворотке крови больных СПЯ в 2-3 раза выше, чем у женщин с неизменёнными яичниками [27]. Изначально предполагалось, что это повышение связано с увеличением количества малых антральных фолликулов, затем было показано, что продукция АМГ гранулёзными клетками больных СПЯ, сопровождающегося ановуляцией, в 75 раз выше, чем в нормальных яичниках [49]. Кроме того было выявлено, что содержание АМГ в фолликулярной жидкости больных СПЯ, сопровождающегося ановуляцией, в 5 раз выше, чем у при СПЯ в овуляторном цикле [19]. Pellatt L. с соавторами [49] показали, что активность клеток гранулёзы, продуцирующих АМГ, у больных СПЯ в 18 раз выше, чем у здоровых женщин. В последующих исследованиях был найден ряд симптомов заболевания, с которыми коррелирует содержание АМГ в сыворотке крови больных СПЯ. Так, Piouka A. и соавторами [52] были выделены четыре группы больных СПЯ: в первой группе у больных имелась ановуляция, проявляющаяся нарушением менструального цикла по типу опсо- или аменореи, гиперандрогенемия и поликистозная трансформация яичников по данным ультразвукового исследования, во второй — ановуляция и гиперандрогенемия, в третьей — гиперандрогенемия и поликистозная трансформация яичников, в четвертой — ановуляция и поликистозная трансформация яичников.
В конце 90-х годов прошлого столетия выявлено, что уровень АМГ в сыворотке крови больных СПЯ в 2-3 раза выше, чем у женщин с неизменёнными яичниками [27]. Изначально предполагалось, что это повышение связано с увеличением количества малых антральных фолликулов, затем было показано, что продукция АМГ гранулёзными клетками больных СПЯ, сопровождающегося ановуляцией, в 75 раз выше, чем в нормальных яичниках [49]. Кроме того было выявлено, что содержание АМГ в фолликулярной жидкости больных СПЯ, сопровождающегося ановуляцией, в 5 раз выше, чем у при СПЯ в овуляторном цикле [19]. Pellatt L. с соавторами [49] показали, что активность клеток гранулёзы, продуцирующих АМГ, у больных СПЯ в 18 раз выше, чем у здоровых женщин. В последующих исследованиях был найден ряд симптомов заболевания, с которыми коррелирует содержание АМГ в сыворотке крови больных СПЯ. Так, Piouka A. и соавторами [52] были выделены четыре группы больных СПЯ: в первой группе у больных имелась ановуляция, проявляющаяся нарушением менструального цикла по типу опсо- или аменореи, гиперандрогенемия и поликистозная трансформация яичников по данным ультразвукового исследования, во второй — ановуляция и гиперандрогенемия, в третьей — гиперандрогенемия и поликистозная трансформация яичников, в четвертой — ановуляция и поликистозная трансформация яичников. Были обследованы 50 больных СПЯ, у 25 больных отмечалось ожирение, у 25 определялась нормальная масса тела. В контрольную группу входили женщины с овуляторным менструальным циклом. Содержание АМГ в сыворотке крови было значительно выше у больных первой и второй группы, чем у больных третьей и четвертой группы. У женщин контрольной группы уровень АМГ в крови был ниже, чем у больных третьей и четвертой группы. У женщин с ожирением уровень АМГ в крови был ниже, чем у женщин с нормальной массой тела. Pellatt L. с соавторами [50] показали, что увеличение числа фолликулов даёт только 5,3 % от прироста уровня АМГ, остальное же является результатом увеличенной его продукции клетками гранулёзы. При СПЯ происходит увеличение содержания в яичниках фолликулов размерами 2-7 мм, и отсутствует инициация доминантного фолликула, что вероятнее всего связано с блокированием АМГ экспрессии ФСГ-зависимой ароматазы клеток гранулёзы [30]. Рядом исследователей [24, 25, 62] показано, что АМГ тормозит формирование первичных фолликулов, задерживая их на стадии примордиальных.
Были обследованы 50 больных СПЯ, у 25 больных отмечалось ожирение, у 25 определялась нормальная масса тела. В контрольную группу входили женщины с овуляторным менструальным циклом. Содержание АМГ в сыворотке крови было значительно выше у больных первой и второй группы, чем у больных третьей и четвертой группы. У женщин контрольной группы уровень АМГ в крови был ниже, чем у больных третьей и четвертой группы. У женщин с ожирением уровень АМГ в крови был ниже, чем у женщин с нормальной массой тела. Pellatt L. с соавторами [50] показали, что увеличение числа фолликулов даёт только 5,3 % от прироста уровня АМГ, остальное же является результатом увеличенной его продукции клетками гранулёзы. При СПЯ происходит увеличение содержания в яичниках фолликулов размерами 2-7 мм, и отсутствует инициация доминантного фолликула, что вероятнее всего связано с блокированием АМГ экспрессии ФСГ-зависимой ароматазы клеток гранулёзы [30]. Рядом исследователей [24, 25, 62] показано, что АМГ тормозит формирование первичных фолликулов, задерживая их на стадии примордиальных. Кроме того, в исследованиях на мышах показано, что АМГ участвует в формировании пула примордиальных фолликулов [48]. Причина повышения АМГ в сыворотке крови при СПЯ остаётся неизвестной. Повышенное его содержание в сыворотке крови может быть следствием воздействия ряда факторов, играющих ведущую роль в патогенезе СПЯ, например гиперандрогенемии. В поддержку этой гипотезы свидетельствуют данные о положительной корреляции между уровнем АМГ в крови и андрогенами, независимо полученные Pigny P. и соавторами в 2003 году [51], Laven J. S.E. и соавторами в 2004 году [39] и Eldar-Geva T. и соавторами в 2005 году [26]. Так, в исследовании Pigny P. и соавторов [51], включившем 59 больных СПЯ и 45 женщин контрольной группы, была выявлена достоверная положительная связь между АМГ, уровнем свободного тестостерона и андростендиона в сыворотке крови. У женщин с гиперандрогенемией и поликистозно изменёнными яичниками уровень АМГ в сыворотке крови был выше, чем у женщин с поликистозно изменёнными яичниками без гиперандрогенемии [26].
Кроме того, в исследованиях на мышах показано, что АМГ участвует в формировании пула примордиальных фолликулов [48]. Причина повышения АМГ в сыворотке крови при СПЯ остаётся неизвестной. Повышенное его содержание в сыворотке крови может быть следствием воздействия ряда факторов, играющих ведущую роль в патогенезе СПЯ, например гиперандрогенемии. В поддержку этой гипотезы свидетельствуют данные о положительной корреляции между уровнем АМГ в крови и андрогенами, независимо полученные Pigny P. и соавторами в 2003 году [51], Laven J. S.E. и соавторами в 2004 году [39] и Eldar-Geva T. и соавторами в 2005 году [26]. Так, в исследовании Pigny P. и соавторов [51], включившем 59 больных СПЯ и 45 женщин контрольной группы, была выявлена достоверная положительная связь между АМГ, уровнем свободного тестостерона и андростендиона в сыворотке крови. У женщин с гиперандрогенемией и поликистозно изменёнными яичниками уровень АМГ в сыворотке крови был выше, чем у женщин с поликистозно изменёнными яичниками без гиперандрогенемии [26]. Но результаты последующих исследований скорее опровергают гипотезу о стимулирующем влиянии андрогенов на прирост АМГ, чем подтверждают её. Несмотря на то, что в начале исследования, проведённого Carlsen S. M. и соавторами [16], имелась прямая корреляция между уровнем АМГ и андрогенами в крови больных СПЯ, после шестимесячной торможения синтеза андрогенов дексаметазоном уровень АМГ оставался неизменным. Помимо гиперандрогенемии, гиперинсулинемия также может претендовать на роль причины повышенного синтеза АМГ яичниками больных СПЯ. Значительно чаще гиперинсулинемия встречается у больных с ановуляторным, чем с овуляторным менструальным циклом [18]. Принимая во внимание факт усиления инсулином стимулированной гонадотропинами секреции андрогенов клетками гранулёзы и теки [64], нельзя исключить вторичной, опосредованной зависимости эффектов инсулина на синтез АМГ. Вместе с тем другими исследователями [35] связи уровня андрогенов и АМГ не было прослежено, но была продемонстрирована связь между содержанием АМГ в сыворотке крови и инсулинорезистентностью.
Но результаты последующих исследований скорее опровергают гипотезу о стимулирующем влиянии андрогенов на прирост АМГ, чем подтверждают её. Несмотря на то, что в начале исследования, проведённого Carlsen S. M. и соавторами [16], имелась прямая корреляция между уровнем АМГ и андрогенами в крови больных СПЯ, после шестимесячной торможения синтеза андрогенов дексаметазоном уровень АМГ оставался неизменным. Помимо гиперандрогенемии, гиперинсулинемия также может претендовать на роль причины повышенного синтеза АМГ яичниками больных СПЯ. Значительно чаще гиперинсулинемия встречается у больных с ановуляторным, чем с овуляторным менструальным циклом [18]. Принимая во внимание факт усиления инсулином стимулированной гонадотропинами секреции андрогенов клетками гранулёзы и теки [64], нельзя исключить вторичной, опосредованной зависимости эффектов инсулина на синтез АМГ. Вместе с тем другими исследователями [35] связи уровня андрогенов и АМГ не было прослежено, но была продемонстрирована связь между содержанием АМГ в сыворотке крови и инсулинорезистентностью. Eldar-Geva T. с соавторами [26] и Pigny P. с соавторами [51] эта вероятная причина повышения уровня АМГ не была подтверждена. Кроме того, при снижении уровня инсулина в крови при лечении больных СПЯ и восстановлении овуляции, последующего уменьшения содержания АМГ в крови не происходило [12, 16]. Двойное слепое исследование, проведенное Carlsen S. M. с соавторами [16], включало 50 больных СПЯ, которые соблюдали диету и получали метформин в дозе 850 мг три раза в сутки. Больные были рандомизированы в 2 группы: 25 человек принимали 0,25 мг дексаметазона ежедневно, 25 человек — плацебо. Исследование длилось 26 недель, завершило его 36 человек. Результаты оценивались спустя 8 и 26 недель лечения. Базальный уровень АМГ в крови, составивший в среднем 7,1 нг/мл, положительно коррелировал с уровнем тестостерона и отрицательно — с уровнем в крови ДГЭА-С. Шестимесячная терапия метформином и дексаметазоном не привела к снижению подавлению синтеза АМГ. Диетотерапия больных СПЯ, приводящая к увеличению количества овуляторных менструальных циклов, сопровождалась снижением уровня АМГ в сыворотке крови [45].
Eldar-Geva T. с соавторами [26] и Pigny P. с соавторами [51] эта вероятная причина повышения уровня АМГ не была подтверждена. Кроме того, при снижении уровня инсулина в крови при лечении больных СПЯ и восстановлении овуляции, последующего уменьшения содержания АМГ в крови не происходило [12, 16]. Двойное слепое исследование, проведенное Carlsen S. M. с соавторами [16], включало 50 больных СПЯ, которые соблюдали диету и получали метформин в дозе 850 мг три раза в сутки. Больные были рандомизированы в 2 группы: 25 человек принимали 0,25 мг дексаметазона ежедневно, 25 человек — плацебо. Исследование длилось 26 недель, завершило его 36 человек. Результаты оценивались спустя 8 и 26 недель лечения. Базальный уровень АМГ в крови, составивший в среднем 7,1 нг/мл, положительно коррелировал с уровнем тестостерона и отрицательно — с уровнем в крови ДГЭА-С. Шестимесячная терапия метформином и дексаметазоном не привела к снижению подавлению синтеза АМГ. Диетотерапия больных СПЯ, приводящая к увеличению количества овуляторных менструальных циклов, сопровождалась снижением уровня АМГ в сыворотке крови [45].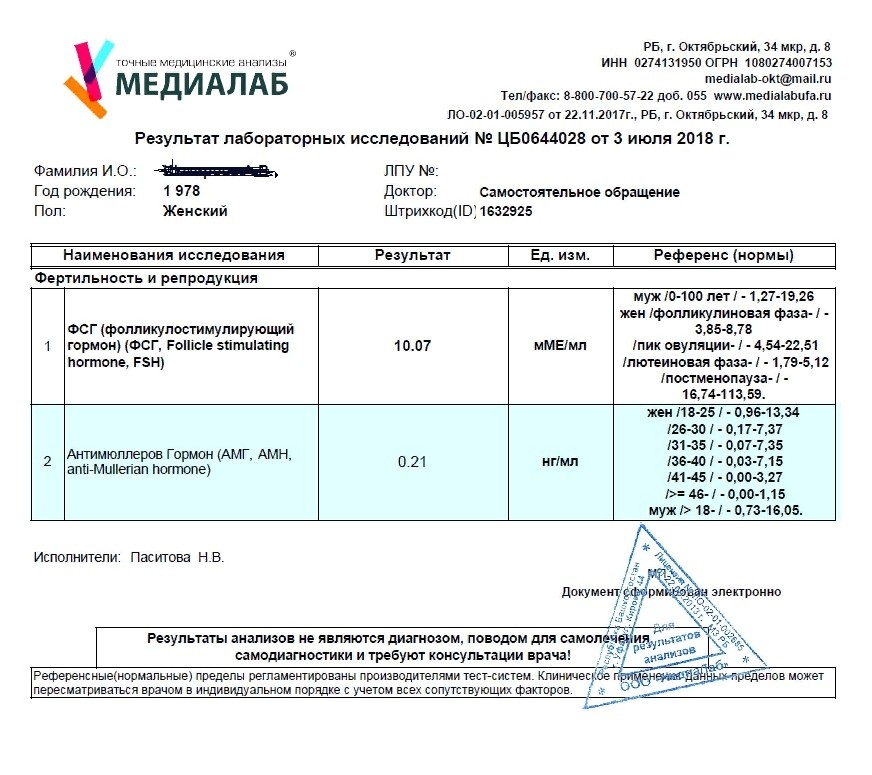 Thomson R. L. и соавторами [60] установили, что на фоне лечения метформином уже через месяц происходит уменьшение числа антральных фолликулов, но вместе с этим уровень АМГ в крови остаётся неизменным [12]. Через 4-8 месяцев применения метформина уровень АМГ в сыворотке крови больных СПЯ снижается [28]. Одним из самых надёжных методов достижения овуляции у больных СПЯ является стимуляция ФСГ. У женщин, получавших рекомбинантный человеческий ФСГ, содержание АМГ в сыворотке крови уменьшалось на фоне лечения [35], свидетельствуя о том, что снижение секреции АМГ является необходимым условием восстановления овуляции. Терапия ФСГ больных СПЯ приводит к значительному снижению продукции АМГ гранулёзными клетками, что не происходит в яичниках здоровых женщин [49]. Некоторые исследователи [27, 35] продемонстрировали отрицательную корреляцию между уровнями эстрадиола и АМГ в сыворотке крови больных СПЯ. Важное место в лечении СПЯ занимает хирургический метод. Он применяется, претерпевая эволюционные изменения, на протяжении практически целого века.
Thomson R. L. и соавторами [60] установили, что на фоне лечения метформином уже через месяц происходит уменьшение числа антральных фолликулов, но вместе с этим уровень АМГ в крови остаётся неизменным [12]. Через 4-8 месяцев применения метформина уровень АМГ в сыворотке крови больных СПЯ снижается [28]. Одним из самых надёжных методов достижения овуляции у больных СПЯ является стимуляция ФСГ. У женщин, получавших рекомбинантный человеческий ФСГ, содержание АМГ в сыворотке крови уменьшалось на фоне лечения [35], свидетельствуя о том, что снижение секреции АМГ является необходимым условием восстановления овуляции. Терапия ФСГ больных СПЯ приводит к значительному снижению продукции АМГ гранулёзными клетками, что не происходит в яичниках здоровых женщин [49]. Некоторые исследователи [27, 35] продемонстрировали отрицательную корреляцию между уровнями эстрадиола и АМГ в сыворотке крови больных СПЯ. Важное место в лечении СПЯ занимает хирургический метод. Он применяется, претерпевая эволюционные изменения, на протяжении практически целого века. В мировой науке первое описание клинической картины СПЯ, а также метода хирургического лечения посредством клиновидной резекции трети каждого яичника, связана с именами И. Штейна и М. Левенталя и датируются 1935 годом. Тем не менее отечественным врачом С. К. Лесным уже в 1928 году были представлены сведения об эффективности клиновидной резекции яичников у больных с олиго- и аменореей, ожирением, гипертрихозом и увеличенными в размерах яичниками [5]. Свыше 30 лет клиновидная резекция яичников с удалением до 75 % их ткани оставалась единственным методом лечения СПЯ. Развитие лапароскопической техники позволило не только снизить частоту послеоперационных осложнений, характерных для лапаротомии, но и ввести этот метод в ряд рутинных способов лечения СПЯ. Оперативное вмешательство влечёт за собой уменьшение размеров яичников и снижение в крови АМГ, приводя к восстановлению овуляции [4]. Таким образом, в настоящее время получено достаточное количество данных о структуре и биологических свойствах антимюллерова гормона.
В мировой науке первое описание клинической картины СПЯ, а также метода хирургического лечения посредством клиновидной резекции трети каждого яичника, связана с именами И. Штейна и М. Левенталя и датируются 1935 годом. Тем не менее отечественным врачом С. К. Лесным уже в 1928 году были представлены сведения об эффективности клиновидной резекции яичников у больных с олиго- и аменореей, ожирением, гипертрихозом и увеличенными в размерах яичниками [5]. Свыше 30 лет клиновидная резекция яичников с удалением до 75 % их ткани оставалась единственным методом лечения СПЯ. Развитие лапароскопической техники позволило не только снизить частоту послеоперационных осложнений, характерных для лапаротомии, но и ввести этот метод в ряд рутинных способов лечения СПЯ. Оперативное вмешательство влечёт за собой уменьшение размеров яичников и снижение в крови АМГ, приводя к восстановлению овуляции [4]. Таким образом, в настоящее время получено достаточное количество данных о структуре и биологических свойствах антимюллерова гормона. Повышенное содержание АМГ в крови больных СПЯ следует считать твердо установленным фактом. Остается неясным вопрос: является ли это повышение АМГ вторичным по отношению к гипоталамо-гипофизарным нарушениям или первично-овариальным повреждениям, приводящим к увеличению числа антральных фолликулов и ановуляции. Решить эту проблему помогут исследования, направленные на изучение связи АМГ и овариальной ароматазы.
Повышенное содержание АМГ в крови больных СПЯ следует считать твердо установленным фактом. Остается неясным вопрос: является ли это повышение АМГ вторичным по отношению к гипоталамо-гипофизарным нарушениям или первично-овариальным повреждениям, приводящим к увеличению числа антральных фолликулов и ановуляции. Решить эту проблему помогут исследования, направленные на изучение связи АМГ и овариальной ароматазы.
- Бебия З. Н., Орлов В. М. Антимюллеровый фактор. Журнал акушерства и женских болезней. 1999; 2: 66-70.
- Боярский К. Ю., Гайдуков С. Н. Роль антимюллерова гормона (АМГ) в норме и при различных гинекологических заболеваниях. Журнал акушерства и женских болезней. 2009; 3: 74-83.
- Дедов И. И., Г. А. Мельниченко, Т. В. Чеботникова и др. Распространенность и клиническая картина синдрома поликистозных яичников в популяции Москвы. Клиническая эндокринология.
 2010; 4: 7-8.
2010; 4: 7-8. - Дедов И. И., Мельниченко Г. А. ред. Синдром поликистозных яичников: Руководство для врачей. М.: МИА; 2007.
- Лесной С. К. Частичная резекция яичников при олигоменорее и аменорее. Акушерство и гинекология. 1928; 7: 16-19.
- Назаренко Т. А. Женское бесплодие, обусловленное нарушениями процесса овуляции (клиника, диагностика, лечение). Автореф. дис. … д-ра мед. наук. М. 1998.
- Al-Qahtami A., Groome N. Anti-Mullerian hormone: Cinderella finds new admirers. J. Clin. Endocrinol. Metab. 2006; 91: 3760-2.
- Arbo E., Vetori D. V., Jimenez M. F. et al. Serum anti-mullerian hormone levels and follicular cohort characteristics after pituitary suppression in the late luteal phase with oral contraceptive pills. Human Reproduction. 2007; 22: 3192-6.
- Asuncion M., Calvo R. M., San Millan J. L. et al. A prospective study of the prevalence of the polycystic ovary syndrome in unselected Caucasian women from Spain.
 J. Clin. Endocrinol. Metab. 2000; 85 (7): 2434-8.
J. Clin. Endocrinol. Metab. 2000; 85 (7): 2434-8. - Azziz R., Woods K. S., Reyna R. et al. The prevalence and features of the polycystic ovary syndrome in an unselected population. J. Clin. Endocrinol. Metab. 2004; 89: 2745-9.
- Badawy A., Elnashar A. Treatment options for polycystic ovary syndrome. Int. J. Womens Health. 2011; 3: 25-35.
- Bayrak A., Terbell H., Urwitz-Lane R. et al. Acute effects of metformin therapy include improvement of insulin resistance and ovarian morphology. Fertil. Steril. 2007; 87: 870-5.
- Behringer R. R., Finegold M. J., Cate R. L. Müllerian inhibiting substance function during mammalian sexual development. Cell. 1994; 79: 415-25.
- Broekmans F. J., Kwee J., Hendriks D. J. A systematic review of tests predicting ovarian reserve and IVF outcome. Hum. Reprod. 2006; 12: 685-718.
- Broer S., Mol B. W., Dolleman M.
 et al. The role of anti-Mullerian hormone assessment in assisted reproductive technology outcome. Curr. Opin. Obstet. Gynecol. 2010; 22: 193-201.
et al. The role of anti-Mullerian hormone assessment in assisted reproductive technology outcome. Curr. Opin. Obstet. Gynecol. 2010; 22: 193-201. - Carlsen S. M., Vanky E., Fleming R. Anti-Mullerian hormone concentrations in androgen-suppressed women with polycystic ovary syndrome. Hum. Reprod. 2009; 24: 1732-8.
- Cate R. L., Mattaliano R. J., Hession C. et al. Isolation of the bovine and human genes for Müllerian inhibiting substance and expression of the human gene in animal cells. Cell. 1986; 45: 685-98.
- Conway G. S., Jacobs H. S. Clinical implications of hyperinsulinaemia in women. Clinical Endocrinology. 1993; 39: 623-32.
- Das M., Gillott D. J., Saridogan E., Djahanbakhch O. Anti-Mullerian hormone is increased in follicular fluid from unstimulated ovaries in women with polycystic ovary sundrome. Hum. Reprod. 2008; 23: 2122-6.
- de Santa Barbara P., Moniot B.
 , Poulat F et al. Steroidogenic Factor-1 regulates transcription of the human anti-Mullerian hormone receptor. J. Biol. Chemistry. 1998; 273 (45): 29654-60.
, Poulat F et al. Steroidogenic Factor-1 regulates transcription of the human anti-Mullerian hormone receptor. J. Biol. Chemistry. 1998; 273 (45): 29654-60. - Deb S., Campbell B. K., Pincott-Allen C. et al. Quantifying effect of combined oral contraceptive pill on functional ovarian reserve as measured by serum anti-Müllerian hormone and small antral follicle count using three-dimensional ultrasound. Ultrasound Obstet. Gynecol. 2012; 39 (5): 574-80.
- Dólleman M., Verschuren W. M., Eijkemans M. J. et al. Reproductive and lifestyle determinants of anti-Müllerian hormone in a large population-based study. J. Clin. Endocrinol. Metabol. 2013; 98 (5): 2106-15.
- Dubeau L. The cell of origin of ovarian epithelial tumours. Lancet Oncol. 2008; 9: 1191-7.
- Durlinger A. L., Gruijters M. J., Kramer P. et al. Anti-Mullerian hormone inhibits initiation of primordial follicle growth in the mouse ovary.
 Endocrinology. 2002; 143: 1076-84.
Endocrinology. 2002; 143: 1076-84. - Durlinger A. L., Visser J. A., Themmen A. P. Regulation of ovarian function: the role of anti-Mullerian hormone. Reproduction. 2002; 124: 601-9.
- Eldar-Geva T., Margalioth E. J., Gai M. et al. Serum anti-Mullerian hormone levels during controlled ovarian hyperstimulation in women in polycystic ovaries with and without hyperandrogenism. Hum. Reprod. 2005; 20: 1814-9.
- Fallat M. E., Cook C., Siow Y., Carrillo A., Marra M. Mullerian-inhibiting substance in follicular fluid and serum: a comparison of patients with tubal factor infertility, polycystic ovary syndrome, and endometriosis. Fertil. Steril. 1997; 67: 962-5.
- Fleming R., Harborne L., MacLaughlin D.T. et al. Metformin reduces serum Mullerian-inhibiting substance levels in women with polycystic ovary syndrome after protracted treatment. Fertil. Steril. 2005; 83: 130-6.
- Goodarzi M.
 O., Quinones M. J., Azziz R. et al. Polycystic ovary syndrome in Mexican-Americans: prevalence and association with the severity of insulin resistance. Fertil. Steril. 2005; 84 (3): 766-9.
O., Quinones M. J., Azziz R. et al. Polycystic ovary syndrome in Mexican-Americans: prevalence and association with the severity of insulin resistance. Fertil. Steril. 2005; 84 (3): 766-9. - Grossman M., Nakajima S., Fallat M., Siow Y. Mullerian inhibiting substance inhibits cytochrome P450 aromatase activity in human granulosa lutein cell culture. Fertil. Steril. 2008; 89: 1364-70.
- Hehenkamp W. J., Looman C. W., Themmen A. P. et al. Anti-Müllerian hormone levels in the spontaneous menstrual cycle do not show substantial fluctuation. J. Clin.Endocrinol. Metabol. 2006; 91: 4057-63.
- Ji Hee Yoo, Hye Ok Kim, Sun Wha Cha et al. Age specific serum anti-Müllerian hormone levels in 1,298 Korean women with regular menstruation. Clin. Exp. Reprod. Med. 2011; 38 (2): 93-97.
- Kallio S., Puurunen J., Ruokonen A. et al. Antimullerian hormone levels decrease in women using combined contraception independently of administration route.
 Fertil. Steril. 2013; 99 (5): 1305-10.
Fertil. Steril. 2013; 99 (5): 1305-10. - La Marca A., Giulini S., Orvieto R. et al. Anti-Müllerian hormone concentrations in maternal serum during pregnancy. Hum. Reprod. 2005; 20: 1569-72.
- La Marca A., Orvieto R., Giulini S. et al. Müllerian-inhibiting substance in women with polycystic ovary syndrome: relationship with hormonal and metabolic characteristics. Fertil. Steril. 2004; 82: 970-2.
- La Marca A., Sighinolfi G., Radi D. et al. Anti-Mullerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART). Hum. Reprod. 2010; 16: 113-30.
- La Marca A., Stabile G., Artenisio A. C., Volpe A. Serum anti-Müllerian hormone throughout the human menstrual cycle. Hum. Reprod. 2006; 21: 3103-7.
- La Marca A., Volpe A. Anti-Mullerian hormone (AMH) in female reproduction: is measurement of circulating AMH a useful tool? Clin. Endocrinol. 2006; 64 (6): 603-10.

- Laven J. S.E., Mulders A. M., Visser J. et al. Anti-Mullerian hormone serum concentrations in normoovulatory and anovulatory women of reproductive age. J. Clin. Endocrinol. Metabol. 2004; 89: 318-23.
- Lee M. M., Donahoe P. K., Hasegawa T. et al. Mullerian inhibiting substance in humans: normal levels from infancy to adulthood. J. Clin. Endocrinol. 1996; 81: 571-6.
- Lobo R. A., Carmina E. The importance of diagnosing the polycystic ovary syndrome Ann. Intern. Med. 2000; 132 (12): 989-93.
- Masiakos P. T., MacLaughlin D.T., Maheswaran S. et al. Human ovarian cancer, cell lines and primary ascites all express the human Mullerian inhibiting substance (MIS) type II receptor, bind and are responsive to MIS. Clin. Cancer Res. 1999; 5: 3488-99.
- Massagué J. The transforming growth factor-b family. Ann. Rev. Cell Biol. 1990; 6: 597-641.
- Mohamed K.
 A., Davies W. A., Lashen H. Antimüllerian hormone and pituitary gland activity after prolonged down-regulation with goserelin acetate. Fertil. Steril. 2006; 86: 1515-7.
A., Davies W. A., Lashen H. Antimüllerian hormone and pituitary gland activity after prolonged down-regulation with goserelin acetate. Fertil. Steril. 2006; 86: 1515-7. - Moran L. J., Noakes M., Clifton P. M., Norman R. J. The use of anti-Mullerian hormone in predicting menstrual response after weight loss in overweight women with polycystic ovary syndrome. J. Clin. Endocrinol. Metabol. 2007; 92: 3796-802.
- Nakhuda G. S., Chu M. C., Wang J. et al. Elevated serum MIS levels may be a marker for ovarian hyperstimulation syndrome in normal women undergoing IVF. Fertil. Steril. 2006; 85: 1541-3.
- Nelson S. M., Yates R. W., Lyall H. et al. Anti-Mullerian hormone-based approach to controlled ovarian stimulation for assisted conception. Hum. Reprod. 2009; 24: 867-75.
- Nilsson E. E., Schindler R., Savenkova M. I., Skinner M. K. Inhibitory actions of anti-Mullerian hormone (AMH) on ovarian primordial follicle assembly.
 PLoS One. 2011; 6 (5): 20087.
PLoS One. 2011; 6 (5): 20087. - Pellatt L., Hanna L., Brincat M. et al. Granulosa cell production of anti-Mullerian hormone is increased in polycystic ovaries. J. Clin. Endocrinol. Metab. 2007; 92: 240-5.
- Pellatt L., Rice S., Mason H. D. Anti-Mullerian hormone and polycystic ovary syndrome: a mountain too high? Reproduction. 2010; 139 (5): 825-33.
- Pigny P., Merlen E., Robert Y. et al. Elevated serum level of anti-Mullerian hormone in patients with polycystic ovary syndrome: relationship to the ovarian follicle excess and to the follicle arrest. J. Clin. Endocrinol. Metabol. 2003; 88: 5957-62.
- Piouka A., Farmakiotis D., Katsikis I. et al. Anti-Mullerian hormone levels reflect severity of PCOS but are negatively influenced by obesity: relationship with increased luteinizing hormone levels. Am. J. Physiol. Endocrinol. Metabol. 2009; 296: 238-43.
- Rajperts-de Meyts E.
 , Jorgensen N., Graem N. et al. Expression of anti-Müllerian hormone during normal and pathological gonadal development: association with differentiation of Sertoli and granulosa cells. J. Clin. Endocrinol. Metabol. 1999; 84: 3836-44.
, Jorgensen N., Graem N. et al. Expression of anti-Müllerian hormone during normal and pathological gonadal development: association with differentiation of Sertoli and granulosa cells. J. Clin. Endocrinol. Metabol. 1999; 84: 3836-44. - Rey R., Belville C., Nihoul-Fekete C. et al. Evaluation of gonadal function in 107 intersex patients by means of serum anti-Mullerian hormone measurement. J. Clin. Endocrinol. Metab. 1999; 84: 627-31.
- Rey R., Sabourin J. C., Venara M. et al. Anti-Mullerian hormone is specific marker of sertoli- and granulose-cell origin in gonadal tumors. Hum. Pathol. 2000; 31: 1202-3.
- Rotterdam E. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil. Steril. 2004; 81 (1): 19-25.
- Seifer D. B., Baker V. L., Leader B. Age-specific serum anti-Mullerian hormone values for 17,120 women presenting to fertility centers within the United States.
 Fertil. Steril. 2011; 95: 747-50.
Fertil. Steril. 2011; 95: 747-50. - Stephen A. E., Pearsoll L. A., Christian B. P. et al. Highly purified Mullerian inhibiting substance inhibits human ovarian cancer in vivo. Clin. Cancer Res. 2002; 8: 2640-6.
- Streuli I., Fraisse T., Chapron C. et al. Clinical uses of anti-Mullerian hormone assays: pitfalls and promises. Fertil. Steril. 2009; 91: 226-30.
- Thomson R. L., Buckley J. D., Moran L. J. et al. The effect of weight loss on anti-Mullerian hormone levels in overweight and obese women with polycystic ovary syndrome and reproductive impairment. Hum. Reprod. 2009; 24: 1976-81.
- Van Rooij I. A., Broekmans F. J., te Velde E. R. et al. Serum anti-Mullerian hormone levels: a novel measure of ovarian reserve. Hum. Reprod. 2002; 17: 3065-71.
- Visser J. A., Themmen A. P. Anti-Mullerian hormone and folliculogenesis. Mol. Cell Endocrinol. 2005; 234: 81-6.
- Wachs D.
 S., Coffler M. S., Malcom P. J., Chang R. J. Serum anti-Mullerian hormone concentrations are not altered by acute administration of follicle stimulating hormone in polycystic ovary syndrome and normal women. J. Clin. Endocrinol. Metabol. 2007; 92: 1871-14.
S., Coffler M. S., Malcom P. J., Chang R. J. Serum anti-Mullerian hormone concentrations are not altered by acute administration of follicle stimulating hormone in polycystic ovary syndrome and normal women. J. Clin. Endocrinol. Metabol. 2007; 92: 1871-14. - Willis D., Mason H., Gilling-Smith C., Franks S. Modulation by insulin of follicle-stimulating hormone and luteinizing hormone actions in human granulosa cells of normal and polycystic ovaries. J. Clin.Endocrinol. Metabol. 1996; 81: 302-9.
Views
Abstract — 745
PDF (Russian) — 283
Cited-By
Article Metrics
PlumX
Dimensions
НОВИНКА!!! Антимюллеров гормон (или ингибирующее вещество Мюллера) – один из основных показателей репродуктивной функции у мужчин и женщин!
Антимюллеров гормон (АМГ), другие названия — антимюллеровская субстанция, антимюллеровый фактор или ингибирующее вещество Мюллера — один из последних и наиболее важных маркеров репродуктивной системы женщины и мужчины.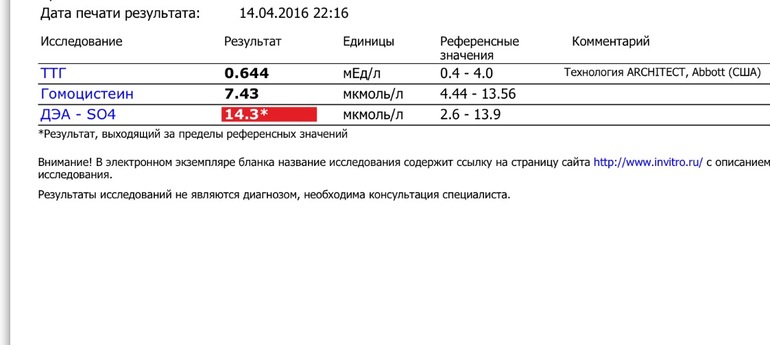
Какова роль данной субстанции в организме женщины?
Немецким анатомом Йохан Мюллером описан эмбриональный проток, предшественник матки, маточных труб и верхней трети влагалища – Мюллеров проток. Первые признаки продукции АМГ в яичниках девочки появляются в пренатальный период (32 – 36 недель беременности), и уровень его в крови медленно повышается с возрастом. Максимальный уровень АМГ достигается к расцвету репродуктивной функции женщины в 20 – 30 лет, в дальнейшем постепенно снижается, и к менопаузе равняется нулю. АМГ является важнейшим показателем старения женской репродуктивной системы. Одиночное измерение АМГ на любой день менструального цикла (по данным большинства исследований, наиболее показательно на 3-й день менструального цикла) дает полную клиническую информацию о состоянии овариального резерва (АМГ не находится под контролем гонадотропных гормонов (ФСГ, ЛГ) и адекватно отражает количество фолликулов). Под овариальным резервом понимают функциональный резерв яичника, который определяет способность последнего к развитию здорового фолликула с полноценной яйцеклеткой и адекватному ответу на овариальную стимуляцию. АМГ является одним из наиболее значимых регуляторов репродуктивной функции женщины, который отражает рост фолликулов от примордиального пула до стадии больших антральных, позволяет провести диагностику овариального резерва, синдрома поликистозных яичников, преждевременного истощения яичников (первичной яичниковой недостаточности), гипоталамической аменореи, нервной анорексии, гранулезо — клеточных опухолей яичников.
АМГ является одним из наиболее значимых регуляторов репродуктивной функции женщины, который отражает рост фолликулов от примордиального пула до стадии больших антральных, позволяет провести диагностику овариального резерва, синдрома поликистозных яичников, преждевременного истощения яичников (первичной яичниковой недостаточности), гипоталамической аменореи, нервной анорексии, гранулезо — клеточных опухолей яичников.
АМГ – маркер: Овариального резерва. Овариального старения. Овариальной дисфункции. Овариального ответа
В протоколах IVF(ЭКО) у женщин старшего репродуктивного возраста успех наступления беременности тем выше, чем выше уровень AMГ. При синдроме поликистозных яичников (СПКЯ) уровень AMГ выше, чем у нормально овулирующих женщин.
В онкологической практике определение АМГ имеет значение при диагностике гранулёзоклеточных опухолей яичников, поскольку при этом происходит значительное повышение его концентрации.
Какова роль данной субстанции в организме мужчины?
В процессе эмбрионального развития он секретируется клетками Cертоли и отвечает за регрессию Мюллеровых протоков у мужчин. До наступления половой зрелости АМН продуцируется яичками, а затем его уровень постепенно снижается до остаточных постпубертатных значений. Нарушение функции антимюллерова гормона вызывает у мужчин сохранение дериватов мюллеровых протоков. Это состояние клинически проявляется крипторхизмом, паховыми грыжами и нарушением репродуктивной функции и названо синдромом персистенции мюллеровых протоков (СПМП). Несмотря на то, что у пациентов с СПМП не нарушена дифференцировка яичек, у них часто отмечают бесплодие. Бесплодие у пациентов с СПМП может быть вследствие поздно устраненного оперативными методами крипторхизма, приводящего к атрофии семенных канальцев и вторичной андрогенной недостаточности. Поэтому, АМГ используется для оценки мужской половой функции в любом возрасте
До наступления половой зрелости АМН продуцируется яичками, а затем его уровень постепенно снижается до остаточных постпубертатных значений. Нарушение функции антимюллерова гормона вызывает у мужчин сохранение дериватов мюллеровых протоков. Это состояние клинически проявляется крипторхизмом, паховыми грыжами и нарушением репродуктивной функции и названо синдромом персистенции мюллеровых протоков (СПМП). Несмотря на то, что у пациентов с СПМП не нарушена дифференцировка яичек, у них часто отмечают бесплодие. Бесплодие у пациентов с СПМП может быть вследствие поздно устраненного оперативными методами крипторхизма, приводящего к атрофии семенных канальцев и вторичной андрогенной недостаточности. Поэтому, АМГ используется для оценки мужской половой функции в любом возрасте
В каких случаях рекомендуется определять уровень Антимюллеров гормона или ингибирующего вещества Мюллера?
• Бесплодие неясного генеза.
• Проблемы оплодотворения.
• Оценка мужской половой функции в любом возрасте.
• Исследование овариального резерва и пременопаузальных изменений у женщин.
• Выявление преждевременного или замедленного полового созревания.
• Постановка диагноза крипторхизма и анорхизма.
• Диагностика и контроль гранулёзоклеточного рака яичника.
• Неудачные попытки ЭКО, недостаточный ответ на стимуляцию.
• Установление пола в сомнительных случаях.
• Пограничные или повышенные значения ФСГ.
• При аутотрансплантации ткани яичника.
• При химиотерапии как маркер овариальной функции.
• Подтверждение наличия тестикулярной ткани.
• При оценке эффективности антиандрогенной терапии.
Используя самые современные методы лабораторной и инструментальной диагностики, коллектив «Медицинского Центра Здоровья» готов прийти на помощь каждому, кто оказался в сложной ситуации.
С заботой о Вашем здоровье,
врач-терапевт, кардиолог Бичева Анна Юрьевна.
Состояние овариального резерва у женщин с сахарным диабетом 1 типа в репродуктивном периоде | Григорян
Несмотря на значительное улучшение прогноза для жизни и здоровья больных сахарным диабетом 1 типа (СД1) за последние десятилетия, такие пациенты по-прежнему входят в группу риска по раннему формированию микро- и макрососудистых осложнений, приводящих к поражению периферических артерий, развитию сердечно-сосудистых и цереброваскулярных заболеваний, прогрессированию хронической болезни почек [1]. Очевидно, что во многом повышение риска связано с метаболическими нарушениями, характерными для СД1 (гипергликемия, гиперлипидемия и др.), однако степень его увеличения не может объясняться лишь этими факторами. Более того, известные гендерные различия в частоте сердечно-сосудистых заболеваний (значимо большая частота у мужчин) у больных СД1 выражены значительно меньше по сравнению с субъектами из общей популяции. Раннее развитие сердечно-сосудистых заболеваний – не единственное проявление ускоренного старения у больных СД1. К другим проявлениям относятся истончение базальной мембраны мышечных капилляров, повышение жесткости базальной мембраны, что у людей без СД1 отмечается лишь после 50 лет, а у больных СД1 – в существенно более молодом возрасте, особенно при длительном течении заболевания. Кроме того, у больных СД1 чаще развивается катаракта, уменьшена скорость возобновления клеточной популяции по сравнению со здоровыми людьми [2].
Очевидно, что недооцениваются другие проявления несоответствия биологического возраста больных СД1 их календарному возрасту. Так, известно, что у больных СД1 позже наступает менархе, по сравнению со здоровыми женщинами чаще отмечается нерегулярность менструального цикла: в репродуктивном периоде у 30% больных СД1 женщин отмечаются аменорея, полименорея или олигоменорея, раньше наступает менопауза [3]. У больных СД1 чаще развивается синдром поликистозных яичников (СПКЯ), характерна сниженная фертильность [3, 4, 5]. Поздние осложнения СД и высокий уровень HbA1с могут вносить вклад в снижение овариального резерва у пациенток с СД1, однако, по всей видимости, основа патогенеза у таких больных – это каскад аутоиммунных процессов.
Овариальный резерв – это количество антральных фолликулов в обоих яичниках. Для определения овариального резерва принято определять сывороточный уровень фолликулостимулирующего гормона (ФСГ) и антимюллерова гормона (АМГ) на 2–3-й день менструального цикла. Снижение овариального резерва связано с уменьшением количества и потерей качества яйцеклеток и ассоциировано с плохим прогнозом исходов оплодотворения in vitro. Исследование АМГ особенно важно у молодых женщин, т.к. снижение овариального резерва часто пропускается врачами, в результате диагноз бесплодия становится неполным, а значит, не используются все возможные вмешательства для его лечения [6].
В исследовании Soto и соавт. (2009) показано, что у больных СД1 происходит преждевременное старение яичников, что проявляется в снижении уровней АМГ и ингибина В, свидетельствующем о более раннем уменьшении количества фолликулов в яичниках по сравнению со здоровыми женщинами [7]. Целью настоящего исследования явилась сравнительная оценка овариального резерва у молодых женщин, больных СД1, и у здоровых женщин репродуктивного возраста.
Цель
Сравнить овариальный резерв у женщин с СД1 репродуктивного возраста и у женщин без СД1 репродуктивного возраста.
Методы
Дизайн исследования
Проспективное обсервационное одноцентровое исследование в параллельных группах.
Критерии соответствия
Для минимизации влияния дополнительных факторов, изменяющих овариальный резерв, в исследование были включены женщины европеоидной расы репродуктивного возраста (от 18 до 37 лет включительно). В основную группу включались больные с верифицированным не менее 2 лет диагнозом СД1, в группу сравнения – женщины без СД. Критериями исключения являлись: операции на органах малого таза, химиотерапия или лучевая терапия в анамнезе, опухолевидные образования яичников, СПКЯ, эндометриоз, диагностированное бесплодие, нарушения менструального цикла, беременность, менопауза, прием гормональных препаратов (кроме инсулина в основной группе) на момент включения в исследование и в течение 3 мес до включения, эндокринные заболевания (кроме СД1 в основной группе), курение сигарет на момент включения или в анамнезе, злоупотребление алкоголем, наркомания и токсикомания. Все участницы ознакомились с информацией об исследовании, получили ответы на интересующие вопросы и подписали форму информированного согласия на участие в исследовании.
Условия проведения
Исследование проведено на базе одного центра – ФГБУ «НИМЦ эндокринологии» Минздрава России, Москва.
Продолжительность исследования
Продолжительность набора участниц исследования в соответствии с планом составила 10 мес, каждую участницу в рамках исследования обследовали дважды – на 2–3-й и на 21–23-й дни менструального цикла. Исследование проводилось в течение 2017 г.
Описание медицинского вмешательства
Всех участниц обследовали по единому протоколу: забор венозной крови натощак на 2–3-й и 21–23-й дни менструального цикла для определения сывороточных уровней АМГ, ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона (на 2–3-й дни цикла) и прогестерона (на 21–23-й дни цикла) методом усиленной люминесценции, на 2-й день также определяли уровень гликированного гемоглобина (HbA1с). В индивидуальную регистрационную карту заносились данные о возрасте менархе и манифестации СД1 (для больных основной группы). На 2–3-й дни менструального цикла для оценки объема яичников и числа антральных фолликулов проводилось трансвагинальное ультразвуковое исследование (УЗИ) на ультразвуковом аппарате Hewlett Packard Image Point (США) с использованием вагинального датчика с частотой 3,5 МГц по общепринятой методике.
Основной исход исследования
Основными оцениваемыми параметрами в рамках исследования явились уровень АМГ и когорта антральных фолликулов на 2–3-й день менструального цикла.
Дополнительные исходы исследования
Дополнительные оцениваемые параметры: уровни ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона и объем яичников на 2–3-й дни менструального цикла, уровень прогестерона на 21–23-й дни менструального цикла, уровень HbA1с при включении в исследование.
Анализ в подгруппах
Больные был разделены на две группы:
- группа А (основная) – больные СД1;
- группа B (контрольная) – здоровые женщины без СД1.
Методы регистрации исходов
Уровни АМГ, ингибина В, ФСГ, ЛГ, эстрадиола, тестостерона прогестерона, определялись методом усиленной люминесценции. Уровень HbA1с определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Для оценки объема яичников и числа антральных фолликулов проводилось трансвагинальное УЗИ на ультразвуковом аппарате Hewlett Packard Image Point (США) с использованием вагинального датчика с частотой 3,5 МГц по общепринятой методике. Референтные значения определялись на основании данных локальной лаборатории, а также с учетом рекомендаций Американской коллегии акушеров-гинекологов по определению овариального резерва 2015 г. [8] и Роттердамских критериев СПКЯ (для определения нормального объема яичника) [9].
Статистический анализ
Принципы расчета размера выборки: размер выборки предварительно не рассчитывался.
Методы статистического анализа данных: статистический анализ осуществлялся с помощью пакета программ Statistica 6.0 (StatSoftInc, США). Нормальность распределения признаков оценивалась с помощью критерия Шапиро-Уилка. При описании нормально распределенных переменных указывалось среднее и стандартное отклонение (M±s). Сравнение количественных показателей в разных группах осуществлялось при помощи критерия Манна–Уитни (для двух групп). Качественные показатели представлялись в виде абсолютного числа наблюдений. Различия считались статистически значимыми при p<0,05. По коэффициенту Спирмена оценивали силу связи между переменными (r). При значениях коэффициента r<0,3 связь считалась слабой и незначительной; при значениях r=0,3–0,7 – средней или умеренной; при значениях r>0,7 – значительной и сильной.
Этическая экспертиза
Протокол исследования одобрен на заседании этического комитета ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России от 19 октября 2016 г. (протокол № 12).
Результаты
Основные результаты исследования
В основную группу вошли 224 женщины, в группу сравнения – 230 женщин.
Результаты обследования участниц исследования представлены в табл. 1.
Таблица 1. Результаты обследований больных СД1 женщин (группа A) и здоровых женщин (группа B)
Характеристика | Группа A (n=224) | Группа B (n=230) | Референсные значения |
Возраст, лет | 26,7±5,3 | 25,8±4,2 | Не применимо |
Возраст менархе, лет | 13,4±0,8* | 11,8±0,45 | Не применимо |
Роды однократно, % | 53 | 56 | Не применимо |
Роды повторно, % | 21 | 23 | Не применимо |
ИМТ, кг/м2 | 22,7±3,3 | 23,6±3,9 | 18–24,9 |
Окружность талии, см | 72,3±3,8 | 76±5,3 | ≤ 80 |
АМГ, нг/мл | 2,9±1,3* | 4,7±1,5 | 1–12,6 |
Ингибин В, пг/мл | 92,1±18,6 | 100±22,3 | <273 |
ФСГ, мМЕд/мл | 5,4±2,6 | 5,8±2,3 | 1,37–9,9 |
ЛГ, мМЕд/мл | 8,7±3,4 | 9,2±3,8 | 1,68–15 |
Эстрадиол, пмоль/л | 176±35 | 204±42 | 68–1269 |
Тестостерон, нмоль/л | 0,65±0,15 | 0,68±0,13 | 0,52–1,72 |
Прогестерон, нмоль/л | 1,4±0,5 | 1,6±0,6 | 0,3–2,2 |
HbA1c, % | 8,2±2,5* | 4,9±0,52* | <6 |
Объем яичников (см3) | 8,4±2,2 | 8,2±1,4 | ≤10 |
Число антральных фолликулов, n | 16,4±7,2* | 20,4±5,2* | Минимум 3–10 |
Примечания: *p<0,05 при сравнении параметра у больных СД1 и у здоровых женщин.
Благодаря жестким критериям включения/исключения участницы из обеих групп сопоставимы по возрасту и главным факторам, влияющим на овариальный резерв. Не выявлено различий по таким параметрам, как возраст, индекс массы тела, окружность талии, уровни ФСГ, ЛГ, эстрадиола, тестостерона, прогестерона, ингибина В, объем яичников.
В табл. 2 представлены параметры, статистически значимо различающиеся у больных СД1 и у здоровых женщин.
Таблица 2. Значимые различия параметров у больных СД1 (группа А) и у здоровых женщин репродуктивного возраста (группа В)
Характеристика | Группа A (n=224) | Группа B (n=230) |
Возраст менархе, лет | 13,4±0,8 | 11,8±0,45 |
Число антральных фолликулов, n | 16,4±7,2 | 20,4±5,2 |
HbA1c, % | 8,2±2,5 | 4,9±0,52 |
АМГ, нг/мл | 2,9±1,3 | 4,7±1,5 |
Обращают внимание значимые различия таких параметров овариального резерва у больных СД1 и у здоровых женщин, как уровень АМГ (2,9±1,3 нг/мл у больных СД1 против 4,7±1,5 нг/мл в группе здоровых женщин, p<0,05) и когорты антральных фолликулов (16,4±7,2 у больных СД1 и 20,4±5,2 у здоровых женщин). Закономерно значимое различие в уровне HbA1с: 8,2±2,5% у больных СД1 и 4,9±0,52% у здоровых женщин. Менархе у больных СД1 наступало значимо позже при сравнении с женщинами без СД (13,4±0,8 лет по сравнению с 11,8±0,45 лет, p<0,05).
При анализе корреляционных связей между уровнем HbA1с и параметрами овариального резерва отмечается сильная отрицательная связь с уровнем АМГ (r=-0,92, p<0,05) и с количеством антральных фолликулов (r=-0,76, p<0,05). При этом уровни таких маркеров овариального резерва, как размер яичников, уровни ФСГ, ЛГ, ингибина В, эстрадиола и прогестерона значимо не отличались.
При анализе зависимости овариального резерва от сроков манифестации СД1 получены интересные результаты: при манифестации СД1 до пубертата овариальный резерв, оцененный по уровню АМГ, оказался ниже, чем у больных с манифестацией СД1 после пубертата (рис. 1).
Рис. 1. Зависимость уровня АМГ (нг/мл) от сроков манифестации СД1.
При анализе по подгруппам больных СД1 в зависимости от степени компенсации заболевания (уровня HbA1с) связи между уровнем контроля диабета и овариальным резервом в одномоментном исследовании выявить не удалось (рис. 2).
Рис. 2. Зависимость уровня АМГ (нг/мл) от уровня HbA1с (%) у больных СД1. Статистически значимых различий между подгруппами больных не выявлено.
Нежелательные явления
В ходе проведения исследования нежелательных явлений не зарегистрировано.
Обсуждение
Состояние репродуктивного здоровья у больных СД1 в последние годы является предметом для серьезного изучения.
В 2016 г. опубликована работа Yarde и соавт. [10], целью которой явилось установление зависимости между факторами сердечно-сосудистого риска у больных СД1 со снижением овариального резерва как параметра, характеризующего возрастные изменения в яичниках. В это поперечное исследование случай-контроль вошел анализ данных 150 больных СД1 (средний возраст 33,8±8,4 лет) и 177 здоровых женщин с сохранной репродуктивной функцией. Оценивали такие параметры, как когорта антральных фолликулов, липидограмма, плазменные уровни АМГ, С-реактивного белка, HbA1с, а также систолическое артериальное давление, вызванная кровотоком дилатация артерий, скорость пульсовой волны и толщина комплекса интима-медиа. Авторы пришли к выводу, что значимых различий в параметрах овариального резерва у больных СД1 и у здоровых женщин нет, а негативная корреляция обнаружена только между значениями систолического артериального давления и уровнем АМГ и количеством антральных фолликулов. При сравнении с нашим исследованием обращает внимание отличие методологии: ретроспективный характер с историческим контролем. Кроме того, в нашем исследовании в соответствии с критериями включения участвовали значимо более молодые женщины. Проспективный характер нашего исследования позволил проконтролировать все известные факторы, влияющие на овариальный резерв, что обеспечивает высокую сопоставимость групп по всем параметрам. Кроме того, объем выборки в нашем исследовании значимо больше, что увеличивает статистическую мощность исследования и достоверность выводов. Таким образом можно объяснить различия в полученных результатах. Тем не менее результаты исследования Yarde и соавт. представляют большую ценность для понимания патогенеза снижения овариального резерва у больных СД1. В нашем исследовании мы не ставили задачу сопоставить параметры овариального резерва с выраженностью факторов риска сердечно-сосудистого риска, обнаружена лишь корреляция с уровнем HbA1с. Отсутствие корреляции параметров овариального резерва с параметрами липидограммы и с характеристиками сосудистой стенки в исследовании Yarde и соавт. свидетельствует об отсутствии как минимум прямой причинно-следственной связи снижения овариального резерва при СД1 с макрососудистыми поражениями.
Soto и соавт. изучили функцию яичников у больных СД1 (n=66) в сравнении со здоровыми женщинами (n=58) в возрасте моложе 45 лет. Среди больных СД1 чаще встречались случаи снижения уровня АМГ до характерных для менопаузы уровней, при этом у больных СД1 старше 33 лет уровень АМГ был значимо ниже по сравнению со здоровыми женщинами. Авторы пришли к заключению, что снижение уровня АМГ у больных СД1 на четвертом десятке жизни свидетельствует об ускоренном уменьшении когорты примордиальных фолликулов. Эти данные согласуются с результатами, полученными в нашем исследовании: даже у молодых женщин репродуктивного возраста наличие СД1 приводит к снижению овариального резерва (более низкие значения АМГ и когорты антральных фолликулов) [7].
Kim и соавт. в исследовании с участием женщин в возрасте от 30 до 45 лет с сохранной репродуктивной функцией показали, что у больных СД1 log концентрации АМГ значимо ниже при сравнении с женщинами без СД (β-коэффициент -1,27, 95% доверительный интервал [-2,18, -0,36]) [11].
Совсем недавно до выхода печатной версии статьи онлайн опубликованы результаты исследования Al Khafajia и соавт. [12], в рамках которого анализировались параметры овариального резерва у 60 молодых больных СД1 и 80 здоровых молодых женщин (средний возраст 24,87±8,47 лет и 25,91±8,29 лет соответственно). Авторы показали значимо меньшие уровни АМГ (2,82±1,27 нг/мл и 3,79±1,91 нг/мл) и более высокие уровни HbA1с (8,73±2,8% и 4,82±0,39%) в группе больных СД1 по сравнению со здоровыми женщинами соответственно (p<0,00 для обоих сравнений). При этом отмечалась сильная отрицательная корреляция между уровнем АМГ и содержанием HbA1с (r=-0,931, p=0,2). Таким образом, данные Al Khafajia полностью согласуются с результатами нашего исследования.
По данным Codner и соавт., изменения в яичниках, связанные с СД1, начинаются еще до наступления пубертата [13]. Они провели оценку гормонального статуса и УЗИ органов малого таза у девочек с СД1 (n=73) и здоровых девочек (n=86). В препубертатном возрасте у больных СД1 девочек уровень АМГ был значимо выше по сравнению со здоровыми сверстницами (4,07 нг/мл и 4,19 нг/мл соответственно). Однако в пубертатном периоде у больных СД1 отмечалось значимое снижение АМГ, чего не наблюдалось у здоровых девочек (1,41 нг/мл по сравнению с 2,20 нг/мл соответственно). Таким образом, к периоду полового созревания в яичниках больных СД1 больше фолликулов по сравнению со здоровыми сверстницами, что авторы связывают с воздействием экзогенного инсулина в качестве ростового фактора. Такое повышение количества фолликулов повышает риск развития синдрома поликистозных яичников у больных СД1. В то же время фолликулогенез в яичниках изменяется после достижения полового созревания с ростом уровня гонадотропинов – отмечается прогрессивное снижение уровня АМГ по сравнению со здоровыми девушками.
Таким образом, результаты нашего исследования, в котором показано снижение овариального резерва у больных СД1 по сравнению со здоровыми женщинами репродуктивного возраста, согласуются с результатами большинства других исследований, в которых оценивался овариальный резерв у больных СД1. Механизмы снижения овариального резерва при СД1 не ясны. Девочка рождается с пулом фолликулов в яичниках, единицы из которых при достижении половой зрелости входят в процесс созревания, остальные представляют «покоящиеся» фолликулы. Клетки гранулезы находятся в тесном взаимодействии с окружающими клетками, что необходимо для выживания и адекватного созревания яйцеклетки. В экспериментах на животных с индуцированным диабетом показано, что в условиях гипергликемии эти клетки повреждаются: изменяются пути метаболизма, нарушается созревание фолликулов и усиливается апоптоз [14–17]. Кроме того, в процессах физиологического старения задействовано гликозилирование белков, значимо увеличивающееся при диабете. Так, Diamanti-Kandarakis и соавт. показали значимое повышение уровня конечных продуктов гликирования даже в яичниках здоровых молодых женщин [18]. Логично предположить, что содержание таких токсичных веществ в яичниках больных СД1 увеличено в большей степени, что негативно сказывается на овариальном резерве. Наконец, в ряде исследований показана ассоциация аутоиммунных заболеваний, в том числе СД1, с развитием синдрома преждевременной недостаточности яичников, с чем связано предположение об участии аутоиммунных механизмов в более раннем снижении овариального резерва у больных СД1 [19, 20].
В отечественной литературе удалось найти единичные публикации, посвященные оценке овариального резерва у больных СД. Так, исследование Толопыгиной М.Г. и соавт. посвящено оценке функции яичников у больных СД1. Анализ результатов обследования 180 больных СД1 женщин репродуктивного возраста показал, что овариальная недостаточность имелась у 62,2% обследованных женщин. Выявлена связь овариальной недостаточности (критерии оценки: уровни ФСГ, ЛГ, пролактина, эстрадиола, общего и свободного тестостерона, прогестерона в периферической крови, параметры УЗИ органов малого таза) с уровнем гликемии, HbA1с, дозой вводимого инсулина. Отсутствовала связь недостаточности функции яичников с выраженностью микрососудистых диабетических осложнений и режимом инсулинотерапии. У больных СД1 отмечалось увеличение объема яичников, числа антральных фолликулов по сравнению с этими показателями у здоровых женщин. У этих больных наблюдалось повышение уровня ЛГ, эстрадиола и свободного тестостерона в крови. Увеличение объема яичников коррелировало с наличием и выраженностью диабетических микрососудистых осложнений и дозой вводимого инсулина. Аутоиммунное поражение яичников (оценивалось по наличию антител к ткани яичников) у женщин с СД1 выявлено лишь у 3,6% [21]. В нашем исследовании 2015 г. мы показали, что среди женщин с СД2 в возрастных группах от 20 до 49 лет значимо, по сравнению с группой контроля, повышен уровень ФСГ и снижено общее количество фолликулов [22].
Ограничения исследования
В нашем исследовании не проводился формальный расчет объема выборки, что допустимо в рамках неинтервенционного исследования. Жесткие критерии отбора участниц исследования уменьшают вероятность влияния на результат дополнительных вмешивающихся факторов, однако в реальной клинической практике дисменорея, прием гормональных контрацептивов, гинекологические операции в анамнезе, ожирение могут существенно изменять овариальный резерв. Таким образом, экстраполяция результатов на общую популяцию больных СД1 репродуктивного возраста некорректна.
Заключение
В нашем исследовании доказано снижение параметров овариального резерва у молодых больных СД1 по сравнению со здоровыми женщинами того же возраста (18–37 лет). В совокупности с ранее известными данными о связанных с СД1 нарушениях менструальной функции и проблемах при планировании беременности полученные результаты требуют информирования врачей и пациенток о потенциальном влиянии диабета на репродуктивную функцию. Несмотря на сохранение параметров овариального резерва в референтных пределах, с учетом их снижения при СД1 по сравнению со здоровыми женщинами целесообразно рекомендовать пациенткам планировать беременность в более молодом возрасте.
Дополнительная информация
Источник финансирования. Работа выполнена в рамках Гранта Российского научного фонда «Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркёры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация» (Грант РНФ № 17-75-30035).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Григорян О.Р., Красновская Н.С. – сбор материала, написание текста рукописи; Андреева Е.Н., Дедов И.И. – идея, редактирование текста рукописи; Михеев Р.К. – статистический анализ данных, написание текста рукописи. Все авторы внесли существенный вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
1. de Ferranti SD, de Boer IH, Fonseca V, et al. Type 1 diabetes mellitus and cardiovascular disease: a scientific statement from the American Heart Association and American Diabetes Association. Diabetes Care. 2014;37(10):2843-2863. doi: 10.2337/dc14-1720
2. Dorman JS, Steenkiste AR, Foley TP. Menopause in type 1 diabetic women: is it premature? Diabetes. 2001;50(8):1857-1862
3. Codner E, Escobar-Morreale HF. Clinical review: Hyperandrogenism and polycystic ovary syndrome in women with type 1 diabetes mellitus. J Clin Endocrinol Metab. 2007;92(4):1209-1216. doi: 10.1210/jc.2006-2641
4. Sjöberg L, Pitkäniemi J, Haapala L, et al. Fertility in people with childhood-onset type 1 diabetes. Diabetologia. 2013;56(1):78-81. doi: 10.1007/s00125-012-2731-x
5. Jonasson JM, Brismar K, Sparén P, et al. Fertility in women with type 1 diabetes: a population-based cohort study in Sweden. Diabetes Care. 2007;30(9):2271-2276. doi: 10.2337/dc06-2574
6. Rasool S, Shah D. Fertility with early reduction of ovarian reserve: the last straw that breaks the Camel’s back. Fertil Res Pract. 2017;11(3):15. doi: 10.1186/s40738-017-0041-1
7. Soto N, Iñiguez G, López P, et al. Anti-Mullerian hormone and inhibin B levels as markers of premature ovarian aging and transition to menopause in type 1 diabetes mellitus. Hum Reprod. 2009;24(11):2838-2844. doi: 10.1093/humrep/dep276
8. Committee on Gynecologic Practice. Committee opinion no. 618: Ovarian reserve testing. Obstet Gynecol. 2015;125(1):268-273. doi: 10.1097/01.AOG.0000459864.68372.ec
9. Franks S. Controversy in clinical endocrinology: diagnosis of polycystic ovarian syndrome: in defense of the Rotterdam criteria. J Clin Endocrinol Metab. 2006;91(3):786-789. doi: 10.1210/jc.2005-2501
10. Yarde F, Spiering W, Franx A, et al. Association between vascular health and ovarian ageing in type 1 diabetes mellitus. Hum Reprod. 2016;31(6):1354-1362. doi: 10.1093/humrep/dew063
11. Kim C, Karvonen-Gutierrez C, Kong S, et al. Antimüllerian hormone among women with and without type 1 diabetes: the Epidemiology of Diabetes Interventions and Complications Study and the Michigan Bone Health and Metabolism Study. Fertil Steril. 2016;106(6):1446-1452. doi: 10.1016/j.fertnstert.2016.07.009
12. Al Khafajia MM, Al-Taeea HA, Al-Shaikhb SF. Assessment of anti-Mullerian hormone level in reproductive age group women with diabetes mellitus type one. Middle East Fertility Society Journal. 2017;22(4):269-272. doi: 10.1016/j.mefs.2017.04.004
13. Codner E, Iñiguez G, Hernández IM, et al. Elevated anti-Müllerian hormone (AMH) and inhibin B levels in prepubertal girls with type 1 diabetes mellitus. Clin Endocrinol (Oxf). 2011;74(1):73-78. doi: 10.1111/j.1365-2265.2010.03887.x
14. Tatone C, Amicarelli F, Carbone MC, et al. Cellular and molecular aspects of ovarian follicle ageing. Hum Reprod Update. 2008;14(2):131-142. doi: 10.1093/humupd/dmm048
15. Colton SA, Humpherson PG, Leese HJ, Downs SM. Physiological changes in oocyte-cumulus cell complexes from diabetic mice that potentially influence meiotic regulation. Biol Reprod. 2003;69(3):761-770. doi: 10.1095/biolreprod.102.013649
16. Chang AS, Dale AN, Moley KH. Maternal diabetes adversely affects preovulatory oocyte maturation, development, and granulosa cell apoptosis. Endocrinology. 2005;146(5):2445-2453. doi: 10.1210/en.2004-1472
17. Витязева И.И., Боголюбов С.В., Иловайская И.А., и др. Бесплодный брак у пациентов с сахарным диабетом // Сахарный диабет. – 2009. – Т. 12. – №4. – C. 6-9. [Vityazeva II, Bogolyubov SV, Ilovayskaya IA, et al. Infertile marriage in patients with diabetes mellitus. Diabetes mellitus. 2009;12(4):6-9. (In Russ.)] doi: 10.14341/2072-0351-5695.
18. Diamanti-Kandarakis E, Piperi C, Patsouris E, et al. Immunohistochemical localization of advanced glycation end-products (AGEs) and their receptor (RAGE) in polycystic and normal ovaries. Histochem Cell Biol. 2007;127(6):581-589. doi: 10.1007/s00418-006-0265-3
19. Košir Pogačnik R, Meden Vrtovec H, Vizjak A, et al. Possible role of autoimmunity in patients with premature ovarian insufficiency. Int J Fertil Steril. 2014;7(4):281-290.
20. Ebrahimi M, Akbari Asbagh F. The role of autoimmunity in premature ovarian failure. Iran J Reprod Med. 2015 Aug;13(8):461-472.
21. Толпыгина М.Г., Потин В.В., Тарасова М.А. Функция яичников у женщин с сахарным диабетом 1 типа // Журнал акушерства и женских болезней. – 2014. – Т. 63. – №3. – С. 53-57. [Tolpygina MG, Potin VV, Tarasova MA. Ovarian function in women with type 1 diabetes mellitus. Journal of obstetrics and women’s diseases. 2014; 63(3):53-57] doi: 10.17816/JOWD63353-57
22. Григорян О.Р., Жемайте Н.С., Джавелидзе М.И., и др. Оценка овариального резерва у женщин с сахарным диабетом 2-го типа (оригинальная статья) // Проблемы репродукции. – 2015. – Т. 21. – №4. – C. 27-34. [Grigoryan OR, Zhemaite NS, Dzhavelidze MI, et al. Evaluation of ovarian reserve in women with type 2 diabetes mellitus. Problemy reproduktsii. 2015;21(4):27-34. (In Russ.)] doi: 10.17116/repro201521427-34
Антимюллеров гормон | Вы и ваши гормоны от Общества эндокринологов
Альтернативные названия антимюллерова гормона
AMH; Фактор ингибирования Мюллера; МИФ; Гормон, ингибирующий Мюллериан; MIH; Вещество, ингибирующее Мюллериан; MIS
Что такое антимюллеров гормон?
Примерно через восемь недель после зачатия у человеческого плода есть два набора протоков, один из которых может развиваться в мужской репродуктивный тракт, а другой — в женский.Если плод генетически мужской (XY-хромосомы), то семенники эмбриона будут вырабатывать антимюллеров гормон. Это приводит к исчезновению мюллеровских (женских) протоков — отсюда и термин антимюллеровский гормон, в то время как тестостерон, вырабатываемый семенниками, заставляет мужские (волльфианские) протоки выжить. Протоки Воллфа развиваются в различные части мужской репродуктивной системы: придаток яичка, семявыносящие протоки, семенные пузырьки и предстательную железу. У плода женского пола (ХХ хромосомы) воллфиевые протоки исчезают (из-за недостатка тестостерона), а мюллеровы протоки развиваются в маточные трубы, матку (матку), шейку матки и верхнюю часть влагалища.
Антимюллеров гормон также может играть роль в регулировании выработки половых стероидов в период полового созревания, а также в яичниках и семенниках взрослых. В яичниках антимюллеров гормон, по-видимому, важен на ранних стадиях развития фолликулов, которые содержат и поддерживают яйцеклетки до оплодотворения. Чем больше у женщины фолликулов яичников, тем больше антимюллерова гормона могут вырабатывать ее яичники, поэтому в кровотоке можно измерить АМГ, чтобы оценить, сколько фолликулов осталось у женщины в яичниках: ее «яичниковый резерв».
Как контролируется антимюллеров гормон?
В настоящее время неизвестно, как контролируется выработка антимюллерова гормона.
Что произойдет, если у меня будет слишком много или слишком мало антимюллерова гормона?
Когда мужской плод не вырабатывает достаточно антимюллерова гормона, мюллеровы протоки не исчезают, и это приводит к стойкому синдрому мюллерова протока. Пациенты с этим синдромом выглядят как мужчины, но обычно у них неопущенные яички (крипторхизм) и низкое или полное отсутствие сперматозоидов из-за аномального развития протока Воллфа.Это может быть связано с пороком развития семявыносящего протока, и придатка яичка. Это состояние встречается редко.
Поскольку фолликулы яичников вырабатывают антимюллеров гормон во взрослом возрасте, измерение уровней антимюллерова гормона в крови позволяет оценить овариальный резерв у женщин. Следовательно, уровни антимюллерова гормона обычно используются для прогнозирования того, насколько хорошо женщина может отреагировать на стимуляцию яичников для лечения бесплодия в условиях экстракорпорального оплодотворения (ЭКО) и какие дозы гормонов следует использовать во время ЭКО.
У женщин уровни антимюллерова гормона достигают пика в период полового созревания и остаются относительно постоянными до наступления менопаузы, когда фолликулы не остаются, а уровни антимюллерова гормона становятся низкими. Некоторые исследования показывают, что уровень антимюллерова гормона может быть ниже нормы у женщин с преждевременной недостаточностью яичников. Однако результаты антимюллерова гормона следует интерпретировать с осторожностью, поскольку многие другие факторы могут влиять на фертильность человека.
Высокий уровень антимюллерова гормона может быть связан с синдромом поликистозных яичников.Однако измерение уровня антимюллерова гормона может ввести в заблуждение и не дать окончательного диагноза ни преждевременной недостаточности яичников, ни синдрома поликистозных яичников. Важно, чтобы любой тест для измерения уровня антимюллерова гормона проводился квалифицированным медицинским работником.
Последний раз отзыв: март 2018
Антимюллеров гормон — обзор
Антимюллеров гормон (АМГ) синтезируется в клетках Сертоли и является одним из первых белков, продуцируемых развивающимся семенником.АМГ вызывает регрессию мюллерова протоков внутри мужского эмбриона, которые в противном случае развивались бы как яйцеводы, матка и верхняя часть влагалища. В небольшой регуляторной области гена AMH были обнаружены сайты связывания для SOX9 и SF1 (стероидогенный фактор 1). Белки SOX9 и SF1 связываются с соседними сайтами в регуляторной области AMH и вызывают значительную повышающую регуляцию экспрессии AMH. У мышей мутация сайтов связывания Sox9 или Sf1 в регуляторной области Amh вызывает отмену или уменьшение, соответственно, экспрессии Amh .SOX9, по-видимому, необходим для инициации экспрессии AMH. SF1 физически взаимодействует с соседним белком SOX9, значительно повышая уровень транскрипта AMH. Определенная изоформа WT1 также, по-видимому, физически взаимодействует с SF1 для синергетического усиления экспрессии AMH. В противоположность этому, DAX1, как было показано в экспериментах in vitro , подавляет синергетическое действие SF1 и WT1 на промотор AMH . Это говорит о том, что когда существует ненормальная двойная доза DAX1 и он присутствует в больших количествах в яичках, это может блокировать нормальную повышающую регуляцию экспрессии AMH.Нормальная роль DAX1 в яичнике может заключаться в предотвращении экспрессии AMH. Один член семейства факторов транскрипции GATA , GATA4 , экспрессируется в развивающихся гонадах. Сайт связывания GATA4 также присутствует в регуляторной области AMH. Считается, что белок GATA4 может связываться с этим сайтом и взаимодействовать с SOX9, регулируя экспрессию AMH. Роль WT1 и GATA4 в регуляции AMH не подтверждена in vivo .Однако мы можем четко утверждать, что SOX9 и SF1 вместе повышают экспрессию AMH . В то время как AMH необходим для половой дифференциации репродуктивного тракта, отсутствие AMH не влияет на развитие семенников.
Генетический контроль определения пола человека. (По материалам O’Neill M и Sinclair A (1996). Ген, определяющий семенники, SRY. Advances in Genome Biology 4: 29-51.)
Роль антимюллерова гормона и тестостерона в росте фолликулов: перекрестная секционное исследование | BMC Endocrine Disorders
Описание образца исследования
Как показано на рис.1, с апреля 2016 г. по март 2019 г. было включено 3487 женщин, обследованных на АМГ и половые гормоны. Одна тысяча двести двадцать один случай был исключен, потому что тест на половые гормоны не проводился на ранней стадии фолликула. Позже 149 случаев были исключены из-за кисты яичников, гиперпролактинемии, злокачественных заболеваний, операций, гипофизомы и сахарного диабета. Наконец, 2117 женщин остались для дальнейшего анализа корреляции, включая 68 СПКЯ и 56 эндометриоз.
Характеристики исследуемой популяции представлены в таблице 1.В группе DOR средний возраст, вес и ИМТ были выше ( P <0,001). В группе СПКЯ средний возраст был значительно ниже в группе СПКЯ, чем в контрольной группе, а средний вес, ИМТ и АМГ были значительно выше (P <0,001). Не было разницы в росте, уровне FPG и FPI ( P > 0,05).
Таблица 1 Характеристики включенных субъектовКорреляция между демографическими характеристиками, половыми гормонами и AMH
Тест Пирсона был проведен для исследования корреляции между демографическими характеристиками, гонадотропинами, стероидами яичников и AMH.Как показано на рис. 2a и d, в общей популяции возраст (R = -0,457, P <0,001) и ФСГ (R = -0,310, P <0,001) умеренно и слабо коррелировали с АМГ. Между тем, ЛГ (R = 0,307, P <0,001) и T (R = 0,346, P <0,001) слабо коррелировали с AMH положительно (рис. 2e и i). Слабая отрицательная корреляция между весом (R = - 0,050, P = 0,021), ИМТ (R = — 0,058, P = 0,008), E 2 (R = — 0,052, P = 0.017) и AMH (рис. 2б, в, ж). Корреляции между PRL, P, ростом и AMH не было ( P > 0,01).
Рис. 2Корреляция между уровнем АМГ и демографическими характеристиками и половыми гормонами. АМГ: антимюллеров гормон. ИМТ: индекс массы тела. ФСГ: фолликулостимулирующий гормон. ЛГ: лютеинизирующий гормон. ПРЛ: пролактин. E 2 : эстрадиол. П: прогестерон. Т: тестостерон. * P <0,05
Поскольку корреляционный анализ Пирсона показал, что возраст, вес, ИМТ, ФСГ, ЛГ, E 2 и T коррелировали с AMH, для дальнейшего изучения взаимосвязи были выполнены множественные линейные регрессионные анализы с пошаговыми анализами. между этими показателями и AMH.Результаты показали, что в контрольной группе значительный вклад в прогнозирование сывороточного АМГ вносили возраст, ФСГ, ЛГ, E 2 и Т, но не вес и ИМТ (таблица 2). Возраст, ФСГ и E 2 отрицательно коррелировали с АМГ, а ЛГ и Т положительно коррелировали с АМГ ( P <0,001).
Таблица 2 Корреляция демографических характеристик, половых гормонов и АМГ по множественной линейной регрессииДемографические характеристики и половые гормоны в группе DOR
Возраст был значительно старше в группе DOR по сравнению с контролем (рис.3а). Поскольку в этом исследовании DOR был диагностирован с отсечкой AMH, уровень AMH в группе DOR был намного ниже, чем в контрольной группе (рис. 3b). Вес и ИМТ показали небольшое увеличение в группе DOR ( P <0,05) (рис. 3c и d). Для гормонов гипофиза уровень ФСГ значительно увеличился в группе DOR, в то время как LH и PRL существенно не изменились между двумя группами ( P > 0,05) (рис. 3e, f и g). Для стероидов яичников значительное увеличение E 2 и значительное снижение T наблюдалось в группах DOR по сравнению с контролем (рис.3h, h и j).
Рис. 3Демографические характеристики и половые гормоны в группах NOR, DOR и PCOS. НОР: нормальный овариальный резерв. ДОР: уменьшение овариального резерва. СПКЯ: синдром поликистозных яичников. ИМТ: индекс массы тела. ФСГ: фолликулостимулирующий гормон. ЛГ: лютеинизирующий гормон. ПРЛ: пролактин. E 2 : эстрадиол. П: прогестерон. Т: тестостерон. * P <0,05
Демографические характеристики и половые гормоны в группе СПКЯ
Возраст был значительно ниже в группе СПКЯ по сравнению с контролем (рис.3а). Как показано на рис. 3b, средний уровень АМГ почти удвоился в группе с СПКЯ по сравнению с контрольной группой (6,93 ± 3,84 против 4,08 ± 3,00, P <0,05). Уровни веса и ИМТ показали значительное увеличение в группе с СПКЯ по сравнению с контролем (рис. 3c и d). Что касается гормонов гипофиза, уровень ЛГ значительно увеличился в группе с СПКЯ, а уровни ФСГ и ПРЛ были одинаковыми между двумя группами (рис. 3e, f и g). Для гормонов яичников уровень Т показал значительное повышение в группе СПКЯ по сравнению с контролем, а вариации E , 2, и P не были значительными (рис.3h, i и j).
Логистическая регрессия групп DOR и PCOS
Для анализа прогнозов DOR по возрасту, весу, ИМТ, ФСГ, E 2 и T. Возраст, вес, ФСГ, E 2 использовалась бинарная логистическая регрессия с прямым методом. и Т, но не ИМТ, были значимыми факторами, которые независимо предсказывали вероятность DOR. В модели логистической регрессии, скорректированной с учетом возраста, веса, ФСГ и E 2 , повышение уровня Т на один нмоль / л было связано со снижением в 0,60 раза (95% ДИ: 0.42–0,87, P = 0,007) риск DOR (таблица 3).
Таблица 3 Взаимосвязь AMH, демографических характеристик и половых гормонов у пациентов с DOR и PCOS с использованием логистической регрессииБинарная логистическая регрессия с прямым методом использовалась для анализа прогнозов на PCOS по возрасту, весу, ИМТ, AMH, FSH, LH и Т. Возраст, ИМТ, АМГ, ЛГ и Т, но не вес и ФСГ, были значимыми факторами, которые независимо предсказывали вероятность СПКЯ. В модели логистической регрессии с поправкой на возраст, ИМТ, АМГ и ЛГ повышение уровня тестостерона на один нмоль / л было связано с 1.В 54 раза увеличился (95% ДИ: 1,06–2,24, P = 0,025) риск СПКЯ (Таблица 3).
Антимюллеров гормон (АМГ): что нам еще нужно знать? | Репродукция человека
8″ data-legacy-id=»s1″> Введение
В апреле 2008 г. в Модене (Италия) под эгидой Специальной группы по репродуктивной эндокринологии был организован семинар ESHRE Campus Workshop под названием «Яичниковый резерв: новые идеи для клинического ведения».Во время этой встречи круглый стол на тему «Антимюллеров гормон (АМГ): что нам еще нужно знать?» Предоставил возможность многим исследовательским группам, работающим с АМГ, оценить наши текущие знания и обсудить вопросы клинических исследований. которые еще предстоит решить.
Обсуждаемые вопросы включали: (i) современные взгляды на роль AMH в фолликулогенезе, (ii) анализы для измерения сывороточного AMH, (iii) AMH и дисфункцию яичников, (iv) роль AMH в тестировании резерва яичников.В этой статье резюмируется понимание экспертами этих тем и выделяются те вопросы, которые, как считается, требуют дальнейшего исследования.
0″ data-legacy-id=»s2a»> Проблемы, требующие дальнейшего изучения
Подавляющее большинство из исследований in vitro AMH было проведено на грызунах. Хотя основные результаты, по-видимому, также применимы к яичникам человека, это все еще необходимо продемонстрировать. Важные аспекты, требующие дальнейшего уточнения, включают (а) какие именно фолликулы секретируют АМГ, (б) роль АМГ, присутствующего в фолликулярной жидкости, (в) роль АМГ в фолликулогенезе яичников и (г) возможные экстраариальные эффекты AMH.
Хотя было показано, что АМГ в основном оказывает аутокринное и паракринное действие на развитие фолликулов, этот белок также можно измерить в сыворотке крови. Антральные фолликулы считаются основным источником циркулирующего АМГ, поскольку они содержат большое количество клеток гранулезы. Совокупность клинических данных свидетельствует о том, что АМГ преимущественно и постоянно секретируется небольшими, а не большими антральными фолликулами. Количество и скорость продукции AMH одним антральным фолликулом должны быть исследованы и, в частности, его модификация в зависимости от фолликулярной гормональной среды и старения.
Клетки гранулезы секретируют АМГ как в кровоток, так и в фолликулярную жидкость, хотя в последней концентрации намного выше. Однако точная роль AMH в этом компартменте не выяснена. В дополнение к паракринному и аутокринному действию на клетки гранулезы может быть определена возможная прямая роль в модулировании физиологии ооцитов.
Срочно необходимы более глубокие знания о физиологической роли АМГ в фолликулогенезе яичников человека. Как только это будет выяснено, откроется путь к разработке экспериментов по манипулированию фолликулогенезом.Поскольку AMH, по-видимому, является мощным тормозом фолликулярного перехода, супрафизиологическое воздействие экзогенного рекомбинантного AMH может создать новую стратегию гормональной контрацепции и, что, возможно, более важно, замедлить процесс репродуктивного старения.
Следующее новое направление исследований будет сосредоточено на возможных экстраариальных эффектах AMH. Рецепторы AMH типа II были идентифицированы в тканях, отличных от яичника, таких как эндометрий человека (Wang et al ., 2008), и в нескольких линиях раковых клеток человека, в том числе происходящих из шейки матки (Barbie et al ., 2003), эндометрия (Renaud et al ., 2005), эпителия яичников (Masiakos et al ., 1999; Ha et al ., 2000) и молочной железы (Segev et al ., 2000).
7″ data-legacy-id=»s3a»> Текущие анализы
До недавнего времени анализы AMH были доступны только в нескольких лабораториях по всему миру. Отсутствие доступа к единому надежному и стандартизированному коммерческому анализу препятствовало развитию АМГ как клинического маркера резерва яичников.9 лет назад был разработан чувствительный анализ ELISA, способный определять уровни до 2 нг / мл (Long et al ., 2000). Однако недавно были разработаны новые коммерческие сверхчувствительные сэндвич-анализы ELISA, способные определять концентрации <0,1 нг / мл. Повышенная чувствительность и доступность различных анализов подчеркнули острую необходимость согласования используемых стандартных препаратов, чтобы избежать путаницы в сообщаемых уровнях и интерпретации.
В настоящее время доступны два высокочувствительных сэндвич-теста ELISA: Diagnostic Systems Laboratories (DSL) и Immunotech-Beckman.Сообщается, что чувствительность DSL составляет 0,025 нг / мл по сравнению с 0,07 нг / мл для анализа Immunotech-Beckman, хотя это различие не было подтверждено в недавнем клиническом исследовании (Taieb et al ., 2008). Вариации внутри и между анализами двух анализов аналогичны (<7 и <5%, соответственно). Анализ DSL не зависит от вида, что может быть полезно для исследовательских лабораторий, использующих модели грызунов.
Первоначальные исследования, сравнивающие два анализа, показали, что уровни АМГ, по-видимому, в 4–5 раз ниже при анализе DSL по сравнению с анализом Immunotech-Beckman (Bersinger et al ., 2007; Fréour et al ., 2007). В своем отчете Bersinger et al. (2007) упомянул проблемы, присущие измерениям AMH, которые проистекают из остаточных матричных эффектов и нестабильности определенных антигенных детерминант. Однако, несмотря на независимую разработку, эти анализы в настоящее время производятся одной компанией (Beckman-Coulter), и перекрестные ссылки показали, что корреляция между двумя анализами составляет> 0,9 (личное сообщение представителя Beckman-Coulter).Это подтверждается недавними исследованиями, в которых были обнаружены схожие значения АМГ в обоих анализах (Taieb et al. ., 2008; Streuli et al. ., 2009), что позволяет предположить, что методологические проблемы, упомянутые Bersinger et al. (2007) должен был быть рассмотрен и разрешен производителем анализа.
Оба набора, вероятно, останутся в производстве в течение следующих нескольких лет, поскольку примерно половина исследователей использует тест DSL, а другая половина — продукт Immunotech-Beckman.
6″ data-legacy-id=»s4″> Роль АМГ в исследовании дисфункции яичников
3″ data-legacy-id=»s4b»> Синдром поликистозных яичников
Ряд исследований показал повышение уровня АМГ в сыворотке у женщин с синдромом поликистозных яичников (СПКЯ) по сравнению с контрольной группой (Cook et al ., 2002; Pigny et al ., 2003; La Marca et al ). ., 2004b; Лавен и др. ., 2004; Малдерс и др. ., 2004; Эльдар-Гева и др. ., 2005b; Пилтонен и др. , 2005; La Marca et al. , 2006а; Wachs et al ., 2007) (Таблица I). Считается, что это результат повышенного синтеза клетками гранулезы и секреции AMH в поликистозных яичниках (Mulders et al ., 2004). Действительно, уровни AMH в среднем в 75 раз выше в гранулезных клетках поликистозных яичников по сравнению с уровнями в нормальных яичниках (Pellatt et al ., 2007). Кроме того, повышение уровня АМГ при СПКЯ может быть связано с нарушением фолликулогенеза, что приводит к избыточному накоплению преантральных и малых антральных фолликулов (Wang et al ., 2007).
Таблица IБыло обнаружено, что уровни АМГ в сыворотке значительно повышены при СПКЯ по сравнению со здоровыми женщинами.
| Автор . | Год . | Пациенты ( n ) . | Уровни АМГ (нг / мл) . | ||
|---|---|---|---|---|---|
| . | . | . | Органы управления . | СПКЯ . | Среднее увеличение в% . |
| Кук и др. . | 2002 | 47 | 2,4 ± 0,2 | 5,3 ± 0,7 | +120 |
| Пиньи и др. . | 2003 | 104 | 2,9 ± 0,3 | 6,6 ± 0,4 | +127 |
| Ла Марка и др. . | 2004b | 29 | 1.3 ± 0,5 | 5 ± 1,8 | +284 |
| Лавен и др. . | 2004 | 109 | 2,1 ± 0,6 | 7,6 ± 1,8 | +261 |
| Piltonen et al . | 2005 | 170 | 2,4 ± 0,2 | 8,1 ± 0,8 | +237 |
| Эльдар-Гева и др. . | 2005b | 52 | 1,6 ± 0,8 | 5.1 ± 1,3 | +218 |
| Ла Марка и др. . | 2006a | 34 | 3,5 ± 1,5 | 7,4 ± 1,7 | +111 |
| Wachs et al . | 2007 | 27 | 2,1 ± 0,4 | 7,2 ± 0,5 | +242 |
| Автор . | Год . | Пациенты ( n ) . | Уровни АМГ (нг / мл) . | ||
|---|---|---|---|---|---|
| . | . | . | Органы управления . | СПКЯ . | Среднее увеличение в% . |
| Кук и др. . | 2002 | 47 | 2,4 ± 0,2 | 5,3 ± 0,7 | +120 |
| Пиньи и др. . | 2003 | 104 | 2,9 ± 0,3 | 6,6 ± 0,4 | +127 |
| Ла Марка и др. . | 2004b | 29 | 1,3 ± 0,5 | 5 ± 1,8 | +284 |
| Лавен и др. . | 2004 | 109 | 2,1 ± 0,6 | 7,6 ± 1,8 | +261 |
| Piltonen et al . | 2005 | 170 | 2.4 ± 0,2 | 8,1 ± 0,8 | +237 |
| Эльдар-Гева и др. . | 2005b | 52 | 1,6 ± 0,8 | 5,1 ± 1,3 | +218 |
| Ла Марка и др. . | 2006a | 34 | 3,5 ± 1,5 | 7,4 ± 1,7 | +111 |
| Wachs et al . | 2007 | 27 | 2,1 ± 0,4 | 7.2 ± 0,5 | +242 |
Было обнаружено, что уровни АМГ в сыворотке значительно повышены при СПКЯ по сравнению со здоровыми женщинами.
| Автор . | Год . | Пациенты ( n ) . | Уровни АМГ (нг / мл) . | ||
|---|---|---|---|---|---|
| . | . | . | Органы управления . | СПКЯ . | Среднее увеличение в% . |
| Кук и др. . | 2002 | 47 | 2,4 ± 0,2 | 5,3 ± 0,7 | +120 |
| Пиньи и др. . | 2003 | 104 | 2,9 ± 0,3 | 6,6 ± 0,4 | +127 |
| Ла Марка и др. . | 2004b | 29 | 1,3 ± 0,5 | 5 ± 1,8 | +284 |
| Лавен и др. . | 2004 | 109 | 2,1 ± 0,6 | 7,6 ± 1,8 | +261 |
| Piltonen et al . | 2005 | 170 | 2,4 ± 0,2 | 8,1 ± 0,8 | +237 |
| Эльдар-Гева и др. . | 2005b | 52 | 1.6 ± 0,8 | 5,1 ± 1,3 | +218 |
| Ла Марка и др. . | 2006a | 34 | 3,5 ± 1,5 | 7,4 ± 1,7 | +111 |
| Wachs et al . | 2007 | 27 | 2,1 ± 0,4 | 7,2 ± 0,5 | +242 |
| Автор . | Год . | Пациенты ( n ) . | Уровни АМГ (нг / мл) . | ||
|---|---|---|---|---|---|
| . | . | . | Органы управления . | СПКЯ . | Среднее увеличение в% . |
| Кук и др. . | 2002 | 47 | 2,4 ± 0,2 | 5,3 ± 0,7 | +120 |
| Пиньи и др. . | 2003 | 104 | 2,9 ± 0,3 | 6,6 ± 0,4 | +127 |
| Ла Марка и др. . | 2004b | 29 | 1,3 ± 0,5 | 5 ± 1,8 | +284 |
| Лавен и др. . | 2004 | 109 | 2,1 ± 0,6 | 7,6 ± 1,8 | +261 |
| Piltonen et al . | 2005 | 170 | 2.4 ± 0,2 | 8,1 ± 0,8 | +237 |
| Эльдар-Гева и др. . | 2005b | 52 | 1,6 ± 0,8 | 5,1 ± 1,3 | +218 |
| Ла Марка и др. . | 2006a | 34 | 3,5 ± 1,5 | 7,4 ± 1,7 | +111 |
| Wachs et al . | 2007 | 27 | 2,1 ± 0,4 | 7.2 ± 0,5 | +242 |
Повышенные уровни АМГ также были обнаружены у дочерей женщин с СПКЯ в препубертатном (Sir-Petermann et al ., 2007) и перипубертатном (Crisosto et al ., 2007) состоянии. а также у девочек-подростков с СПКЯ с нормальным менструальным циклом (Siow et al ., 2005), предполагая, что измененное развитие фолликулов уже присутствует в младенчестве и в раннем взрослом возрасте до того, как проявится клинический фенотип дисфункции яичников.
Уровни АМГ, по-видимому, связаны с тяжестью синдрома, поскольку наблюдались более высокие уровни у инсулинорезистентных женщин с СПКЯ, чем у пациентов с нормальной чувствительностью к инсулину (Fleming et al ., 2006). Точно так же АМГ выше у женщин с аменореей по сравнению с олигоменореей у женщин с СПКЯ (La Marca et al ., 2004b), что может указывать на роль АМГ в патогенезе ановуляции, связанной с СПКЯ. С другой стороны, высокие значения АМГ могут отражать большее нарушение фолликулогенеза и функции гранулезных клеток в яичниках при аменорее по сравнению с женщинами с олигоменореей с СПКЯ (La Marca et al ., 2004b).
В недавнем продольном исследовании уровни АМГ в сыворотке были измерены у 98 женщин с СПКЯ и 41 контрольной женщины в двух временных точках (интервал между посещениями: 0,3–9 лет). Хотя уровни АМГ в сыворотке крови со временем снижались в обеих группах, снижение, наблюдаемое у пациентов с СПКЯ, было меньше, чем в контроле. Авторы этого исследования предположили, что это может указывать на более длительную репродуктивную продолжительность жизни у пациентов с СПКЯ (Mulders et al ., 2004). При гистологическом исследовании поликистозные яичники показывают среднюю плотность небольших преантральных фолликулов, в том числе на начальной и первичной стадиях, в 6 раз больше, чем в нормальных яичниках (Hughesdon, 1982; Webber et al ., 2003). Следовательно, можно предположить, что процесс старения яичников у женщин с СПКЯ задерживается, поскольку высокие уровни АМГ могут ингибировать истощение пула примордиальных фолликулов (Mulders et al ., 2004).
Было обнаружено, что измерение AMH обеспечивает относительно высокую специфичность и чувствительность (92 и 67% соответственно) в качестве диагностического маркера СПКЯ (Pigny et al ., 2006). На этом основании было предложено, чтобы в ситуациях, когда точные данные УЗИ недоступны, АМГ можно было бы использовать вместо подсчета фолликулов в качестве диагностического критерия для СПКЯ (Pigny et al ., 2006).
Помимо диагностической оценки, измерение АМГ также может быть полезно в терапевтическом подходе к пациентам с СПКЯ. Действительно, у женщин с избыточным весом с СПКЯ, которые реагируют на потерю веса улучшением менструального цикла, значительно снижается уровень АМГ до потери веса, что указывает на то, что исходный уровень АМГ может служить потенциальным клиническим предиктором улучшения менструального цикла с потерей веса при СПКЯ (Moran et al ., 2007). . Точно так же оценка базального уровня АМГ может быть полезна для прогнозирования ответа яичников на цитрат кломифена (El-Halawaty et al ., 2007). Наконец, было показано, что введение метформина женщинам, страдающим СПКЯ, связано со снижением как уровней АМГ в сыворотке, так и антральных фолликулов, что позволяет предположить, что измерение АМГ можно использовать для оценки эффективности лечения сенсибилизаторами инсулина (Piltonen et al ., 2005).
6″ data-legacy-id=»s5″> Роль АМГ как маркера яичникового резерва
5″ data-legacy-id=»s5b»> AMH как прогностический фактор у бесплодных женщин
Во время стимуляции яичников уровни AMH в сыворотке положительно коррелируют с количеством маленьких (но не больших) антральных фолликулов и с уровнями ингибина B в сыворотке (Fanchin et al ., 2003a, b). Было показано, что уровни АМГ в сыворотке постепенно снижаются во время развития множественных фолликулов, что, вероятно, отражает резкое сокращение количества малых антральных фолликулов и подтверждает сообщенные низкие уровни экспрессии АМГ более крупными фолликулами (Bézard et al ., 1988; Fanchin et al ., 2003a, b; La Marca et al ., 2004a).
При оценке AMH как маркера ответа яичников, первая статья, в которой сообщается о связи между циркулирующим AMH и ответом яичников на стимуляцию гонадотропинами, была опубликована Seifer et al . (2002), которые сообщили, что более высокие уровни АМГ в сыворотке на третий день были связаны с большим количеством извлеченных ооцитов. Этот вывод был подтвержден несколькими ретроспективными и проспективными исследованиями, проведенными рядом независимых групп (Van Rooij et al ., 2002; Fanchin et al ., 2003a, b; Hazout и др. , 2004; Муттукришна и др. , 2004, 2005; Эльдар-Гева и др. ., 2005a; Тремеллен и др. , 2005; Peñarrubia et al ., 2005; Fiçicioglu et al ., 2006; La Marca et al ., 2007; Кви и др. , 2007; Элгинди и др. ., 2008; McIlveen et al ., 2007; Нельсон и др. , 2007; Wunder и др. , 2008; Gnoth и др. ., 2008; Нардо и др. , 2008; Джаяпракасан и др. , 2008; Нельсон и др. ., 2009).
В доступной в настоящее время литературе показано, что АМГ может быть лучшим маркером для прогнозирования ответа яичников в зависимости от возраста пациентки, 3-го дня ФСГ, эстрадиола или ингибина B, тогда как подавляющее большинство исследований показали, что AMH и AFC имеют аналогичную прогностическую ценность. за плохой ответ. Недавно в метаанализе сравнили значение сывороточного уровня АМГ с показателями AFC в качестве теста для прогнозирования плохой реакции яичников и наступления беременности после ЭКО.Всего было найдено 13 исследований, посвященных AMH, и 17 — AFC. Кривые оператора приемника для прогнозирования плохого отклика не выявили существенной разницы между прогнозируемой ценностью AMH и AFC. Для прогноза отсутствия беременности оба уровня сывороточного АМГ и AFC показали одинаково низкие показатели. В заключение, в настоящее время AMH, по-видимому, предлагает, по крайней мере, такой же уровень точности и клиническую ценность для прогнозирования плохого ответа и отсутствия беременности, что и AFC (Broer et al ., 2008) (рис.4).
Рисунок 4
Точность плохого ответа и прогнозов отсутствия беременности.
AMH, наряду с AFC, в настоящее время является лучшим предиктором возникновения плохого ответа на гиперстимуляцию при ЭКО. Прогнозирование беременности остается неадекватным (из Broer et al ., 2008). AFC: количество антральных фолликулов; АМГ: антимюллеров гормон; ROC: рабочая характеристика приемника.Рисунок 4
Точность плохого ответа и прогнозов отсутствия беременности.
AMH, наряду с AFC, в настоящее время является лучшим предиктором возникновения плохого ответа на гиперстимуляцию при ЭКО. Прогнозирование беременности остается неадекватным (из Broer et al ., 2008). AFC: количество антральных фолликулов; АМГ: антимюллеров гормон; ROC: рабочая характеристика приемника.Уровни АМГ в сыворотке также могут быть предиктором гиперответа на ФСГ и, следовательно, могут быть полезны для прогнозирования женщин с риском синдрома гиперстимуляции яичников (СГЯ) (Nakhuda et al ., 2006; Тремеллен и др. , 2005; Ли и др. ., 2008). Ли и др. (2008) четко продемонстрировали, что измерение базального уровня АМГ, а также количества фолликулов и уровней эстрадиола в день ХГЧ помогает выявить женщин, у которых разовьется СГЯ.
Одно из основных преимуществ измерения АМГ при ВРТ по сравнению с другими маркерами овариального резерва может заключаться в его низкой меж- и внутрицикловой вариабельности. Относительная стабильность и постоянство уровней АМГ в сыворотке указывают на то, что АМГ можно использовать в качестве независимого от менструального цикла маркера ответа яичников на контролируемую стимуляцию яичников.Первое исследование, посвященное этому вопросу, продемонстрировало, что измерение АМГ в любой день цикла имеет прогностическую эффективность для ответа на стимуляцию яичников при ВРТ (La Marca et al ., 2007). Этот вывод был недавно подтвержден в большом проспективном исследовании 538 пациенток, получающих АРТ (Nelson et al ., 2009), что укрепляет концепцию о том, что забор крови в любой момент менструального цикла будет предпочтительным методом измерения АМГ. из-за его неоспоримых преимуществ как для пациента, так и для врача.
В дополнение к отражению количественной реакции яичников, несколько авторов обнаружили значительную положительную корреляцию между уровнями АМГ и качеством ооцитов (Hazout et al ., 2004; Ebner et al .2006; Silberstein et al ., 2006; Cupisti et al ., 2007) и морфологии эмбриона (Silberstein et al ., 2006). Однако эта связь не была подтверждена другими (Smeenk et al ., 2007; Lie Fong et al ., 2008а). Более того, в недавнем исследовании не было продемонстрировано устойчивой корреляции между AMH и морфологией эмбриона и, что наиболее важно, частотой анеуплоидии эмбриона (Lie Fong et al ., 2008a). Следовательно, возможное предсказание качественных аспектов программ АРТ с помощью измерения AMH остается в значительной степени спорным. Это также очевидно из исследований, в которых сообщается о частоте наступления беременности после ЭКО. Ряд авторов пытались определить пороговые уровни АМГ, которые позволяют различать беременность и отсутствие беременности (Hazout et al ., 2004; Эльдар-Гева и др. ., 2005a; Кви и др. , 2007; Элгинди и др. ., 2008). Однако большинство из них указали, что измерение AMH не полезно для прогнозирования этой конечной точки (Van Rooij et al ., 2002; Fanchin et al ., 2003b; Penarrubia et al ., 2005; Ebner ). et al ., 2006; Fiçicioglu et al ., 2006; Kwee et al ., 2007; Smeenk et al ., 2007). К настоящему времени опубликовано только одно исследование, в котором уровни АМГ в сыворотке крови соотносились с частотой живорождений после ЭКО (Nelson et al ., 2009). В этом проспективном исследовании с участием 340 пациентов было продемонстрировано, что частота живорождений резко возрастает с увеличением базального значения АМГ. Однако, как заключил тот же автор, это открытие может, по крайней мере, частично объясняться очень хорошей корреляцией, существующей между базальным AMH и количеством извлеченных ооцитов (Nelson et al ., 2009), что указывает на то, что циркулирующий AMH может определенно считаться лучшим маркером для количественных, чем для качественных аспектов АРТ.
8″ data-legacy-id=»s6″> Выводы
Таким образом, имеющиеся в настоящее время данные показывают, что АМГ продуцируется растущими преантральными и ранними антральными фолликулами.На мышах было продемонстрировано, что АМГ подавляет начальное рекрутирование фолликулов на начальной стадии покоя. Кроме того, АМГ может влиять на ФСГ-зависимый рост более зрелых фолликулов. Однако точная природа функции AMH в яичниках человека и, в частности, паракринная роль AMH в фолликулогенезе и стероидогенезе яичников у человека остается в значительной степени спекулятивной.
Поскольку АМГ связан с фолликулярным статусом яичников, измерение циркулирующего АМГ может предоставить полезную информацию у женщин с дисфункцией яичников.Изменения уровней АМГ при некоторых физиологических и патологических состояниях представлены в Таблице II.
Таблица IIИзменения маркеров функции яичников в течение жизни женщины и при некоторых патологических состояниях (изменено из La Marca et al ., 2006c).
| Маркеры * . | Поздний репродуктивный период . | Постменопауза . | Беременность . | СПКЯ . | Гипогонадотропный гипогонадизм . | Гипергонадотропный гипогонадизм . |
|---|---|---|---|---|---|---|
| FSH | ↔ / ↑ | ↑ | ↓ | ↔ | ↔ / ↓ | ↑ | ↓
| ↑ | ↑↔ / ↓ | ↓ | ||||
| Ингибин B | ↓ | ↓ | ↔ | ↔ / ↑ | ↔ | ↓ | ↓ | ↓ 9046 9046 ↑↔ | ↓ / nd |
| Маркеры * . | Поздний репродуктивный период . | Постменопауза . | Беременность . | СПКЯ . | Гипогонадотропный гипогонадизм . | Гипергонадотропный гипогонадизм . |
|---|---|---|---|---|---|---|
| FSH | ↔ / ↑ | ↑ | ↓ | ↔ | ↔ / ↓ | ↑ | ↓
| ↑ Эстрадиол | ↑ ↑↑ | ↔ / ↓ | ↓ | |||
| Ингибин B | ↓ | ↓ | ↔ | ↔ / ↑ | ↔ | ↓ | ↓ | ↓ 9046 9046 ↑↔ | ↓ / nd |
Изменения маркеров функции яичников в течение жизни женщины и при некоторых патологических состояниях (изменено из La Marca et al ., 2006c).
| Маркеры * . | Поздний репродуктивный период . | Постменопауза . | Беременность . | СПКЯ . | Гипогонадотропный гипогонадизм . | Гипергонадотропный гипогонадизм . |
|---|---|---|---|---|---|---|
| FSH | ↔ / ↑ | ↑ | ↓ | ↔ | ↔ / ↓ | ↑ | ↓
| ↑ | ↑↔ / ↓ | ↓ | ||||
| Ингибин B | ↓ | ↓ | ↔ | ↔ / ↑ | ↔ | ↓ | ↓ | ↓ 9046 9046 ↑↔ | ↓ / nd |
| Маркеры * . | Поздний репродуктивный период . | Постменопауза . | Беременность . | СПКЯ . | Гипогонадотропный гипогонадизм . | Гипергонадотропный гипогонадизм . |
|---|---|---|---|---|---|---|
| FSH | ↔ / ↑ | ↑ | ↓ | ↔ | ↔ / ↓ | ↑ | ↓
| ↑ | ↑↔ / ↓ | ↓ | ||||
| Ингибин B | ↓ | ↓ | ↔ | ↔ / ↑ | ↔ | ↓ | ↓ | ↓ 9046 9046 ↑↔ | ↓ / nd |
Уровни циркулирующего АМГ повышены у женщин с СПКЯ, и было предложено его использование в качестве клинического диагностического маркера синдрома.До сих пор неясно, могут ли уровни АМГ отражать тяжесть нарушения функции яичников или играть роль в прогнозировании результатов отдельных схем лечения.
AMH может быть ценным маркером резерва яичников в общей популяции, что может способствовать планированию репродуктивной жизни для женщин. Однако лонгитюдные данные о значениях АМГ в течение репродуктивной продолжительности жизни недоступны, и остается неизвестным, могут ли уровни АМГ способствовать независимому от возраста прогнозированию продолжительности репродуктивной жизни людей и спонтанной беременности в общей популяции.В настоящее время применение измерения AMH для оценки фертильности среди населения в целом вне контекста научных исследований нецелесообразно.
Относительная стабильность и постоянство уровней АМГ в сыворотке указывает на то, что АМГ можно использовать в качестве предиктора ответа яичников на контролируемую стимуляцию яичников. В этом приложении предсказательная сила AMH для ответа яичников на ФСГ, по-видимому, аналогична той, которая демонстрируется подсчетом антральных фолликулов. Одним из основных преимуществ измерения AMH может быть его использование в качестве независимого от цикла теста.Точная роль измерения АМГ в условиях ЭКО должна быть уточнена также с учетом анализа затрат и выгод. С высокой вероятностью наиболее полезным клиническим применением измерения AMH может быть индивидуализация стратегий лечения COS.
В итоге, хотя AMH может улучшить наше понимание патофизиологии яичников и направить клиническое ведение широкого диапазона Из-за состояний необходимо решить ряд важных вопросов, касающихся как базовой физиологии АМГ, так и его клинических проявлений, особенно у человека.
Заметки автора
© Автор 2009.Опубликовано Oxford University Press от имени Европейского общества репродукции человека и эмбриологии. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.Антимюллеров гормон: маркер овариального резерва при первичной недостаточности яичников.
Конвей, Г.С. Преждевременная недостаточность яичников. руб. Med. Бык. 56 , 643–649 (2000).
Артикул CAS Google Scholar
Олбрайт, Ф., Смит, П. Х. и Фрейзер, Р. Синдром, характеризующийся первичной недостаточностью яичников и снижением роста: отчет об 11 случаях с отклонением от гормонального контроля подмышечных и лобковых волос. г. J. Med. Sci. 204 , 625–648 (1942).
Артикул Google Scholar
Welt, C.K. Первичная недостаточность яичников: более точный термин для преждевременной недостаточности яичников. Clin. Эндокринол. (Oxf.) 68 , 499–509 (2008).
Артикул Google Scholar
Нельсон Л. М. Клиническая практика. Первичная недостаточность яичников. N. Engl. J. Med. 360 , 606–614 (2009).
Артикул CAS PubMed PubMed Central Google Scholar
Де Вос, М., Девроей, П. и Фаузер, Б.С. Первичная недостаточность яичников. Ланцет 376 , 911–921 (2010).
Артикул Google Scholar
те Велде, Э. Р. и Пирсон, П. Л. Изменчивость женского репродуктивного старения. Hum. Репрод. Обновление 8 , 141–154 (2002).
Артикул Google Scholar
Coulam, C. B., Adamson, S. C. и Annegers, J. F. Частота преждевременной недостаточности яичников. Акушерство. Гинеколь. 67 , 604–606 (1986).
CAS PubMed Google Scholar
Анасти, Дж. Н. Преждевременная недостаточность яичников: обновленная информация. Fertil. Стерил. 70 , 1–15 (1998).
Артикул CAS Google Scholar
Persani, L., Rossetti, R. & Cacciatore, C. Гены, участвующие в преждевременной недостаточности яичников у человека. J. Mol. Эндокринол. 45 , 257–279 (2010).
Артикул CAS Google Scholar
Мацук М. и Лэмб Д. Дж. Биология бесплодия: достижения в исследованиях и клинические проблемы. Nat. Med. 14 , 1197–1213 (2008).
Артикул CAS PubMed PubMed Central Google Scholar
Бакалов В.К. и др. . Аутоиммунный оофорит как механизм фолликулярной дисфункции у женщин с 46, XX спонтанной преждевременной недостаточностью яичников. Fertil. Стерил. 84 , 958–965 (2005).
Артикул Google Scholar
Aittomäki, K. et al . Мутация в гене рецептора фолликулостимулирующего гормона вызывает наследственную гипергонадотропную недостаточность яичников. Cell 82 , 959–968 (1995).
Артикул PubMed PubMed Central Google Scholar
Латронико, А.С. и др. . Краткий отчет: устойчивость яичек и яичников к лютеинизирующему гормону, вызванная инактивирующими мутациями гена рецептора лютеинизирующего гормона. N. Engl. J. Med. 334 , 507–512 (1996).
Артикул CAS Google Scholar
Араки, С. и др. . Остановка развития фолликулов у пациента с дефицитом 17 альфа-гидроксилазы: фолликулогенез в сочетании с отсутствием синтеза эстрогена в яичниках. Fertil. Стерил. 47 , 169–172 (1987).
Артикул CAS Google Scholar
Conte, F. A., Grumbach, M. M., Ito, Y., Fisher, C. R. & Simpson, E. R. Синдром женского псевдогермафродизма, гипергонадотропного гипогонадизма и поликистозных яичников, связанных с миссенс-мутациями в гене, кодирующем ароматазу (P450) (P450). J. Clin. Эндокринол. Метаб. 78 , 1287–1292 (1994).
CAS PubMed Google Scholar
Нельсон, Л. М. и др. . Развитие лютеинизированных граафовых фолликулов у пациентов с нормальным кариотипом спонтанной преждевременной недостаточности яичников. J. Clin. Эндокринол. Метаб. 79 , 1470–1475 (1994).
CAS PubMed Google Scholar
Нельсон, Л. М., Ковингтон, С. Н.& Rebar, R. W. Обновленная информация: спонтанная преждевременная недостаточность яичников — это не ранняя менопауза. Fertil. Стерил. 83 , 1327–1332 (2005).
Артикул Google Scholar
Хубайтер, З. Р. и др. . Проспективная оценка функции антрального фолликула у женщин со спонтанной первичной недостаточностью яичников 46, XX лет. Fertil. Стерил. 94 , 1769–1774 (2010).
Артикул Google Scholar
Каримов, С.Б. и др. . Повышенная частота скрытой хрупкой Х-связанной первичной недостаточности яичников у бесплодных женщин с признаками нарушения функции яичников. Hum. Репрод. 26 , 2077–2083 (2011).
Артикул CAS Google Scholar
Госвами Д. и Конвей Г. С. Преждевременная недостаточность яичников. Hum. Репрод. Обновление 11 , 391–410 (2005).
Артикул CAS Google Scholar
Скиллерн, А.И Райкович, А. Последние разработки в области определения генетических детерминант преждевременной недостаточности яичников. Секс. Dev. 2 , 228–243 (2008).
Артикул CAS Google Scholar
Knauff, E. A. и др. . Полногеномное исследование ассоциации у пациенток с преждевременной недостаточностью яичников предполагает, что ADAMTS19 является возможным геном-кандидатом. Hum. Репрод. 24 , 2372–2378 (2009).
Артикул CAS Google Scholar
ван Дорен, М.Ф., Бертоли-Авеллаб, А. М. и Ольденбург, Р. А. Преждевременная недостаточность яичников и полиморфизмы генов. Curr. Opin. Акушерство. Гинеколь. 21 , 313–317 (2009).
Артикул Google Scholar
Ольденбург Р. А. и др. . Сканирование сцепления по всему геному в голландской семье выявляет локус предрасположенности к преждевременной недостаточности яичников. Hum. Репрод. 23 , 2835–2841 (2008).
Артикул CAS Google Scholar
Christin-Maitre, S.& Tachdjian, G. Исследование ассоциации всего генома и преждевременная недостаточность яичников. Ann. Эндокринол. (Париж) 71 , 218–221 (2010).
Артикул CAS Google Scholar
Бонди, К. А. Уход за девочками и женщинами с синдромом Тернера: руководство Исследовательской группы по синдрому Тернера. J. Clin. Эндокринол. Метаб. 92 , 10–25 (2007).
Артикул CAS Google Scholar
Saenger, P. и др. . Рекомендации по диагностике и лечению синдрома Тернера. J. Clin. Эндокринол. Метаб. 86 , 3061–3069 (2001).
CAS PubMed Google Scholar
Шерман С. Л. Преждевременная недостаточность яичников при синдроме ломкой Х-хромосомы. г. J. Med. Genet. 97 , 189–194 (2000).
Артикул CAS Google Scholar
Веркерк, А.Дж. и др. . Идентификация гена (FMR-1), содержащего повтор CGG, совпадающий с областью кластера контрольной точки, демонстрирующей вариацию длины при синдроме ломкой Х-хромосомы. Cell 65 , 905–914 (1991).
Артикул CAS Google Scholar
Fu, Y.H. и др. . Вариация CGG-повтора в хрупком Х-сайте приводит к генетической нестабильности: разрешению парадокса Шермана. Cell 67 , 1047–1058 (1991).
Артикул CAS Google Scholar
Allingham-Hawkins, D. J. et al. . Премутация ломкой Х-хромосомы является значительным фактором риска преждевременной недостаточности яичников: предварительные данные Международного совместного исследования POF in Fragile X. г. J. Med. Genet. 83 , 322–325 (1999).
Артикул CAS PubMed PubMed Central Google Scholar
Конвей, Г.С., Пейн, Н. Н., Уэбб, Дж., Мюррей, А. и Джейкобс, П. А. Предварительный скрининг ломкой Х-хромосомы у женщин с преждевременной недостаточностью яичников. Hum. Репрод. 13 , 1184–1187 (1998).
Артикул CAS Google Scholar
Conway, G. S., Kaltsas, G., Patel, A., Davies, M. C. & Jacobs, H. S. Характеристика идиопатической преждевременной недостаточности яичников. Fertil. Стерил. 65 , 337–341 (1996).
Артикул CAS Google Scholar
Новосад, Дж. А., Калантариду, С. Н., Тонг, З. Б. и Нельсон, Л. М. Антитела к яичникам, обнаруженные с помощью непрямой иммунофлуоресценции, ненадежны при диагностике аутоиммунной преждевременной недостаточности яичников: контролируемая оценка. BMC Womens Health 3 , 2 (2003).
Артикул PubMed PubMed Central Google Scholar
La Marca, A. и др. . Первичная недостаточность яичников: аутоиммунные причины. Curr. Opin. Акушерство. Гинеколь. 22 , 277–282 (2010).
PubMed Google Scholar
Gatta, G., Capocaccia, R., Coleman, M. P., Ries, L. A. & Berrino, F. Выживание рака в детстве в Европе и США. Рак 95 , 1767–1772 (2002).
Артикул Google Scholar
Гатта, Г. и др. . Тенденции выживаемости при детском раке в Европе: исследование рабочей группы EUROCARE. J. Clin. Онкол. 23 , 3742–3751 (2005).
Артикул Google Scholar
Эдгар, А. Б., Моррис, Э. М., Келнар, К. Дж. И Уоллес, У. Х. Долгосрочное наблюдение за выжившими после детского рака. Endocr. Dev. 15 , 159–180 (2009).
Артикул Google Scholar
Ванна, Л.Э., Уоллес, У. Х. и Кричли, Х. О. Поздние эффекты лечения детского рака на женскую репродуктивную систему и возможность сохранения фертильности. BJOG 109 , 107–114 (2002).
Артикул Google Scholar
van Dorp, W. и др. . Долгосрочные эндокринные побочные эффекты лечения детской лимфомы Ходжкина: обзор. Hum. Репрод. Обновление http: // dx.doi.org/10.1093/humupd/dmr038.
Брум, М. Ф. и Уоллес, У. Х. Субфертильность у детей и молодых людей, лечившихся от солидных и гематологических злокачественных новообразований. руб. J. Haematol. 131 , 143–155 (2005).
PubMed Google Scholar
Shelling, A. N. Преждевременная недостаточность яичников. Репродукция 140 , 633–641 (2010).
Артикул CAS Google Scholar
Josso, N. и др. . Антимюллеров гормон: фактор Йоста. Последние прог. Horm. Res. 48 , 1–59 (1993).
CAS PubMed Google Scholar
Ли, М. М. и Донахью, П. К. Мюллерово ингибирующее вещество: гонадный гормон с множеством функций. Endocr. Ред. 14 , 152–164 (1993).
CAS PubMed Google Scholar
Josso, N., Пикард, Дж. Ю. и Тран, Д. Антимюллеров гормон. Врожденные дефекты Ориг. Artic. Сер. 13 , 59–84 (1977).
CAS PubMed Google Scholar
Дурлингер, А. Л., Виссер, Дж. А. и Теммен, А. П. Регуляция функции яичников: роль антимюллерова гормона. Репродукция 124 , 601–609 (2002).
Артикул CAS Google Scholar
Райперт-Де Мейтс, Э. и др. . Экспрессия антимюллерова гормона во время нормального и патологического развития гонад: связь с дифференцировкой клеток Сертоли и гранулезы. J. Clin. Эндокринол. Метаб. 84 , 3836–3844 (1999).
PubMed Google Scholar
Weenen, C. и др. . Паттерн экспрессии анти-Мюллерова гормона в яичниках человека: потенциальные последствия для начального и циклического набора фолликулов. Мол. Гм. Репрод. 10 , 77–83 (2004).
Артикул CAS Google Scholar
Ши, Дж. и др. . Костный морфогенетический белок-6 стимулирует экспрессию гена рецептора фолликулостимулирующего гормона, бета-субъединиц ингибина / активина и антимюллерова гормона в клетках гранулезы человека. Fertil. Стерил. 92 , 1794–1798 (2009).
Артикул Google Scholar
Лосось, Н.А., Хэндисайд, А. Х. и Джойс, И. М. Ооциты, регулирующие экспрессию антимюллерова гормона в клетках гранулезы во время развития фолликулов яичников у мышей. Dev. Биол. 266 , 201–208 (2004).
Артикул CAS Google Scholar
Grøndahl, M. L. и др. . Антимюллеров гормон остается высоко экспрессируемым в кумулюсных клетках человека на заключительных стадиях фолликулогенеза. Репродукция.Биомед. Интернет: 22 , 389–398 (2011).
Артикул CAS Google Scholar
Макги, Э. А. и Сюэ, А. Дж. Начальное и циклическое привлечение фолликулов яичников. Endocr. Ред. 21 , 200–214 (2000).
CAS PubMed Google Scholar
Durlinger, A. L. L. и др. . Контроль за рекрутированием примордиальных фолликулов антимюллеровым гормоном в яичнике мышей. Эндокринология 140 , 5789–5796 (1999).
Артикул CAS PubMed Google Scholar
Карлссон И. Б. и др. . Антимюллеров гормон подавляет начало роста первичных фолликулов яичников человека in vitro . Hum. Репрод. 21 , 2223–2227 (2006).
Артикул CAS Google Scholar
Дурлингер, А.Л. Л. и др. . Антимюллеров гормон подавляет начало роста примордиальных фолликулов в яичнике мыши. Эндокринология 143 , 1076–1084 (2002).
Артикул CAS Google Scholar
Gigli, I., Cushman, R.A., Wahl, C.M. & Fortune, J.E. Доказательства роли антимюллерова гормона в подавлении активации фолликулов в яичниках мышей и коре яичников крупного рогатого скота, трансплантированных под хориоаллантоисную мембрану цыплят. Мол. Репрод. Dev. 71 , 480–488 (2005).
Артикул CAS Google Scholar
Кевенаар М.Э. и др. . Полиморфизм гена рецептора AMH типа II связан с возрастом наступления менопаузы во взаимодействии с паритетом. Hum. Репрод. 22 , 2382–2388 (2007).
Артикул CAS Google Scholar
Дурлингер, А.Л. Л. и др. . Антимюллеров гормон ослабляет действие ФСГ на развитие фолликулов в яичнике мыши. Эндокринология 142 , 4891–4899 (2001).
Артикул CAS Google Scholar
Visser, J. A. et al. . Повышенная дегенерация ооцитов и атрезия фолликулов во время эстрального цикла у мышей, у которых отсутствует антимюллеров гормон. Эндокринология 148 , 2301–2308 (2007).
Артикул CAS PubMed Google Scholar
ди Клементе, Н. и др. . Ингибирующее действие АМГ на экспрессию рецепторов ароматазы и ЛГ гранулезных клеток незрелых яичников крыс и свиней. Эндокринная 2 , 553–558 (1994).
CAS Google Scholar
Гроссман, М. П., Накадзима, С. Т., Фаллат, М.E. & Siow, Y. Вещество, ингибирующее Мюллериан, подавляет активность ароматазы цитохрома P450 в культуре клеток гранулезно-лютеина человека. Fertil. Стерил. 89 , 1364–1370 (2008).
Артикул CAS Google Scholar
Андерсен, К. Ю. и Бысков, А. Г. Эстрадиол и регуляция секреции антимюллерова гормона, ингибина-A и ингибина-B: анализ жидкости малых антральных и преовуляторных фолликулов человека. J. Clin. Эндокринол. Метаб. 91 , 4064–4069 (2006).
Артикул CAS Google Scholar
Кевенаар М.Э. и др. . Полиморфизм рецепторов анти-мюллерова гормона и антимюллерова гормона II типа связан с уровнями эстрадиола в фолликулярной фазе у нормоовуляторных женщин. Hum. Репрод. 22 , 1547–1554 (2007).
Артикул CAS Google Scholar
te Velde, E.Р., Шеффер, Г. Дж., Дорланд, М., Брукманс, Ф. Дж. И Фаузер, Б. С. Эндокринные и развивающие аспекты нормального старения яичников. Мол. Клетка. Эндокринол. 145 , 67–73 (1998).
Артикул CAS Google Scholar
Scheffer, G.J. и др. . Подсчет антральных фолликулов при трансвагинальном ультразвуковом исследовании зависит от возраста у женщин с доказанной естественной фертильностью. Fertil. Стерил. 72 , 845–851 (1999).
Артикул CAS Google Scholar
Bergada, I. et al. . Динамика всплеска сывороточного гонадотропина, ингибинов и антимюллерова гормона у здоровых новорожденных мужчин в течение первого месяца жизни. J. Clin. Эндокринол. Метаб. 91 , 4092–4098 (2006).
Артикул CAS Google Scholar
Гибурденш, Ж. и др. . Уровни анти-мюллерова гормона в сыворотке плодов и детей человека: образец и клинический интерес. Мол. Клетка. Эндокринол. 211 , 55–63 (2003).
Артикул CAS Google Scholar
Хаген, К. П. и др. . Уровни антимюллерова гормона в сыворотке как маркер функции яичников у 926 здоровых женщин от рождения до зрелого возраста и у 172 пациентов с синдромом Тернера. J. Clin. Эндокринол. Метаб. 95 , 5003–5010 (2010).
Артикул CAS Google Scholar
Ли М. М. и др. . Вещество, ингибирующее мюллериан, у человека: нормальные уровни от младенчества до взрослого возраста. J. Clin. Эндокринол. Метаб. 81 , 571–576 (1996).
CAS PubMed Google Scholar
van Rooij, I.А. и др. . Антимюллеров гормон является многообещающим предиктором наступления менопаузального перехода. Менопауза 11 , 601–606 (2004).
Артикул Google Scholar
van Rooij, I. A. et al. . Уровни антимуллерных гормонов в сыворотке лучше всего отражают снижение репродуктивной функции с возрастом у здоровых женщин с доказанной фертильностью: продольное исследование. Fertil. Стерил. 83 , 979–987 (2005).
Артикул CAS Google Scholar
де Вет, А., Лавен, Дж. С., де Йонг, Ф. Х., Теммен, А. П. Н. и Фаузер, Б. С. Уровни антимюллерова гормона в сыворотке: предполагаемый маркер старения яичников. Fertil. Стерил. 77 , 357–362 (2002).
Артикул Google Scholar
Fanchin, R. и др. . Сывороточный антимюллеров гормон в большей степени связан с фолликулярным статусом яичников, чем сывороточный ингибин B, эстрадиол, ФСГ и ЛГ на 3-й день. Hum. Репрод. 18 , 323–327 (2003).
Артикул CAS Google Scholar
ван Рой, И. А. и др. . Уровни антимюллерова гормона в сыворотке: новый показатель резерва яичников. Hum. Репрод. 17 , 3065–3071 (2002).
Артикул CAS Google Scholar
Хансен, К. Р., Ходнетт, Г. М., Ноултон, Н. и Крейг, Л. Б. Корреляция тестов яичникового резерва с гистологически определенным числом примордиальных фолликулов. Fertil. Стерил. 95 , 170–175 (2011).
Артикул Google Scholar
Кевенаар М.Э. и др. . Уровни антимюллерова гормона в сыворотке крови отражают размер пула примордиальных фолликулов у мышей. Эндокринология 147 , 3228–3234 (2006).
Артикул CAS Google Scholar
Сейфер, Д.Б., Бейкер, В. Л. и Лидер, Б. Возрастные значения антимюллерова гормона в сыворотке крови у 17 120 женщин, обращающихся в центры репродуктивной медицины в США. Fertil. Стерил. 95 , 747–750 (2011).
Артикул CAS Google Scholar
Келси, Т. В., Райт, П., Нельсон, С. М., Андерсон, Р. А. и Уоллес, В. Х. Проверенная модель сывороточного антимюллерова гормона от зачатия до менопаузы. PLoS ONE 6 , e22024 (2011).
Артикул CAS PubMed PubMed Central Google Scholar
Нельсон С. М. и др. . Внешнее подтверждение номограммы снижения уровня антимюллерова гормона в сыворотке крови у женщин: популяционное исследование с участием 15 834 пациенток с бесплодием. Репродукция. Биомед. Интернет: 23 , 204–206 (2011).
Артикул Google Scholar
Hehenkamp, W.Дж. и др. . Уровни антимюллерова гормона в спонтанном менструальном цикле не подвержены значительным колебаниям. J. Clin. Эндокринол. Метаб. 91 , 4057–4063 (2006).
Артикул CAS Google Scholar
La Marca, A., Stabile, G., Artenisio, A.C. & Volpe, A. Сывороточный антимюллеров гормон на протяжении менструального цикла человека. Hum. Репрод. 21 , 3103–3107 (2006).
Артикул CAS Google Scholar
Streuli, I. et al. . Уровни антимуллеровых гормонов в сыворотке остаются стабильными на протяжении всего менструального цикла и после перорального или вагинального введения синтетических половых стероидов. Fertil. Стерил. 90 , 395–400 (2008).
Артикул CAS Google Scholar
Tsepelidis, S. et al .Стабильные уровни антимюллерова гормона в сыворотке крови во время менструального цикла: проспективное исследование у женщин с нормоовуляцией. Hum. Репрод. 22 , 1837–1840 (2007).
Артикул CAS Google Scholar
Робертсон, Д. М., Хейл, Г. Э., Фрейзер, И. С., Хьюз, К. Л. и Бургер, Х. Г. Изменения уровней антимюллерова гормона в сыворотке крови во время овуляторного менструального цикла в позднем репродуктивном возрасте. Менопауза 18 , 521–524 (2011).
Артикул Google Scholar
Сауэрс, М. и др. . Изменчивость антимюллерова гормона и ингибина B во время нормальных менструальных циклов. Fertil. Стерил. 94 , 1482–1486 (2010).
Артикул CAS Google Scholar
Streuli, I. et al. . Клиническое использование тестов на антимюллеровы гормоны: подводные камни и перспективы. Fertil. Стерил. 91 , 226–230 (2009).
Артикул CAS Google Scholar
Вундер, Д. М., Берсингер, Н. А., Яред, М., Кречмер, Р. и Биркхойзер, М. Х. Статистически значимые изменения уровней антимюллерова гормона и ингибина во время физиологического менструального цикла у женщин репродуктивного возраста. Fertil. Стерил. 89 , 927–933 (2008).
Артикул CAS Google Scholar
Фанчин, Р. и др. . Высокая воспроизводимость результатов измерения антимюллерова гормона в сыворотке предполагает многоэтапную фолликулярную секрецию и усиливает ее роль в оценке состояния фолликулов яичников. Hum. Репрод. 20 , 923–927 (2005).
Артикул CAS Google Scholar
Сауэрс, М. Р. и др. . Антимюллеров гормон и ингибин B в определении старения яичников и перехода к менопаузе. J. Clin. Эндокринол. Метаб. 93 , 3478–3483 (2008).
Артикул CAS PubMed PubMed Central Google Scholar
ван Дисселдорп, Дж. и др. . Связь концентрации антимюллерова гормона в сыворотке крови с возрастом в период менопаузы. J. Clin. Эндокринол. Метаб. 93 , 2129–2134 (2008).
Артикул CAS Google Scholar
Broer, S.Л. и др. . Антимюллеров гормон предсказывает менопаузу: долгосрочное катамнестическое исследование с участием нормоовуляторных женщин. J. Clin. Эндокринол. Метаб. 96 , 2532–2539 (2011).
Артикул CAS Google Scholar
Тегерани, Ф. Р., Шакери, Н., Солаймани-Додаран, М. и Азизи, Ф. Прогнозирование возраста наступления менопаузы по концентрации антимюллерова гормона в сыворотке. Менопауза 18 , 766–770 (2011).
Артикул Google Scholar
Тегерани, Ф. Р., Солаймани-Додаран, М. и Азизи, Ф. Единственный тест на антимуллерный гормон у женщин позднего репродуктивного возраста является хорошим предиктором менопаузы. Менопауза 16 , 797–802 (2009).
Артикул Google Scholar
Хендрикс, Д. Дж., Мол, Б. В., Банси, Л. Ф., Те Велде, Э. Р. и Брукманс, Ф.J. Подсчет антральных фолликулов в прогнозе плохой реакции яичников и беременности после экстракорпорального оплодотворения: метаанализ и сравнение с базальным уровнем фолликулостимулирующего гормона. Fertil. Стерил. 83 , 291–301 (2005).
Артикул Google Scholar
Сейфер, Д. Б., Маклафлин, Д. Т., Кристиан, Б. П., Фенг, Б. и Шелден, Р. М. Ранние уровни вещества, ингибирующего мюллериан в фолликулярной сыворотке, связаны с реакцией яичников во время циклов вспомогательных репродуктивных технологий. Fertil. Стерил. 77 , 468–471 (2002).
Артикул Google Scholar
Ла Марка, А. и др. . Измерение уровня анти-мюллерова гормона в любой день менструального цикла надежно предсказывает реакцию яичников на вспомогательные репродуктивные технологии. Hum. Репрод. 22 , 766–771 (2007).
Артикул CAS Google Scholar
Нельсон, С.М., Йейтс, Р. У. и Флеминг, Р. Сывороточный антимюллеров гормон и ФСГ: прогнозирование живорождения и экстремальные реакции в стимулированных циклах — значение для индивидуализации терапии. Hum. Репрод. 22 , 2414–2421 (2007).
Артикул CAS Google Scholar
Нельсон С. М. и др. . Подход к контролируемой стимуляции яичников для вспомогательного зачатия, основанный на антимюллеровских гормонах. Hum. Репрод. 24 , 867–875 (2009).
Артикул CAS Google Scholar
Broer, S. L. и др. . AMH и AFC как предикторы чрезмерного ответа при контролируемой гиперстимуляции яичников: метаанализ. Hum. Репрод. Обновление 17 , 46–54 (2011).
Артикул CAS Google Scholar
Broer, S.Л., Мол, Б., Доллеман, М., Фаузер, Б. С. и Брукманс, Ф. Дж. Роль оценки антимюллерова гормона в результатах вспомогательных репродуктивных технологий. Curr. Opin. Акушерство. Гинеколь. 22 , 193–201 (2010).
Артикул Google Scholar
Broer, S. L., Mol, B. W., Hendriks, D. & Broekmans, F. J. Роль антимюллерова гормона в прогнозировании исхода после ЭКО: сравнение с количеством антральных фолликулов. Fertil. Стерил. 91 , 705–714 (2009).
Артикул CAS Google Scholar
Фадини Р. и др. . Антимюллеров гормон как прогностический маркер для отбора женщин для лечения созревания ооцитов in vitro. J. Assist. Репрод. Genet. 28 , 501–508 (2011).
Артикул PubMed PubMed Central Google Scholar
Gnoth, C. и др. . Актуальность измерения антимюллерова гормона в рутинной программе ЭКО. Hum. Репрод. 23 , 1359–1365 (2008).
Артикул CAS Google Scholar
Ли Фонг, С. и др. . Антимюллеров гормон: маркер количества ооцитов, качества ооцитов и качества эмбрионов? Репродукция. Биомед. Интернет: 16 , 664–670 (2008).
Артикул CAS Google Scholar
Сминк, Дж.М. и др. . Антимюллеровый гормон предсказывает реакцию яичников, но не качество эмбриона или беременность после экстракорпорального оплодотворения или интрациоплазматической инъекции сперматозоидов. Fertil. Стерил. 87 , 223–226 (2007).
Артикул CAS Google Scholar
Ла Марка, А. и др. . Уровни антимюллерова гормона в сыворотке крови у женщин с вторичной аменореей. Fertil. Стерил. 85 , 1547–1549 (2006).
Артикул CAS Google Scholar
Méduri, G. et al. . Экспрессия антимюллерова гормона в сыворотке у женщин с преждевременной недостаточностью яичников. Hum. Репрод. 22 , 117–123 (2007).
Артикул CAS Google Scholar
Бачелот, А. и др. . Фенотипирование и генетические исследования 357 последовательных пациенток с преждевременной недостаточностью яичников. Eur. J. Endocrinol. 161 , 179–187 (2009).
Артикул CAS Google Scholar
Knauff, E. A. и др. . Антимюллеров гормон, ингибин B и количество антральных фолликулов у молодых женщин с недостаточностью яичников. J. Clin. Эндокринол. Метаб. 94 , 786–792 (2009).
Артикул CAS Google Scholar
Салливан, А.К. и др. . Связь размера повтора FMR1 с дисфункцией яичников. Hum. Репрод. 20 , 402–412 (2005).
Артикул CAS Google Scholar
Рор, Дж. и др. . Антимюллеров гормон указывает на раннее снижение функции яичников у носителей премутации с ломкой X-умственной отсталостью (FMR1): предварительное исследование. Hum. Репрод. 23 , 1220–1225 (2008).
Артикул CAS Google Scholar
Spath, M.А. и др. . Внутрииндивидуальная стабильность во времени стандартизированного антимюллерова гормона у носителей премутации FMR1. Hum. Репрод. 26 , 2185–2191 (2011).
Артикул CAS PubMed PubMed Central Google Scholar
Глейхер, Н., Вегхофер, А., Октай, К. и Барад, Д. Х. Корреляция тройных повторов в гене FMR1 (ломкий X) с резервом яичников: новый тест на бесплодие? Acta Obstet.Гинеколь. Сканд. 88 , 1024–1030 (2009).
Артикул CAS Google Scholar
Gleicher, N., Weghofer, A., Oktay, K. & Barad, D. Релевантность тройных повторов CGG в гене FMR1 для яичникового резерва. Репродукция. Биомед. Интернет: 19 , 385–390 (2009).
Артикул CAS Google Scholar
Глейхер, Н., Weghofer, A. & Barad, D.H. Пилотное исследование преждевременного старения яичников: I. Корреляция тройных повторов CGG в гене FMR1 с параметрами яичникового резерва ФСГ и антимюллерова гормона. Fertil. Стерил. 91 , 1700–1706 (2009).
Артикул CAS Google Scholar
Беннет, К. Э., Конвей, Г. С., Макферсон, Дж. Н., Джейкобс, П. А. и Мюррей, А. Повторы CGG среднего размера не являются частой причиной идиопатической преждевременной недостаточности яичников. Hum. Репрод. 25 , 1335–1338 (2010).
Артикул CAS PubMed PubMed Central Google Scholar
Абир Р. и др. . Синдром Тернера и фертильность: текущее состояние и возможные предполагаемые перспективы. Hum. Репрод. Обновление 7 , 603–610 (2001).
Артикул CAS Google Scholar
Тониоло, Д.& Rizzolio, F. X хромосома и яичниковая недостаточность. Семин. Репрод. Med. 25 , 264–271 (2007).
Артикул CAS Google Scholar
Borgström, B. и др. . Сохранение фертильности у девочек с синдромом Тернера: прогностические признаки наличия фолликулов яичников. J. Clin. Эндокринол. Метаб. 94 , 74–80 (2009).
Артикул CAS Google Scholar
Пурушотаман, Р., Лазарева, О., Октай, К., Тен, С. Маркеры овариального резерва у молодых девушек с синдромом Тернера. Fertil. Стерил. 94 , 1557–1559 (2010).
Артикул Google Scholar
Цигкоу А. и др. . Высокая концентрация ингибина в сыворотке отличает аутоиммунный оофорит от других форм первичной недостаточности яичников. J. Clin. Эндокринол. Метаб. 93 , 1263–1269 (2008).
Артикул CAS Google Scholar
Ла Марка, А. и др. . Первичная недостаточность яичников из-за аутоиммунитета стероидогенных клеток связана с сохранением пула функционирующих фолликулов. J. Clin. Эндокринол. Метаб. 94 , 3816–3823 (2009).
Артикул CAS Google Scholar
Глейхер Н., Вегхофер А.И Барад, Д. Х. Пилотное исследование преждевременного старения яичников: II. Различный генотип и фенотип по генетической и аутоиммунной этиологии. Fertil. Стерил. 91 , 1707–1711 (2009).
Артикул CAS Google Scholar
Клоуз, М. Э. и др. . Сохранение яичников агонистами ГнРГ во время химиотерапии: метаанализ. J. Womens Health 18 , 311–319 (2009).
Артикул Google Scholar
Nitzschke, M. и др. . Аналоги ГнРГ не защищают яичники от ультраструктурных повреждений, вызванных химиотерапией, у пациентов с лимфомой Ходжкина. Arch. Гинеколь. Акушерство. 282 , 83–88 (2010).
Артикул CAS Google Scholar
Санчес-Серрано, М. и др. . Близнецы, рожденные после трансплантации корковой ткани яичников и витрификации ооцитов. Fertil. Стерил. 93 , 268.e11–268.e13 (2010).
Артикул Google Scholar
Мейроу Д. и др. . Мониторинг яичников после аутотрансплантации криоконсервированной ткани яичника: эндокринные исследования, циклы экстракорпорального оплодотворения и живорождение. Fertil. Стерил. 87 , 418.e7–418.e15 (2007).
Артикул Google Scholar
Янсе, Ф. и др. . Ограниченное значение маркеров функции яичников после ортотопической трансплантации ткани яичников после лечения гонадотоксиками. J. Clin. Эндокринол. Метаб. 96 , 1136–1144 (2011).
Артикул CAS Google Scholar
Шмидт, К. Т. и др. . Аутотрансплантация криоконсервированной ткани яичника у 12 женщин с преждевременной недостаточностью яичников, вызванной химиотерапией: опыт Дании. Fertil. Стерил. 95 , 695–701 (2011).
Артикул Google Scholar
Ли Фонг, С. и др. . Оценка овариального резерва у взрослых выживших после рака в детском возрасте с использованием антимюллерова гормона. Hum. Репрод. 24 , 982–990 (2009).
Артикул CAS Google Scholar
Rosendahl, M. и др. .Функция яичников после удаления всего яичника для криоконсервации кусочков коры головного мозга перед гонадотоксическим лечением: последующее исследование. Hum. Репрод. 23 , 2475–2483 (2008).
Артикул Google Scholar
van Beek, R.D. и др. . Антимюллеров гормон является чувствительным сывороточным маркером функции гонад у женщин, лечившихся от лимфомы Ходжкина в детстве. J. Clin. Эндокринол.Метаб. 92 , 3869–3874 (2007).
Артикул CAS Google Scholar
Bath, LE, Wallace, WH, Shaw, MP, Fitzpatrick, C. & Anderson, RA Истощение овариального резерва у молодых женщин после лечения рака в детстве: обнаружение с помощью антимюллерова гормона, ингибина B и яичников ультразвук. Hum. Репрод. 18 , 2368–2374 (2003).
Артикул CAS Google Scholar
Ли Фонг, С. и др. . Антимюллеров гормон как маркер функции яичников у женщин после химиотерапии и лучевой терапии злокачественных гематологических заболеваний. Hum. Репрод. 23 , 674–678 (2008).
Артикул CAS Google Scholar
Су, Х. И. и др. . Антимуллеровый гормон и ингибин B являются гормональными показателями функции яичников у лиц, переживших рак груди в позднем репродуктивном возрасте. Рак 116 , 592–599 (2010).
Артикул CAS PubMed PubMed Central Google Scholar
Партридж, А. Х. и др. . Резерв яичников у женщин, которые остаются в пременопаузе после химиотерапии рака груди на ранней стадии. Fertil. Стерил. 94 , 638–644 (2010).
Артикул Google Scholar
Lutchman Singh, K. et al. .Предикторы овариального резерва у молодых женщин с раком груди. руб. J. Cancer 96 , 1808–1816 (2007).
Артикул CAS PubMed PubMed Central Google Scholar
Андерсон, Р. А., Теммен, А. П., Аль-Катани, А., Грум, Н. П. и Кэмерон, Д. А. Влияние химиотерапии и длительного подавления гонадотропинов на яичниковый резерв у женщин в пременопаузе с раком груди. Hum.Репрод. 21 , 2583–2592 (2006).
Артикул CAS Google Scholar
Ю. Б. и др. . Изменения маркеров резерва яичников и эндокринной функции у молодых женщин с раком груди, проходящих адъювантную химиотерапию. Рак 116 , 2099–2105 (2010).
CAS PubMed PubMed Central Google Scholar
Rosendahl, M. и др. . Динамика и механизмы индуцированного химиотерапией фолликулярного истощения яичников у женщин фертильного возраста. Fertil. Стерил. 94 , 156–166 (2010).
Артикул CAS Google Scholar
Андерс К. и др. . Пилотное исследование прогностических маркеров аменореи, связанной с химиотерапией, среди женщин в пременопаузе с раком груди на ранней стадии. Рак Инвест. 26 , 286–295 (2008).
Артикул CAS PubMed PubMed Central Google Scholar
Андерсон, Р. А. и Камерон, Д. А. Сывороточный антимюллеров гормон до лечения позволяет прогнозировать долгосрочную функцию яичников и массу костной ткани после химиотерапии при раннем раке груди. J. Clin. Эндокринол. Метаб. 96 , 1336–1343 (2011).
Артикул CAS Google Scholar
Кайпиа, А.& Hsueh, A. J. Регулирование атрезии фолликула яичника. Annu. Rev. Physiol. 59 , 349–363 (1997).
Артикул CAS Google Scholar
Massagué, J. Передача сигнала TGF-β. Annu. Rev. Biochem. 67 , 753–791 (1998).
Артикул Google Scholar
Massagué, J. & Wotton, D. Контроль транскрипции с помощью системы передачи сигналов TGF-бета / Smad. Embo. J. 19 , 1745–1754 (2000).
Артикул PubMed PubMed Central Google Scholar
Visser, J. A. Передача сигналов AMH: от рецептора к гену-мишени. Мол. Клетка. Эндокринол. 211 , 65–73 (2003).
Артикул CAS Google Scholar
Эриксон, Г. Ф. и Шимасаки, С. Пространственно-временной паттерн экспрессии семейства костных морфогенетических белков в типах клеток яичников крыс во время эстрального цикла. Репродукция. Биол. Эндокринол. 1 , 9 (2003).
Артикул PubMed PubMed Central Google Scholar
Уровни тестостерона в сыворотке положительно связаны с уровнями сывороточного антимюллерова гормона у бесплодных женщин
Dewailly, D. et al. Физиология и клиническое применение антимюллеровского гормона у женщин. Hum. Репрод. Обновление 20 , 370–385. https: // doi.org / 10.1093 / humupd / dmt062 (2014).
Артикул PubMed Google Scholar
Jeppesen, J. V. et al. Какие фолликулы вырабатывают у человека больше всего антимюллеровского гормона? Доказательства резкого снижения выработки АМГ во время отбора фолликулов. Мол. Гм. Репрод. 19 , 519–527. https://doi.org/10.1093/molehr/gat024 (2013).
CAS Статья PubMed Google Scholar
Moolhuijsen, L. M. E. & Visser, J. A. Антимюллеров гормон и резерв яичников: обновленная информация об оценке функции яичников. J. Clin. Эндокринол. Метаб. https://doi.org/10.1210/clinem/dgaa513 (2020).
Артикул PubMed PubMed Central Google Scholar
Келси, Т. В., Райт, П., Нельсон, С. М., Андерсон, Р. А. и Уоллес, В. Х. Проверенная модель сывороточного антимюллерова гормона от зачатия до менопаузы. PLoS ONE 6 , e22024. https://doi.org/10.1371/journal.pone.0022024 (2011).
ADS CAS Статья PubMed PubMed Central Google Scholar
Ли Фонг, С. et al. Уровни антимюллерова гормона в сыворотке у здоровых женщин: номограмма от младенчества до взрослого возраста. J. Clin. Эндокринол. Метаб. 97 , 4650–4655. https://doi.org/10.1210/jc.2012-1440 (2012).
CAS Статья PubMed PubMed Central Google Scholar
Broer, S. L. et al. Прогнозирование чрезмерного ответа при экстракорпоральном оплодотворении на основе характеристик пациенток и тестов яичникового резерва и сравнение в подгруппах: метаанализ индивидуальных данных пациента. Fertil. Стерил. 100 , 420-429.e427. https://doi.org/10.1016/j.fertnstert.2013.04.024 (2013).
Артикул PubMed Google Scholar
Broer, S. L. et al. Дополнительная ценность тестирования овариального резерва на характеристиках пациенток при прогнозировании реакции яичников и продолжающейся беременности: индивидуальный подход к данным пациента. Hum. Репрод. Обновление 19 , 26–36. https://doi.org/10.1093/humupd/dms041 (2013).
Артикул PubMed Google Scholar
Lensen, S. F. et al. Индивидуальный подбор дозы гонадотропина с использованием маркеров овариального резерва для женщин, подвергшихся экстракорпоральному оплодотворению плюс интрацитоплазматическая инъекция сперматозоидов (ЭКО / ИКСИ). Кокрановская база данных Syst. Ред. 2 , 2693. https://doi.org/10.1002/14651858.CD012693.pub2 (2018).
Артикул Google Scholar
Friis Petersen, J. et al. Рандомизированное контролируемое исследование индивидуализированного дозирования ФСГ на основе АМГ в протоколе антагонистов ГнРГ для ЭКО. Hum. Репрод. Открыть 2019 , 3. https://doi.org/10.1093/hropen/hoz003 (2019).
Артикул Google Scholar
Уолтерс, К. А. и Хандельсман, Д. Дж. Роль андрогенов в яичнике. Мол. Клетка. Эндокринол. 465 , 36–47. https://doi.org/10.1016/j.mce.2017.06.026 (2018).
CAS Статья PubMed Google Scholar
Астапова О., Минор Б. М., Хэммс С. Р. Физиологическое и патологическое действие андрогенов на яичник. Эндокринология 160 , 1166–1174. https: // doi.org / 10.1210 / en.2019-00101 (2019).
CAS Статья PubMed PubMed Central Google Scholar
Дэвисон С.Л. и Дэвис С.Р. Андрогены у женщин. J. Steroid Biochem. Мол. Биол. 85 , 363–366. https://doi.org/10.1016/s0960-0760(03)00204-8 (2003).
CAS Статья PubMed Google Scholar
Hillier, S.Г., Тецука, М. и Фрейзер, Х. М. Расположение и регуляция развития андрогенных рецепторов в яичниках приматов. Hum. Репрод. 12 , 107–111. https://doi.org/10.1093/humrep/12.1.107 (1997).
CAS Статья PubMed Google Scholar
Дэвисон, С. Л., Белл, Р., Донат, С., Монтальто, Дж. Г. и Дэвис, С. Р. Уровни андрогенов у взрослых женщин: изменения с возрастом, менопаузой и овариэктомией. Дж.Clin. Эндокринол. Метаб. 90 , 3847–3853. https://doi.org/10.1210/jc.2005-0212 (2005).
CAS Статья PubMed Google Scholar
Kim, C.H. et al. Особенности яичников после 2 недель, 3 недель и 4 недель лечения трансдермальным гелем тестостерона и их влияние на исходы ЭКО у пациентов с плохим ответом. Dev. Репрод. 18 , 145–152. https://doi.org/10.12717/dr.2014.18.3.145 (2014).
Артикул PubMed PubMed Central Google Scholar
Ким, К. Х., Хоулз, К. М. и Ли, Х. А. Влияние предварительной обработки трансдермальным гелем тестостерона на контролируемую стимуляцию яичников и исход ЭКО у пациентов с низким ответом. Fertil. Стерил. 95 , 679–683. https://doi.org/10.1016/j.fertnstert.2010.07.1077 (2011).
CAS Статья PubMed Google Scholar
Парк, К. Х. и Чун, С. Влияние комбинированных оральных контрацептивов на параметры, связанные с морфологией поликистозных яичников, у корейских женщин с синдромом поликистозных яичников. Акушерство. Гинеколь. Sci. 63 , 80–86. https://doi.org/10.5468/ogs.2020.63.1.80 (2020).
Артикул PubMed Google Scholar
Plouvier, P. et al. Является ли подавляющий эффект ципротерона ацетата на сывороточные уровни антимюллерова гормона у женщин с синдромом поликистозных яичников сильнее, чем при приеме оральных противозачаточных таблеток ?. Gynecol. Эндокринол. 32 , 612–616. https://doi.org/10.3109/0
90.2016.1145647 (2016).
CAS Статья PubMed Google Scholar
Вендола, К. А., Чжоу, Дж., Адесанья, О. О., Вейл, С. Дж. И Бонди, С. А. Андрогены стимулируют ранние стадии роста фолликулов в яичниках приматов. J. Clin. Вкладывать деньги. 101 , 2622–2629. https://doi.org/10.1172/jci2081 (1998).
CAS Статья PubMed PubMed Central Google Scholar
Sen, A. et al. Андрогены регулируют развитие фолликулов яичников, увеличивая экспрессию рецепторов фолликулостимулирующего гормона и микроРНК-125b. Proc. Natl. Акад. Sci. США 111 , 3008–3013. https://doi.org/10.1073/pnas.1318978111 (2014).
ADS CAS Статья PubMed PubMed Central Google Scholar
Laird, M. et al. Андроген стимулирует рост преантральных фолликулов мыши in vitro: взаимодействие с фолликулостимулирующим гормоном и факторами роста суперсемейства TGFβ. Эндокринология 158 , 920–935. https://doi.org/10.1210/en.2016-1538 (2017).
CAS Статья PubMed PubMed Central Google Scholar
Hickey, T. E. et al. Андрогены усиливают митогенные эффекты факторов, секретируемых ооцитами, и фактора дифференцировки роста 9 на клетки гранулезы свиней. Biol. Репрод. 73 , 825–832. https://doi.org/10.1095/biolreprod.104.039362 (2005).
CAS Статья PubMed Google Scholar
Wu, Y. G., Bennett, J., Talla, D. & Stocco, C. Тестостерон, а не 5α-дигидротестостерон, стимулирует LRH-1, что приводит к независимой от ФСГ экспрессии Cyp19 и P450scc в клетках гранулезы. Мол. Эндокринол. 25 , 656–668. https://doi.org/10.1210/me.2010-0367 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Yang, J. L. et al. Тестостерон вызывает перераспределение вилочного бокса-3a и подавление экспрессии мессенджера фактора 9 роста и дифференцировки рибонуклеиновой кислоты на ранней стадии фолликулогенеза у мышей. Эндокринология 151 , 774–782. https://doi.org/10.1210/en.2009-0751 (2010).
CAS Статья PubMed Google Scholar
Vendola, K. et al. Андрогены способствуют экспрессии инсулиноподобного фактора роста I в ооцитах и инициации развития фолликулов в яичниках приматов. Biol. Репрод. 61 , 353–357. https://doi.org/10.1095/biolreprod61.2.353 (1999).
CAS Статья PubMed Google Scholar
Gleicher, N. et al. Гипоандрогения в связи со снижением функционального резерва яичников. Hum. Репрод. 28 , 1084–1091. https://doi.org/10.1093/humrep/det033 (2013).
CAS Статья PubMed Google Scholar
Fuentes, A. et al. Профиль андрогенов в сыворотке крови и фолликулярной жидкости женщин с плохой реакцией яичников во время контролируемой стимуляции яичников выявляет различия между группами стратификации POSEIDON: пилотное исследование. Фронт. Эндокринол. 10 , 458. https://doi.org/10.3389/fendo.2019.00458 (2019).
Артикул Google Scholar
Mannerås, L. et al. Новая модель на крысах, демонстрирующая как яичниковые, так и метаболические характеристики синдрома поликистозных яичников. Эндокринология 148 , 3781–3791. https://doi.org/10.1210/en.2007-0168 (2007).
CAS Статья PubMed Google Scholar
Caldwell, A. S. et al. Характеристика репродуктивных, метаболических и эндокринных особенностей синдрома поликистозных яичников на моделях самок гиперандрогенных мышей. Эндокринология 155 , 3146–3159. https://doi.org/10.1210/en.2014-1196 (2014).
CAS Статья PubMed Google Scholar
Taieb, J. et al. FSH и его второй мессенджер цАМФ стимулируют транскрипцию человеческого антимюллерова гормона в культивируемых клетках гранулезы. Мол. Эндокринол. 25 , 645–655. https://doi.org/10.1210/me.2010-0297 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Pierre, A. et al. Потеря индуцированного ЛГ подавления экспрессии рецепторов антимюллерова гормона может способствовать ановуляции у женщин с синдромом поликистозных яичников. Hum. Репрод. 28 , 762–769. https://doi.org/10.1093/humrep/des460 (2013).
CAS Статья PubMed Google Scholar
Durlinger, A. L. et al. Антимюллеров гормон ослабляет действие ФСГ на развитие фолликулов в яичнике мыши. Эндокринология 142 , 4891–4899. https://doi.org/10.1210/endo.142.11.8486 (2001).
CAS Статья PubMed Google Scholar
Pellatt, L. et al. Антимюллеров гормон снижает чувствительность фолликулов к фолликулостимулирующему гормону в клетках гранулезы человека. Fertil. Стерил. 96 , 1246-1251.e1241. https://doi.org/10.1016/j.fertnstert.2011.08.015 (2011).
CAS Статья PubMed Google Scholar
Dewailly, D. et al. Взаимодействие между андрогенами, ФСГ, антимюллеровым гормоном и эстрадиолом во время фолликулогенеза в нормальных и поликистозных яичниках человека. Hum. Репрод. Обновление 22 , 709–724. https://doi.org/10.1093/humupd/dmw027 (2016).
CAS Статья PubMed Google Scholar
Cimino, I. et al. Новая роль антимюллерова гормона в регуляции возбудимости нейронов ГнРГ и секреции гормонов. Nat. Commun. 7 , 10055. https://doi.org/10.1038/ncomms10055 (2016).
ADS CAS Статья PubMed PubMed Central Google Scholar
Сильва, М. С. и Джакобини, П. Новое понимание роли антимюллерова гормона в гипоталамо-гипофизарно-гонадной оси и нейроэндокринном развитии. Cell Mol. Life Sci. https://doi.org/10.1007/s00018-020-03576-x (2020).
Артикул PubMed PubMed Central Google Scholar
Pigny, P. et al. Повышенный уровень антимюллерова гормона в сыворотке крови у пациентов с синдромом поликистозных яичников: связь с избытком фолликулов яичников и задержкой фолликулов. J. Clin. Эндокринол. Метаб. 88 , 5957–5962. https: // doi.org / 10.1210 / jc.2003-030727 (2003).
CAS Статья PubMed Google Scholar
Dewailly, D. et al. Согласование определений синдрома поликистозных яичников: количество фолликулов яичников и концентрации антимюллерова гормона в сыворотке сочетаются с маркерами гиперандрогении. J. Clin. Эндокринол. Метаб. 95 , 4399–4405. https://doi.org/10.1210/jc.2010-0334 (2010).
CAS Статья PubMed Google Scholar
Lv, P. P. et al. Роль антимюллерова гормона и тестостерона в росте фолликулов: перекрестное исследование. BMC Endocr. Disord. 20 , 101. https://doi.org/10.1186/s12902-020-00569-6 (2020).
CAS Статья PubMed PubMed Central Google Scholar
Crisosto, N. et al. Индуцированное тестостероном подавление экспрессии антимюллерова гормона в гранулезных клетках малых фолликулов крупного рогатого скота. Эндокринная 36 , 339–345. https://doi.org/10.1007/s12020-009-9227-6 (2009).
CAS Статья PubMed Google Scholar
Caanen, M. R. et al. Уровень антимюллерова гормона снижается у транссексуалов, переходящих от женщины к мужчине, использующих тестостерон в качестве терапии межполого секса Fertil. Стерил. 103 , 1340–1345. https://doi.org/10.1016/j.fertnstert.2015.02.003 (2015).
CAS Статья PubMed Google Scholar
Li, Y., Wei, L. N. & Liang, X. Y. Фолликулостимулирующий гормон подавлял чрезмерное производство антимуллерного гормона, вызванное аномально повышенной активностью промотора в клетках гранулезы синдрома поликистозных яичников. Fertil. Стерил. 95 , 2354–2358. https://doi.org/10.1016/j.fertnstert.2011.03.047 (2011).
CAS Статья PubMed Google Scholar
Сунь, Б., Ван, Ф., Сун, Дж., Ю, В.& Sun, Y. Базальные уровни тестостерона в сыворотке коррелируют с реакцией яичников, но не предсказывают исход беременности у женщин без СПКЯ, подвергающихся ЭКО. J. Assist. Репрод. Genet. 31 , 829–835. https://doi.org/10.1007/s10815-014-0246-8 (2014).
Артикул PubMed PubMed Central Google Scholar
Qin, Y. et al. Связь базального уровня тестостерона в сыворотке с ответом яичников и исходом экстракорпорального оплодотворения. Репродукция. Биол. Эндокринол. 9 , 9. https://doi.org/10.1186/1477-7827-9-9 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Lu, Q. et al. Низкий уровень тестостерона у женщин с нарушением резерва яичников снижает частоту имплантации эмбрионов: ретроспективное исследование случай-контроль. J. Assist. Репрод. Genet. 31 , 485–491. https://doi.org/10.1007 / s10815-014-0186-3 (2014).
Артикул PubMed PubMed Central Google Scholar
Walters, K. A. et al. Профили стероидов с помощью жидкостной хроматографии-масс-спектрометрии согласованной сыворотки и фолликулярной жидкости с одним доминирующим яичником от женщин, перенесших ЭКО. Репродукция. Биомед. Онлайн 38 , 30–37. https://doi.org/10.1016/j.rbmo.2018.10.006 (2019).
CAS Статья PubMed Google Scholar
Новента, М. и др. Терапия тестостероном для женщин с плохим ответом яичников на ЭКО: метаанализ рандомизированных контролируемых исследований. J. Assist. Репрод. Genet. 36 , 673–683. https://doi.org/10.1007/s10815-018-1383-2 (2019).
Артикул PubMed PubMed Central Google Scholar
Zhang, Y. et al. Стратегии адъювантного лечения при стимуляции яичников для плохо реагирующих на ЭКО пациентов: систематический обзор и сетевой метаанализ. Hum. Репрод. Обновление 26 , 247–263. https://doi.org/10.1093/humupd/dmz046 (2020).
CAS Статья PubMed Google Scholar
Шарп А., Морли Л. С., Танг Т., Норман Р. Дж. И Бален А. Х. Метформин для индукции овуляции (за исключением гонадотропинов) у женщин с синдромом поликистозных яичников. Кокрановская база данных Syst. Ред. 12 , 13505. https://doi.org/10.1002/14651858.Cd013505 (2019).
Артикул Google Scholar
Pundir, J. et al. Лечение инозитом ановуляции у женщин с синдромом поликистозных яичников: метаанализ рандомизированных исследований. BJOG 125 , 299–308. https://doi.org/10.1111/1471-0528.14754 (2018).
CAS Статья PubMed Google Scholar
Auchus, R.J. Стероидные анализы и эндокринология: лучшие практики для фундаментальных ученых. Эндокринология 155 , 2049–2051. https://doi.org/10.1210/en.2014-7534 (2014).
CAS Статья PubMed PubMed Central Google Scholar
Комитет практики Американского общества репродуктивной медицины. Электронный адрес, а. а. о. Определения бесплодия и повторного невынашивания беременности: мнение комитета. Fertil. Стерил. 113 , 533–535, DOI: https: //doi.org/10.1016/j.fertnstert.2019.11.025 (2020).
Poseidon, G. et al. Новая более подробная стратификация лиц с низким ответом на стимуляцию яичников: от плохого ответа яичников до концепции низкого прогноза. Fertil. Стерил. 105 , 1452–1453. https://doi.org/10.1016/j.fertnstert.2016.02.005 (2016).
Артикул Google Scholar
Lauritsen, M. P. et al. Распространенность синдрома поликистозных яичников в нормальной популяции в соответствии с Роттердамскими критериями по сравнению с пересмотренными критериями, включая антимюллеровский гормон. Hum. Репрод. 29 , 791–801. https://doi.org/10.1093/humrep/det469 (2014).
CAS Статья PubMed Google Scholar
Белок антимюллерова гормона (AMH) от EUPROTEIN INC
- Дом
- Продукты
- Рекомендуемый белок
- Антимюллеров гормон (AMH)
EUPROTEIN разработал высококачественные биоактивные белки AMH человека, которые могут быть использованы для разработки диагностических тестов AMH.Распродажа! Всего 399 долларов за 25ug
Фиг.1. Белок AMH человека (EPY49921) из клеток человека 293.Рис. 2. Белок AMH человека (EPY49921C) из клеток CHO.
Фон
Ген антимюллерова гормона ( AMH ), также известный как гормон, ингибирующий Мюллеров ( MIH ), фактор ингибирования Мюллера ( MIF ), субстанция, ингибирующая Мюллеров ( MIS )), кодирует секретируемый лиганд суперсемейства белков TGF-бета (трансформирующий фактор роста бета).Гормон АМГ вырабатывается репродуктивными тканями, включая яички у мужчин и яичники у женщин. Роль АМГ и его количество обычно варьируется в зависимости от пола и возраста.
АМГ важен для женщины в детородном возрасте. При рождении у самки есть около миллиона яйцеклеток (ооцитов), количество которых затем естественным образом уменьшается в детстве до примерно 500000. Только крошечное количество этих оставшихся яйцеклеток пройдет созревание фолликула — по одной в рамках ежемесячного менструального цикла женщины.АМГ оказывает балансирующее влияние на ежемесячные циклические действия фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) в процессе созревания и высвобождения яйцеклетки (овуляции). Количество присутствующего АМГ является отражением роста фолликулов.
Тест AMH часто используется для оценки статуса фертильности женщины, поскольку уровень AMH оказался полезным для определения оставшегося у женщины потенциала созревания яйцеклеток (овариального резерва) и ее вероятности зачатия. АМГ снижается с течением времени в детородном возрасте, значительно снижается по мере приближения менопаузы и обычно становится почти не обнаруживаемым после менопаузы.Следовательно, уровень АМГ также может быть полезен для прогнозирования наступления менопаузы.
Повышенный уровень АМГ был связан с состоянием, поражающим яичники, известным как синдром поликистозных яичников (СПКЯ). Избыточные фолликулы, возникающие при этом синдроме, производят аномально большое количество АМГ.
AMH также играет жизненно важную роль в половой дифференциации плода. В течение первых нескольких недель беременности у развивающегося ребенка есть потенциал для развития мужских или женских репродуктивных органов.Производство АМГ и андрогенов двумя яичками, присутствующими у мальчика, тормозит развитие женских репродуктивных органов и способствует формированию других мужских репродуктивных органов. Если во время этого процесса не доступно или отсутствует достаточное количество АМГ, то могут развиваться как мужские, так и основные женские органы.
УровеньАМГ может быть повышен при некоторых опухолях яичников (доброкачественных или злокачественных). Если опухоль вырабатывает гормон, то тест AMH можно использовать в качестве онкомаркера для контроля эффективности лечения и выявления рецидивов.
Применение AMH в диагностике
Анализ крови на уровень АМГ может быть использован для:
- Оценить фертильность женщины
- Предсказать начало менопаузы
- Узнайте причину ранней менопаузы
- Помогите выяснить причину аменореи, отсутствия менструации
- Помогите диагностировать синдром поликистозных яичников (СПКЯ), гормональное нарушение, которое является частой причиной женского бесплодия
- Осмотр младенцев с гениталиями, которые не идентифицируются как мужские или женские
- Наблюдать за женщинами, у которых есть определенные типы рака яичников
EUPROTEIN Предложение
EUPROTEIN разработал высококачественные биоактивные белки AMH человека, которые могут быть использованы для разработки диагностических тестов AMH.
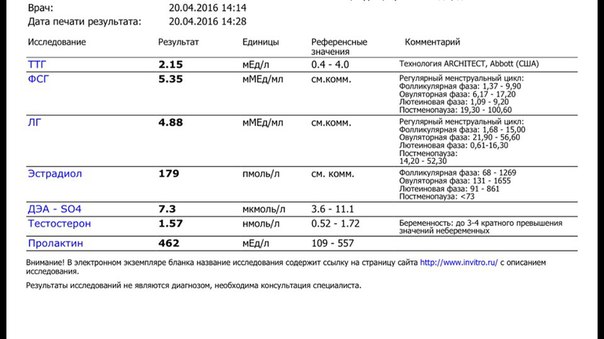 2010; 4: 7-8.
2010; 4: 7-8. J. Clin. Endocrinol. Metab. 2000; 85 (7): 2434-8.
J. Clin. Endocrinol. Metab. 2000; 85 (7): 2434-8. et al. The role of anti-Mullerian hormone assessment in assisted reproductive technology outcome. Curr. Opin. Obstet. Gynecol. 2010; 22: 193-201.
et al. The role of anti-Mullerian hormone assessment in assisted reproductive technology outcome. Curr. Opin. Obstet. Gynecol. 2010; 22: 193-201. , Poulat F et al. Steroidogenic Factor-1 regulates transcription of the human anti-Mullerian hormone receptor. J. Biol. Chemistry. 1998; 273 (45): 29654-60.
, Poulat F et al. Steroidogenic Factor-1 regulates transcription of the human anti-Mullerian hormone receptor. J. Biol. Chemistry. 1998; 273 (45): 29654-60. Endocrinology. 2002; 143: 1076-84.
Endocrinology. 2002; 143: 1076-84. O., Quinones M. J., Azziz R. et al. Polycystic ovary syndrome in Mexican-Americans: prevalence and association with the severity of insulin resistance. Fertil. Steril. 2005; 84 (3): 766-9.
O., Quinones M. J., Azziz R. et al. Polycystic ovary syndrome in Mexican-Americans: prevalence and association with the severity of insulin resistance. Fertil. Steril. 2005; 84 (3): 766-9. Fertil. Steril. 2013; 99 (5): 1305-10.
Fertil. Steril. 2013; 99 (5): 1305-10.
 A., Davies W. A., Lashen H. Antimüllerian hormone and pituitary gland activity after prolonged down-regulation with goserelin acetate. Fertil. Steril. 2006; 86: 1515-7.
A., Davies W. A., Lashen H. Antimüllerian hormone and pituitary gland activity after prolonged down-regulation with goserelin acetate. Fertil. Steril. 2006; 86: 1515-7. PLoS One. 2011; 6 (5): 20087.
PLoS One. 2011; 6 (5): 20087. , Jorgensen N., Graem N. et al. Expression of anti-Müllerian hormone during normal and pathological gonadal development: association with differentiation of Sertoli and granulosa cells. J. Clin. Endocrinol. Metabol. 1999; 84: 3836-44.
, Jorgensen N., Graem N. et al. Expression of anti-Müllerian hormone during normal and pathological gonadal development: association with differentiation of Sertoli and granulosa cells. J. Clin. Endocrinol. Metabol. 1999; 84: 3836-44. Fertil. Steril. 2011; 95: 747-50.
Fertil. Steril. 2011; 95: 747-50. S., Coffler M. S., Malcom P. J., Chang R. J. Serum anti-Mullerian hormone concentrations are not altered by acute administration of follicle stimulating hormone in polycystic ovary syndrome and normal women. J. Clin. Endocrinol. Metabol. 2007; 92: 1871-14.
S., Coffler M. S., Malcom P. J., Chang R. J. Serum anti-Mullerian hormone concentrations are not altered by acute administration of follicle stimulating hormone in polycystic ovary syndrome and normal women. J. Clin. Endocrinol. Metabol. 2007; 92: 1871-14.